适应无血清培养的HEK293细胞系的培育
2012-08-30孟其麟李红梅田大勇仇华吉
孟其麟,孙 元,李红梅,王 楠,田大勇,仇华吉*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨 150001;2.延边大学农学院动物医学系,吉林延吉 130001)
血清为血浆去除纤维蛋白的一种复杂混合物,其组成成份包括碳水化合物、血浆蛋白、多肽、脂肪、生长因子、激素、无机物等,这些物质为细胞生长提供营养物质,其中的激素、生长因子、转运大分子的结合蛋白以及促接触和伸展因子对细胞贴壁具有重要作用。
在常规细胞培养中,血清是一种必需成分,但仍存在一些问题。如不同批次之间差异较大[1-2];对于大多数细胞,血清并不是它们在体内增殖的常规环境,只有在组织损伤愈合以及血液凝固过程中才接触血清,因此有些细胞体外使用血清有可能会改变其在体内的正常状态[3]。
无血清培养作为一种细胞大规模培养方案,在避免上述缺点的同时,还有一些新的特性,例如培养液成分明确,不同批次之间各成分含量无差异等,这些特性提高了培养基的稳定性和实验数据的一致性,并简化了纯化和下游加工的过程;另外,无血清培养基不含动物源性大分子蛋白,避免了细胞水平和机体内不必要的相互作用(如疫苗接种过敏[3])。
近年来,重组腺病毒载体作为一种疫苗载体系统发展较快,但现行的腺病毒生产工艺存在产量低、提纯难、无法脱离血清培养等缺点[4-5]。
为解决以上问题,本研究以HEK293细胞为原始材料,培育了一株适应无血清培养的细胞系,并对其病毒增殖特性和稳定性进行研究。
1 材料和方法
1.1 细胞、培养基、病毒株及主要试剂 HEK293
细胞系由本实验室保存;无血清培养液293SFM II、DMEM、FBS、GlutaMAXTM-1均购自Life Technology公司;细胞培养耗材均购自Corning公司;多聚赖氨酸(PDL)购自Sigma公司;rAdV-SFV-E2为携带甲病毒复制子载体、表达猪瘟病毒(CSFV)E2基因的重组腺病毒[6],由本实验室保存;抗猪瘟病毒E2蛋白单克隆抗体(MAb)HQ06为本实验室制备[7];FITC标记的兔抗猪IgG(FITC-IgG)购自Sigma公司。
1.2 培养方法 本实验采用分步适应的方法,使HEK293细胞适应无血清培养条件,具体步骤为:首先配制含10%FBS的DMEM作为正常细胞生长液。将10%FBS DMEM和293SFM II混合配制细胞适应液,并用不同配比的适应液培养细胞(表1)。

表1 适应液的配比及培养代数Table 1 Ratio formulas and passages
在适应过程中,根据细胞密度确定传代时间。细胞处于贴壁生长状态,前4个血清适应梯度的传代均采用胰酶消化,从第5个梯度开始改用弯头吸管将细胞从培养瓶表面吹下。待细胞完全适应无血清培养后,每次按2.5×105cell/mL~3.0×105cell/mL细胞浓度传代,于37℃、8%CO2条件下中培养。
1.3 培养条件的优化
1.3.1 细胞培养瓶的PDL处理PDL对细胞具有促贴壁作用,采用0.1 mg/mL的PDL于37℃孵育6 h对细胞培养瓶进行处理,并于4℃保存。
1.3.2 采用谷氨酰胺替代物代替谷氨酰胺以400 mmol/L L-丙氨酰-L-谷氨酰胺(GlutaMAXTM-1)代替L-谷氨酰胺加入培养液中,配制的培养液在37℃,8%CO2培养箱中预热后用于细胞培养。
1.4 细胞系的鉴定
1.4.1 形态学观察每代细胞传代24 h后观察细胞是否贴壁及其生长状态。
1.4.2 细胞稳定性将细胞连续传16代,72 h时观察细胞形态、密度,并接种病毒进行培养,72 h后收获病毒,并采用有限稀释法测定病毒滴度。
1.4.3 病毒外源蛋白的表达将适应无血清培养的HEK293细胞(命名为293SF)与普通HEK293细胞分别于6孔板中培养,并适当提高293SF的初密度,以使两种细胞生长速度同步;生长36 h后接种104TCID50/mL的重组腺病毒rAdV-SFV-E2[7],继续培养48 h后收获细胞,用4%甲醛固定20 min,0.2%Triton X-100透膜10 min;以抗CSFVE2蛋白MAb HQ06为一抗,兔抗猪FITC-IgG(1∶100)为二抗进行间接免疫荧光(IFA)鉴定。
2 结果
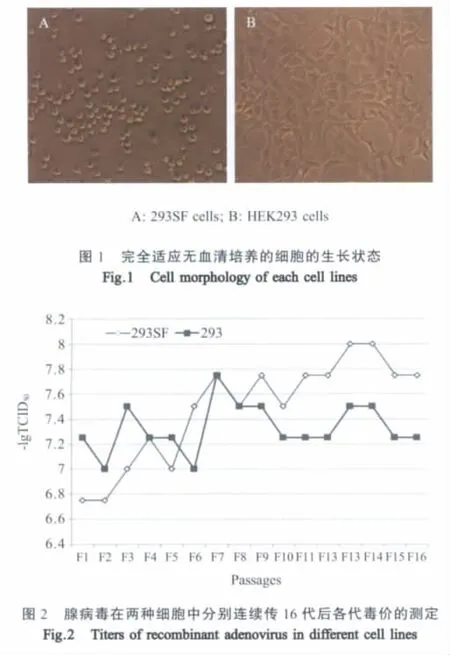
2.1 无血清培养293SF细胞的形态学 由Step1 F1代开始,每代细胞传代24 h后显微镜观察细胞形态和生长状态的变化。Step1 F1至Step4 F3细胞逐渐收缩变圆,转变为半贴壁状态,细胞分裂减慢,平均传代时间由48 h延长至96 h;到Step5 F2时,细胞开始变为悬浮状态;去除血清和DMEM成分后细胞生长速度加快,平均传代时间达到72 h左右,单个细胞呈透明圆形,胞质清亮,静止培养时呈现细胞团状,并且始终悬浮于培养液中。
2.2 细胞稳定性 将细胞连续传16代,培养72 h时观察细胞形态、密度。测定每代细胞的毒价(图2),期间统计完全病变所需时间。使用普通HEK293细胞培养,110.30 h±10.70 h病变完全,病毒价为107.32±0.54TCID50/mL;使用适应无血清培养的293SF细胞培养,97.00 h±11.50 h病变完全,毒价为107.48±0.71TCID50/mL。293SF细胞增殖腺病毒的能力比普通HEK293细胞提高43.3%,并且平均生产时间降低了12.9%。
2.3 蛋白表达情况 收获接种rAdV-SFV-E2 48 h的293SF和HEK293细胞,采用IFA方法检测E2蛋白表达情况。结果显示293SF细胞系在支持病毒复制的同时仍具有对外源蛋白的表达能力(图3)。

3 讨论
本研究采用目前较成熟的商品化细胞培养基,以渐进替换法培育了一株无血清培养的HEK293细胞系,最大限度地减少了培养条件对细胞的冲击,这对保持细胞株活性、降低细胞株变异等具有重要作用。由于该细胞系具有悬浮生长的特性,难以区分正常细胞与病变细胞,为评价支持腺病毒增殖的特性造成诸多不便。因此,在增殖腺病毒及测定病毒毒价过程中,我们采用PDL对细胞培养瓶进行处理,使无血清培养的细胞贴壁生长,大大提高了所测病毒毒价的准确性。
目前,有多种用于无血清培养的293细胞系,如GIBOC 293F、HEK-293 N3S[8-9]。本研究中采用的无血清细胞原材料(HEK293细胞系)与以上商品化细胞系相同,通过改进培育工艺和方法获得了本细胞系,它们在本质上没有区别,又能实现商品化细胞系的稳定性和实用性,同时为后期实验节约了资金,降低了疫苗的生产成本。
本研究中培育的无血清HEK293细胞系能在悬浮及贴壁状态下生长。由于无血清培养基中不含球蛋白、抗体等干扰腺病毒感染的组分,这大大降低了腺病毒的不必要损耗。病变时间由110 h缩短到97 h,同时产率平均提高了43.3%,可以降低腺病毒疫苗的生产成本,同时为腺病毒疫苗生产和加工提供了便利条件。
另外,由于高剂量接种腺病毒引起细胞快速裂解死亡,细胞中大部分未成熟病毒粒子未能组装成为具有感染性的完整病毒粒子,这会导致病毒毒量的下降。因此本研究采用低剂量腺病毒接种,在细胞病变初期采用IFA方法测定外源蛋白表达情况,既能避免腺病毒裂解作用对实验结果的影响,也能直观地对比腺病毒增殖对数期的蛋白表达情况。
无血清细胞培养技术一般应用于灌注培养、生物反应器等大规模培养方案,本研究建立的无血清细胞系仅在实验室水平上对其进行小规模培养和鉴定,下一步工作重点是将该细胞系用于较大规模培养,并对应用该细胞系生产的重组腺病毒疫苗进行免疫原性及免疫效力方面的评价。
[1]Zelphati O,Uyechi S,Barron G,et al.Effect of serum components on the physico-chem ical properties of cationic lipid/oligonucleotide complexes and on their interactions with cells[J].Biochim Biophys Acta,1998,1390(2):119-133.
[2]Mulcahy S,Sm ith R,Stacey W.Requirement for ras proto-oncogene function during serum-stimulated growth of NIH 3T3 cells[J].Nature,1985,313(5999):241-243.
[3]Perrin P,Madhusudana S,Gontier-Jallet C,et al.An experimental rabies vaccine produced w ith a new BHK-21 suspension cell culture process:use of serum-free medium and perfusion-reactor systerm[J].Vaccine,1995,13(13):1244-1250.
[4]Wessman J,Levings R.Benefits and risks due to animal serum used in cell culture production[J].Dev Biol Stand,1999,99:3-8.
[5]Lubiniecki S.Elim ination of serum from cell culture medium[J].Dev Biol Stand,1999,99:153-156.
[6]Sun Yuan,Li Hong-yu,Tian Da-yong,et al.A novel alphavirus replicon-vectored vaccine delivered by adenovirus induces sterile immunity against classical sw ine fever[J].Vaccine,2011,29(46):8364-8372.
[7]Peng Wu-ping,Hou Qiang,Xia Zhao-he,et al.Identification of a conserved linear B-cell epitope at the N-term inus of the E2 glycoprotein of classical swine fever virus by phage-displayed random peptide library[J].Virus Res,2008,135(2):267-272.
[8]Sun X,Hia C,Goh E,et al.High-density transient gene expression in suspension-adapted 293 EBNA1 cells[J].Biotechnol Bioeng,2008,99(1):108-116.
[9]田博,吴彬,张群伟,等.悬浮培养HEK-293 N3S细胞生产重组腺病毒Ad-GFP的实验研究[J].微生物学报,2007,23(5):915-918.
