鸭源鸡杆菌对SPF雏鸡的感染特性研究
2012-08-30李乔晶张九州常洪涛皇甫和平姚惠霞迪丽拜尔阿木提王川庆
李乔晶,张九州,杨 霞,常洪涛,王 珊,皇甫和平,姚惠霞,迪丽拜尔·阿木提,王川庆*
(1.河南农业大学牧医工程学院/禽病研究所动物传染病实验室,河南郑州 450002;2.新疆阿克苏职业技术学院,新疆阿克苏 843000)
鸡杆菌属(Gallibacterium)是巴氏杆菌科成员,该属包括溶血性巴氏杆菌(Pasteurella Haemolytica)、输卵管炎放线杆菌(Actinobacillus salpingitidis)、鸭巴氏杆菌(P.anatis)、鸭源鸡杆菌(G.anatis)、虎皮鹦鹉鸡杆菌(G.melopsittaci)、海藻糖发酵鸡杆菌(G.trehalosifermentans)和输卵管炎鸡杆菌(G.salpingitidis)7个种,其代表种是鸭源鸡杆菌[1-3]。鸭源鸡杆菌有溶血性鸭源鸡杆菌(G.anatis haemolytica,GAH)和鸭子鸭源鸡杆菌(G.anatis anatis)两个生物变型,而GAH在家禽的生殖系统内普遍存在,能引起产蛋鸡群的输卵管炎和腹膜炎[4-6]。目前,对于鸡杆菌尚缺乏有效的治疗药物,而且在鸡杆菌感染鸡群中治疗失败时有发生[3]。国内外学者曾对不同鸡群中鸡杆菌的感染情况及其分离物特性进行过详细报道[1-7],而关于鸡杆菌对雏鸡的感染性和致病性目前尚不清楚。因此,本实验用从自然病例分离纯化的鸡杆菌人工感染4日龄SPF雏鸡,通过形态学、PCR、荧光定量PCR和ELISA等方法分别对感染后SPF雏鸡的组织脏器和血清进行细菌分离鉴定和抗体水平检测,以便为鸡杆菌的流行病学、致病机理及防治研究等提供理论依据。
1 材料和方法
1.1 菌 株 鸡杆菌菌株(YU-PDS-RZ-1-SLG)由本实验室从某地自然感染鸡杆菌病鸡的输卵管中分离鉴定。取冻干菌种接种于血平板培养基,37℃培养18 h~20 h,挑取单个菌落接种于含5%犊牛血清的LB肉汤,37℃振摇培养18 h~20 h,进行平板菌落计数。
1.2 主要试剂 绵羊血琼脂平板购自郑州安图生物工程有限公司;DL2000 DNA Marker、rTaqDNA聚合酶、10×Buffer、dNTP、SYBR GreenⅠ染料均购自日本TaKaRa公司;自制鸭源鸡杆菌超声波裂解抗原;TMB、辣根过氧化物酶标记兔抗鸡IgG抗体(酶标二抗)均购自北京索莱宝科技有限公司;蛋白酶K购自Merck公司;细胞/组织基因组DNA提取试剂盒购自北京百泰克生物技术有限公司。
1.3 实验动物 20只1日龄SPF雏鸡购自乾元浩郑州生物药厂,隔离饲养,2日龄和3日龄时采人工感染组8只SPF雏鸡上颚裂和泄殖腔的棉拭子接种于血平板,均未检测出鸡杆菌。
1.4 感染试验 4日龄时,将20只SPF雏鸡随机分为3组:人工感染组8只,接种量为每只鸡腹腔注射鸡杆菌培养液0.5 ML(1.4×106cfu);阴性对照组6只,腹腔注射等量的无菌液体LB;同居组6只,不作处理。
1.5 临床观察 人工感染后观察SPF鸡临床症状、精神状况、饮水进食等情况。
1.6 人工感染组鸡与同居组鸡的细菌分离与PCR鉴定
1.6.1 细菌分离人工感染后第2 d开始连续90 d每日无菌采取人工感染组和对照组雏鸡上颚裂和泄殖腔的棉拭子接种于血平板分离细菌,从人工感染组分离出鸡杆菌后将同居组与人工感染组一起饲养,同时对同居组进行细菌分离。
1.6.2 PCR鉴定对分离纯化出的鸡杆菌用煮沸法[7]提取基因组DNA作为PCR反应的模板,参考文献[8-10]合成引物,序列如下:

其中rpoB-F和rpoB-R扩增的目的片段为560 bp;1133fgal和114r分别为鸡杆菌16S rRNA和23S rRNA基因特异性引物,扩增16S rRNA和23S rRNA的转录区间(ITS)的核酸序列,根据鸡杆菌中含1个或2个核糖体操纵子,扩增的2个片段分别为 790 bp、1 030 bp或 1 080 bp。
50μL PCR体系,反应程序为:95℃ 4 Min,25个循环,每个循环的反应参数:95℃30 s、55℃1min、72℃ 2m in, 72℃ 10 Min。
PCR产物经1%琼脂糖凝胶电泳分析。
1.7 抗体检测 人工感染第3 d、7 d、10 d、14 d、21 d、28 d、35 d、47 d、60 d、75 d、88 d、96 d采血,分离血清,用间接ELISA方法检测血清的抗体水平。
1.8 病料中细菌的荧光定量PCR检测 根据Gene-Bank中鸡杆菌GtxA基因序列,应用Primer Express软件设计合成荧光定量PCR引物,扩增片段为129bp,送郑州博兴生物科技有限公司合成。引物序列如下:

实验鸡于感染第96 d迫杀并采集心、肝、脾、肺、气管、十二指肠等组织进行细菌分离与荧光定量PCR检测。
1.9 组织病理学检查 采取人工感染组鸡的肝脏、肺脏和气管等组织,10%中性福尔马林缓冲液处理,制作病理切片,HE染色,进行常规的组织学检查。
2 结果
2.1 临床观察 人工感染SPF鸡未出现明显的临床症状和肉眼损伤,同居组SPF鸡和对照组SPF鸡也没有观察到明显的临床症状和肉眼损伤;SPF鸡精神状况良好,饮水进食情况基本正常。
2.2 细菌的分离与PCR鉴定 在整个实验过程中,阴性对照组SPF鸡均未分离出鸡杆菌。人工感染组与同居组分别在人工感染后第3 d、同居第2 d持续到人工感染第96 d(即SPF鸡99日龄)迫杀可以连续从上颚裂分离出鸡杆菌;分离纯化出的鸡杆菌经特异PCR检测为阳性(图1)。
2.3 ELISA检测的SPF鸡血清抗体水平 检测结果表明,人工感染组与同居组SPF鸡抗体分别在人工感染后47 d和同居后32 d出现抗体高峰,而且仅持续2周~4周(图2)。从图2可以看出,人工感染组与同居组的抗体消长曲线基本一致,而且均高于对照组,差异显著(p<0.05);另外,在人工感染60 d时,人工感染组和同居组抗体滴度达到峰值。
2.4 不同组织内细菌分离和定量分析 剖检后心脏、肝脏、脾脏、肺脏、气管、十二指肠等组织内进行细菌分离和荧光定量PCR检测,对照组SPF鸡体内未分离出鸡杆菌,荧光定量PCR检测结果为阴性;人工感染组与同居组SPF鸡体内均分离出鸡杆菌,荧光定量PCR检测组织结果为阳性,通过定量结果可以看出,气管内细菌含量最高,达到106个/mg(表 1)。

2.5 不同组织的病理学检查 人工感染组鸡的肝脏、肺脏和气管均可见微观损伤。接种鸭源鸡杆菌的鸡可见气管上皮淋巴细胞浸润,间质性肺炎、支气管杯状细胞增生和支气管淋巴结增生,肺脏炎症细胞浸润(图3和图4),肝实质中有淋巴细胞和异嗜性白细胞浸润,肝细胞多病灶坏死,胆管增生,肝脏血管周围炎症细胞浸润。
3 讨论
目前,国内外关于鸭源鸡杆菌对SPF雏鸡的致病性研究鲜有报道,本研究选择SPF雏鸡为试验动物,采用人工感染方法对鸡杆菌的感染特性进行了初步研究。鸡杆菌的宿主非常广泛,除鸡外,鸭、鸽、雉、鹧鸪、鹦鹉和鹅等均易感[11-12],给养禽业造成经济损失。Bojesen等将鸭源鸡杆菌腹腔注射于商品鸡,正常免疫状态下,在接种部位表现出不同程度的局部化脓性腹膜炎,而免疫抑制鸡的整个腹膜甚至连腹腔器官都呈现出化脓性腹膜炎[13],这与先前描述的自然感染结果相似,可以成为鸡杆菌毒力因子和发病机制研究的有用感染模型,因此本试验的接种途径选择了腹腔接种。
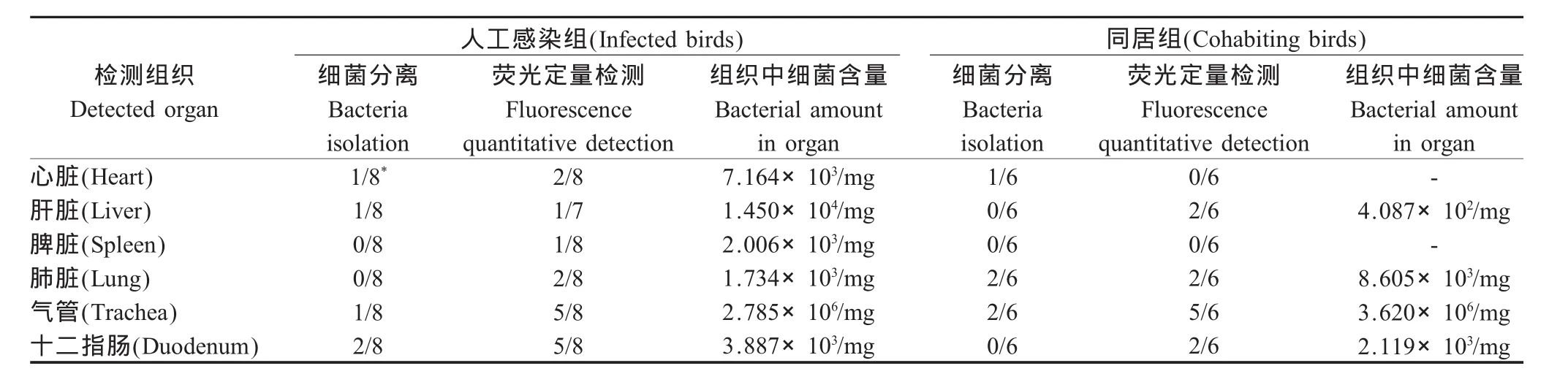
表1 SPF鸡不同组织内细菌分离和荧光定量检测比较Table 1 Comparison of bacteria isolation and fluorescence quantitative detection in SPF chickens'different organs

图3 鸡感染鸭源鸡杆菌的微观损伤(肺脏,炎症细胞浸润)Fig.3 Microscopic lesions in Gallibacterium anatis infected chicken(Lung,infiltration of lymphocytic inflammatory cells)
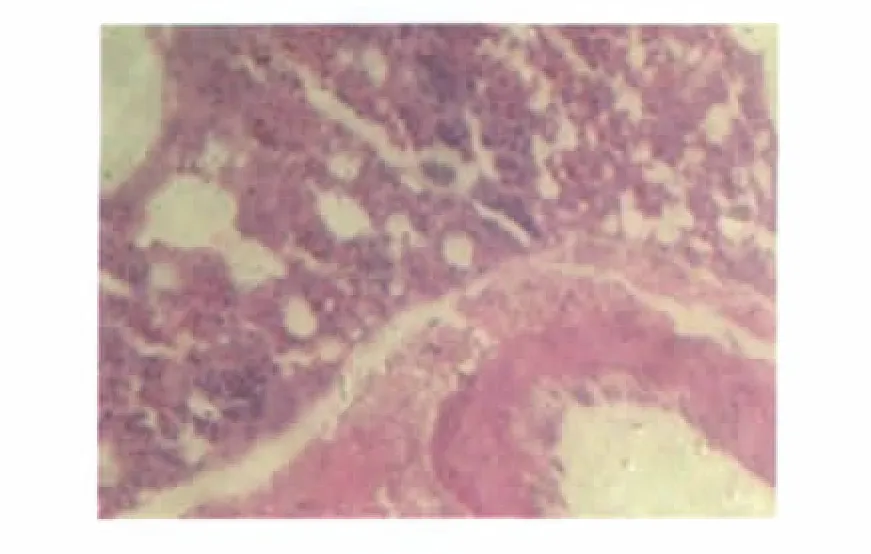
图4 鸡感染鸭源鸡杆菌的微观损伤(肺脏,炎症细胞浸润)Fig.4 Microscopic lesions in Gallibacterium anatis infected chicken(Lung,infiltration of lymphocytic inflammatory cells)
有文献报道,腹腔注射溶血性巴氏杆菌(目前已经划分为鸡杆菌属)不感染1日龄雏鸡,而且溶血性巴氏杆菌仅能从大于4周龄的鸡体内分离出来[11],但本实验的结果表明,SPF雏鸡在4日龄时即可人工感染鸡杆菌,这与以往的报道不一致。本实验将鸭源鸡杆菌接种于SPF鸡,没有明显的眼观症状,然而组织病理学检查发现,在所有感染鸡中,气管、肺、气囊和肝脏出现了不同程度的病理损伤,与Zepeda等[14]的研究结果一致。
鸡杆菌血清抗体ELISA检测结果中,对照组在第一次检测时,抗体水平就较高,可能是非特异性吸附的结果;检测结果表明鸡杆菌抗体产生很慢,直到人工感染后35 d才可检测到,而且持续时间很短,仅为2~4周,这与沙门氏菌、巴氏杆菌等病原的免疫特点很相似[15-16]。荧光定量PCR检测结果表明,人工感染组和同居组SPF鸡的气管内细菌含量最高,这可能是SPF鸡通过排菌二次感染、呼吸道水平传播所致;尽管本实验通过腹腔注射人工感染SPF鸡,但从肝脏中也分离出了鸭源鸡杆菌,此外组织学检查的肝脏损害等均表明鸭源鸡杆菌可能引起菌血症,通过血液而传播至全身,这与Zepeda等[14]报道的一致。由于菌血症可使细菌从泄殖腔排出[7],从而导致二次感染。另外,对于同居感染鸡究竟是经呼吸道还是消化道感染,或者是两者兼而有之尚不清楚,有待进一步研究。
致谢:感谢河南农业大学禽病研究所的老师和同学提供的技术支持与帮助,感谢贺秀媛老师与其学生提供的帮助。
[1]Christensen H,Bisgaard M,Bojesen A M,et al.Genetic relationships among avian isolates classified asPasteurella haemolytica,'Actinobacillus salpingitidis'orPasteurella anatisw ith proposal ofGallibacterium anatisgen.nov.,comb.nov.and description of additional genomospecies withinGallibacteriumgen.nov[J].Int JSyst Evol Microbiol,2003,53:275-287.
[2]Bisgaard M,Korczak B,Busse H,et al.Classification of the taxon 2 and taxon 3 complex of Bisgaard w ithinGallibacteriumand description ofGallibacterium melopsittacisp.nov.,Gallibacterium trehalosifermentanssp.nov.andGallibacterium salpingitidissp.nov[J].Int J Syst Evol Microbiol,2009,59:735-744.
[3]Bojesen A M,Vazquez ME,Bager R J,et al.Antim icrobial susceptibility and tetracycline resistance determinant genotyping ofGallibacteriumanatis[J].Vet Microbiol,2011,148(1):105-110.
[4]Bojesen A M,Christensen H,Nielsen O L,et al.Detection ofGallibacteriumspp.in chickens by fluorescent 16S rRNAin situhybridization[J].JClin Microbiol,2003,41(11):5167-5172.
[5]Jordan F T W,W illiams N J,Wattret A,et al.Observations on salpingitis peritonitis and salpingoperitonitis in a layer breeder flock[J].Vet Rec,2005,157:573-577.
[6]Neubauer C,De Souza-Pilz M,Bojesen A M,et al.Tissue distribution of haemolyticGallibacterium anatisisolates in laying birds w ith reproductive disorders[J].Avian Pathol,2009,38(1):1-7.
[7]郑鹿平,杨霞,陈陆,等.45株鸡卡氏杆菌的分离鉴定[J].中国兽医学报,2010,30(3):347-351.
[8]Korczak B,Christsen H,Em ler S,et al.Phyolgeny of the family Pasteurellaceae based on rpoB sequences[J].Int JSyst Evol Microbiol,2004,54:1393-1399.
[9]Bojesen A M,Vazquez ME,Robles F,et al.Specific identification ofGallibacteriumby a PCR using primers targeting the 16S rRNA and 23S rRNA genes[J].Vet Microbiol,2007,123:262-268.
[10]HuangFu He-ping,Wang Chuan-qing,Chen Lu,et al.Molecular Identification ofGallibacteriumfrom Hen and Analysis of Its 16S rRNA Gene[J].Agricul Sci Techn,2009,10(1):43-46,55.
[11]Bisgaard M.Incidence ofPasteurella haemolyticain the respiratory tract of apparently healthy chickens and chickens with infectious bronchitis.characterisation of 213 strains[J].Avian Pathology,1977,6(4):285-292.
[12]Addo P B,Mohan K.AtypicalPasteurella haemolyticatype A from poultry[J].Avian Dis,1984,29(5):214-217.
[13]Bojesen A M,Nielsen O L,Christensen JP,et al.In vivostudies ofGallibacterium anatisinfection in chickens[J].Avian Pathol,2004,33(2):145-152.
[14]Zepeda V A,Calderon-Apodaca N L,Paasch ML,et al.Histopathologic findings in chickens experimentally infected withGallibacterium anatisby nasal instillation[J].Avian Dis,2010,54(4):1306-1309.
[15]刘军,刘家彦,宋克磊,等.人工感染鸡白痢菌抗体消长规律的试验研究[J].畜牧兽医科技信息,2006,5:16-17.
[16]刘亚刚,刘内生,岳华,等.安宁河流域鸭瘟、鸭霍乱综合防制研究-免疫鸭体内巴氏杆菌抗体消长规律[J].中国兽医学报,1998,1:60-63.
