蛋白激酶C在晚期糖基化终产物促进人腹膜间皮细胞分泌纤维连接蛋白中的作用*
2012-08-30洪富源黄一新
洪富源,孙 芳,刘 军,姚 建,黄一新
(1.福建医科大学省立临床学院,福建省立医院肾内科,福州 350001;2.上海市第一人民医院肾内科,上海 200080)
腹膜病理研究发现,长期腹膜透析后,腹膜间皮细胞下致密胶原层进行性增厚,有相当多的证据表明长期腹膜透析后腹膜的这些改变和腹透液的生物不相容性有关,而缓冲液的组成、糖、糖降解产物是腹透液生物相容性最关键性的因素[1]。长期腹膜透析后患者腹膜长期暴露在含有高糖及含有葡萄糖降解产物的腹透液中,导致晚期糖基化终末产物(advancedglycosylation end products,AGEs)的积聚,这意味着腹膜长期受到AGEs的作用。有研究发现腹膜基质的主要组成成分层连蛋白的表达水平与AGEs的沉积呈明显正相关,转化生长因子-β(TGF-β)等促纤维化细胞因子在腹膜上的表达与AGEs的表达强度一致[2]。AGEs是否能够促进腹膜间皮细胞合成细胞外基质,是否参与长期腹透的腹膜纤维化过程目前尚不清楚。
本研究中我们采用体外人腹膜间皮细胞(human peritoneal mesothelial cells,HPMC)培养模型,观察晚期糖基化人血清白蛋白(AGE-HSA)对HPMC合成纤维连接蛋白(FN)和PKC活性的影响。并且应用PKC激动剂PMA和PKC特异抑制剂Calphostin C进行干预,探讨PKC信号通路在AGEs促进人腹膜间皮细胞分泌细胞外基质中的作用。
1 材料与方法
1.1 主要试剂
人血清白蛋白(human serum albumin,HSA,AMRESCO产品),D-葡萄糖(Sigma公司),DMEM、HEPES(GIBCO公司),小牛血清(上海普飞生物公司),佛波脂(PMA,Sigma公司),Calphostin C(Sigma公司),非放射性PKC测定试剂盒(日本MBL公司),纤维连接蛋白(FN)酶联免疫(ELISA)试剂盒(上海太阳生物技术公司),Trizol(Invitrogen公司),反转录试剂盒(Promega公司),dNTP(脱氧核苷酸)、Taq DNA聚合酶(Promega公司),FN、GAPDH引物(上海生物工程技术服务有限公司),SYBR Green I实时定量PCR试剂盒(大连宝生物TAKARA公司)。
1.2 AGE-HSA的制备
参照文献[3],将1.75 g/L纯化的HSA置于含或不含0.1 mol/L D-葡萄糖的0.4 mol/L磷酸盐缓冲液中,37℃孵育8周。用pH 7.4磷酸盐缓冲液透析以除去未结合的葡萄糖。以在同样条件但不含葡萄糖的磷酸盐缓冲液中孵育8周的HSA作为对照。体外制备的AGE-HSA经荧光分光光度法鉴定。
1.3 细胞培养
人腹膜间皮细胞株(HMrSV5)由TENON医院(法国)肾脏科肾脏病研究所Pierre RONCO教授馈赠。细胞生长于DMEM培养液(含10%胎牛血清,2 mmol/L的 L-谷氨酰胺)中,5%CO2、37℃条件下培养,常规换液。以第10~11代细胞作本试验。待细胞生长至70%~80%用于实验。
1.4 实验分组
A:对照组 HSA 500 μ g/ml;B:AGE-HSA 0 μ g/ml;C:AGE-HSA 100 μ g/ml;D:AGE-HSA 500 μ g/ml;E:AGE-HSA 1 000 μ g/ml;F:PMA 80 nmol/L;G:PMA 100 nmol/L孵育细胞 24 h后 +HSA 500 μ g/ml;H:PMA 100 nmol/L孵育细胞24 h后+AGE-HSA 500 μ g/ml;I:PMA 100 nmol/L孵育细胞24 h后+PMA 80 nmol/L;J:HSA 500 μ g/ml+calphostin C 100 nmol/L;K:AGE-HSA 500 μ g/ml+calphostin C 100 nmol/L;L:PMA 80 nmol/L+calphostin C 100 nmol/L。
1.5 HPMC细胞PKC活性测定
依照试剂盒说明进行细胞PKC提取及活性测定。各处理因素作用后,吸弃培养液,细胞用预冷的HBSS洗3次,用细胞刮刮下细胞,预冷的HBSS再洗2次,加入样品缓冲液,超声波细胞破碎仪破碎细胞4次,每次5 s,63 000×g 4℃离心90 min,沉淀部分用含1.0%Triton-X-100的样品缓冲液溶解,在4℃的摇床上摇动30 min,匀质液用样品缓冲液稀释到Triton-X-100的终浓度为0.5%,63 000×g离心15 min,上清液用作胞膜PKC激酶样品。用ELISA法测定各组PKC活性,以Bio-Rad550型酶标仪测定A490反映PKC活性大小。实验均设复孔,重复3次,取其均值。
1.6 荧光实时定量PCR
RNA抽提和逆转录按Trizol试剂说明书抽提不同组HPMC总RNA。按标准步骤进行逆转录,所得cDNA进行下步实验。Real-time PCR反应总体系25 μ l,包括双蒸水 9.5 μ l,cDNA 2 μ l,SYBR green realtime PCR master mix 12.5 μ l,上下游引物 各 0.5 μ l。FN 正链引物 5′AATATCTCGGTGCCATTTGC3′;负链引物 5′AAAGGCATGAAGCACTCAAT3′GAPDH 正链引物5′CAGGGCTGCTTTTAC3′;负链引物 5′GGGTGGAATCATATTGG3′。FN反应条件:95℃预变性 30 s,随后40循环,包括95℃变性5 s,60℃退火并延伸30 s。每个基因设3复孔,实验重复3次。采用△△Ct=(Ct目标基因-Ct内标)已处理-(Ct目的基因-Ct内标)未处理,检测样品经刺激后,其目的基因表达量相对于样品原始状态分别称为已处理样品和未处理样品。首先使用内标基因GAPDH对模板进行均一化处理,对于未处理样品△△Ct=0,而20=1,所以未处理样品的倍数变化为l,而对于已处理样品相对于对照样品的基因表达的倍数为 2-△△Ct,故2-△△Ct即为半定量指标。
1.7 ELISA方法检测细胞上清液中纤维连接蛋白的分泌
以1×105cells/well细胞密度接种24孔板,细胞80%~90%融合时换无血清培养基孵育24h使细胞同步化,加入上述各实验分组孵育细胞24 h,收集细胞上清液,以4℃,3000 r/min离心5min,弃细胞碎片,-80℃保存待测,同时对每孔细胞以胰蛋白酶消化后进行细胞计数。设6个复孔,ELISA检测严格按照试剂盒操作,所得数据以细胞数进行校正。
1.8 统计学分析
2 结果
2.1 AGE-HSA对人腹膜间皮细胞PKC活性的影响
2.1.1 AGE-HSA作用的时效关系 以AGE-HSA 500 μ g/ml作用 HPMC 0~ 120 min(图 1),AGE-HSA作用15 min,即可使胞膜PKC活性升高。PKC活性在60 min达最高值,是刺激前的3.340倍。120 min时PKC活性还未完全降至刺激前水平,与对照组相比差异有显著意义(P<0.05)。
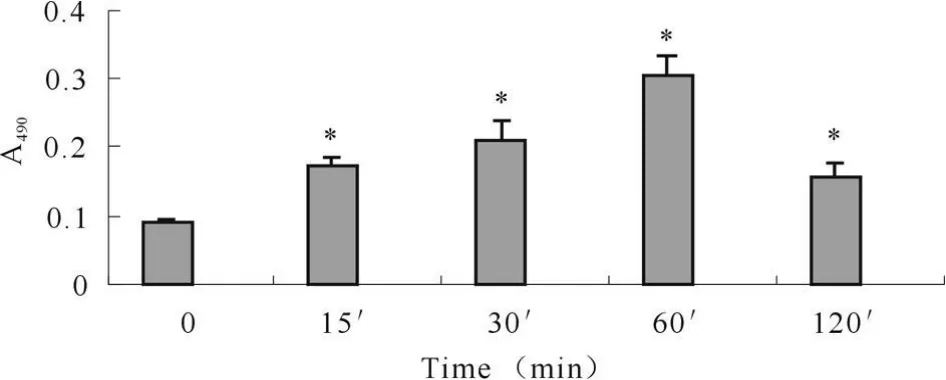
Fig.1 Time-dependent manners of AGE-HSA on PKC activitiesin HPMC
2.1.2 AGE-HSA作用的量效关系 HSA(500 μ g/ml)AGE-HSA(100 μ g/ml、500 μ g/ml、1 000 μ g/ml)作用60 min对胞膜PKC活性影响结果显示:100 μ g/ml AGE-HSA对胞膜PKC活性无明显影响,随AGEHSA浓度增加PKC活性逐渐增强(P<0.05,图2)。
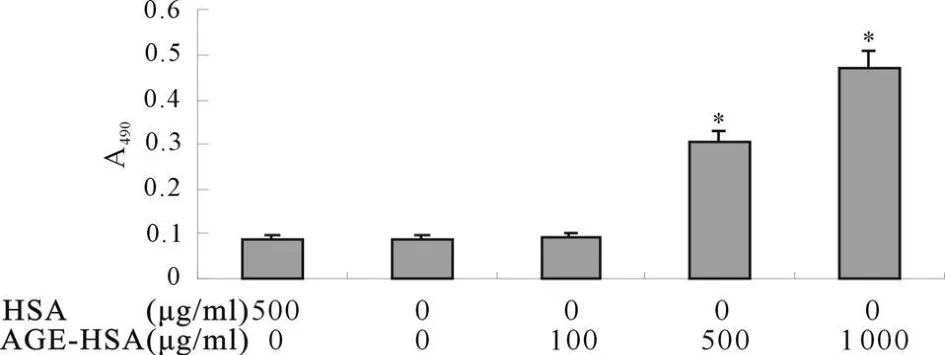
Fig.2 Dose-dependent manners of AGE-HSA on PKC activitiesin HPMC
2.2 AGE-HSA对人腹膜间皮细胞纤维连接蛋白mRNA的影响
AGE-HSA(0、100、500、1 000 ug/ml)作用HPMC 8 h的量效关系图可知,随着AGE-HSA刺激量的增加,HPMC的FN mRNA表达量也增加,呈量效关系;AGE-HSA 500 μ g/ml就 可以明 显促进 FN mRNA 表达,是空白对照组的(3.184±0.736)倍,1 000 μ g/ml AGE-HSA可使FN mRNA表达量进一步增加为是空白对照组的(4.016±1.216)倍(P<0.01,图3)。500 μ g/ml AGE-HSA 作用(0、4、8、12 h)的时效关系图显示,HPMC的FN mRNA表达量在8 h达到最大值,并至少持续到12 h,为空白对照组的(2.014±0.567)倍(P<0.01,图4)。
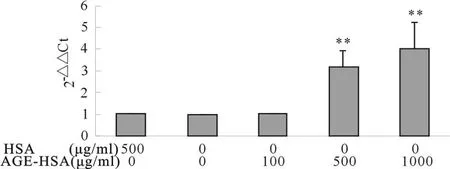
Fig.3 Dose-dependent manners of AGE-HSA on FN mR NA expression of HPMC
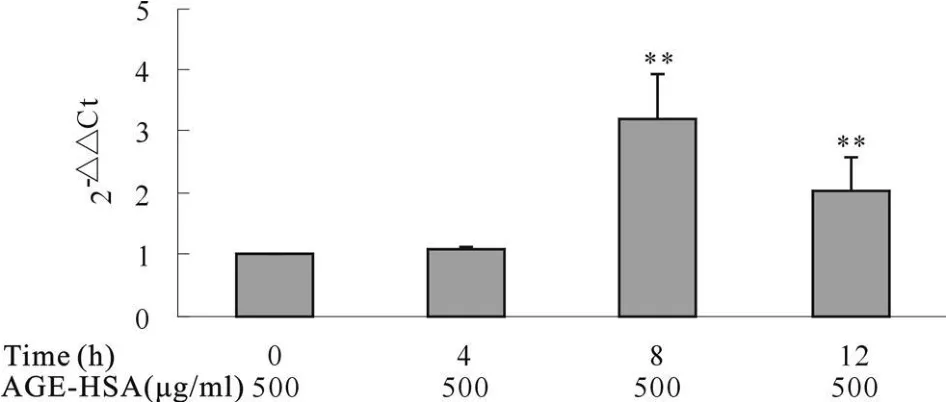
Fig.4 Time-dependent manners of AGE-HSA on FN mR NA expression of HPMC
2.3 AGE-HSA对人腹膜间皮细胞合成和分泌纤维连接蛋白的影响
500 μ g/ml AGE-HSA刺激细胞 24 h后,FN合成和分泌明显增加,为(128.8±8.6)ng/(ml·106cells)(P<0.05),并呈现良好的剂量依赖效应,1 000 μ g/ml AGE-HSA可使FN的合成和分泌增加至(153.5±10.7)ng/(ml·106cells)(P<0.01,图 5)。
2.4 蛋白激酶C(PKC)参与AGE-HSA诱导人腹膜间皮细胞合成和分泌纤维连接蛋白
500 μ g/ml AGE-HSA 和 80 nmol/L PMA 能够促进HPMC分泌细胞ECM 成份FN(P<0.05),用PKC激动剂佛波脂(PMA 100 nmol/L)孵育24 h耗竭细胞内PKC后,AGE-HSA、PMA不能促进HPMC分泌FN,PKC特异抑制剂calphostin C 100 nmol/L可以抑制AGE-HSA诱导的FN分泌。这说明PKC途径参与了AGE-HSA促进HPMC分泌FN(图6)。
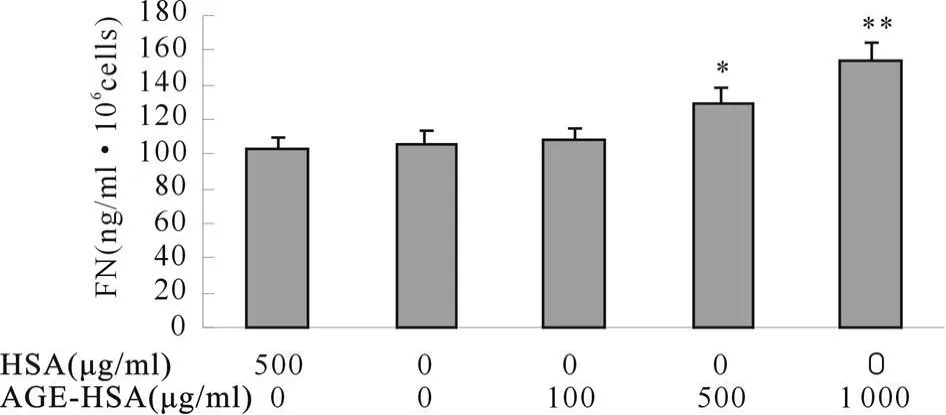
Fig.5 HSA and AGE-HSA on FN secretions of HPMC
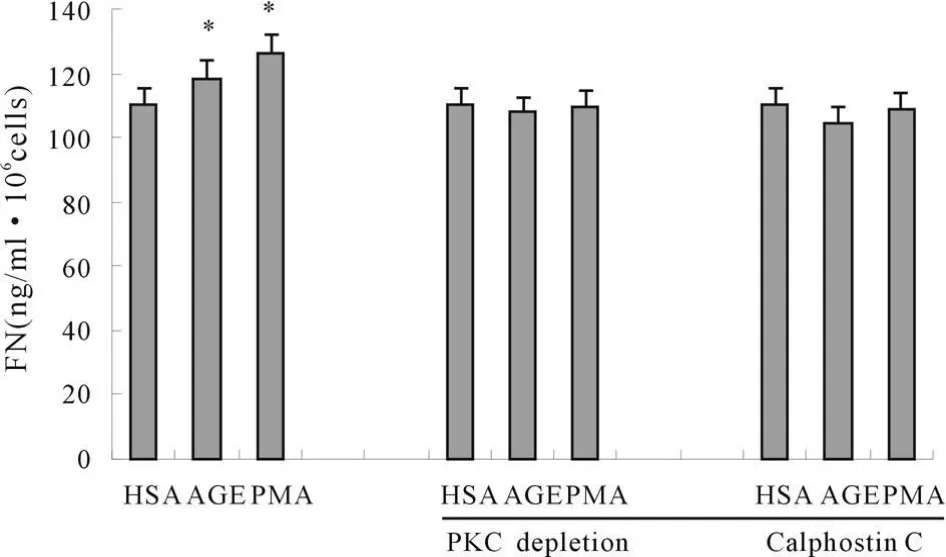
Fig.6 Effects of PKC on the AGE-HSA-stimulated secretions of FN in HPMC HSA 500 μ g/ml,AGE-HSA 500 μ g/ml,PMA 100 nmol/L,Calphostin C 100 nmol/L
3 讨论
腹膜透析,特别是持续性不卧床腹膜透析,是一种有效治疗终末期肾脏疾病患者的方法。但近年来大量实验和临床研究发现,长期和反复使用以葡萄糖为基础的腹透液进行腹膜透析患者会出现腹膜纤维化,超滤失败,最终放弃腹膜透析[4]。腹透相关性腹膜纤维化的主要组织学改变是腹膜间皮细胞层完整性破坏和间皮下基质成分堆积两方面。在基础状态下,人腹膜间皮细胞能够合成和分泌各种细胞外基质蛋白,如纤维连接蛋白、层粘连蛋白、Ⅰ型胶原、Ⅲ型胶原、Ⅳ型胶原等[5]。纤维连接蛋白(FN)是一种间质型的基质成分,其生成的增多提示间皮细胞细胞外基质分泌增加[6]。长期腹膜透析后,有大量的AGEs沉积腹膜上。在体内,腹膜上AGEs本身也可能刺激间皮细胞基质的表达,如腹膜基质的主要组成成分层连蛋白的表达水平与AGEs的沉积呈明显正相关,AGEs诱导腹膜间皮细胞合成基质增加,从而造成基质蛋白大量堆积或基质成分被AGEs修饰而发生结构改变,导致腹膜硬化。而且沉积于腹膜的AGEs还可刺激单核巨噬细胞分泌TNF-α、IL-1、TGF-β、PDGF等,从而促进细胞外基质合成,导致腹膜纤维化[2]。我们在体外的研究发现:AGE-HSA以时间、浓度依赖的方式促进HPMC的细胞外基质成份FN mRNA和蛋白的表达。
然而,AGEs促进HPMC纤维连接蛋白合成增加的具体机制尚不清楚。Ha H等发现,细胞内PKC活化后,HPMC合成和分泌FN也随之增加,因此作者认为PKC途径参与了HPMC合成和分泌FN的过程[7,8]。PKC是一个至少由12种丝氨酸/苏氨酸激酶的同型异构体组成的家族,它对细胞的许多过程(从基本的、自主的细胞功能到生物功能如记忆)都有调节作用。在未受激活的细胞中,PKC存在于细胞质中活性很低,在与Ca2+、二酰基甘油等激动剂结合后即发生酶构象变化,PKC从胞浆移到胞膜或核内,从而被激活,因此本研究以胞膜的PKC作为酶活性的标志。我们的研究发现:随AGE-HSA浓度增加,PKC活性呈剂量依赖关系,500 μ g/ml AGEHSA作用于HPMC可迅速激活PKC,活性高峰在60 min,先用PKC激动剂PMA耗竭细胞内PKC后、或者用PKC特异抑制剂calphostin C后,HPMC合成和分泌FN表达减少了。因此我们认为,AGEs可能通过活化PKC,促进HPMC合成和分泌FN。目前已经证实活化的PKC可诱导原癌基因c-fos和c-jun的转录,而c-fos和c-jun通过AP-1链接位置基因转录,FN的启动区含有AP-1链接交感序列,故认为活化的PKC诱导AP-1可能是AGE-HSA上调FN合成的一种机制[7]。Lee BH等人还发现PMA诱导分泌的FN的主要基因序列位于-69和+136[9]。PKC活化后不仅促进FN的表达,在肾小球系膜细胞还会增加Ⅳ型胶原的转录活性。AGEs除了可以通过PKC途径合成FN外,在对大鼠系膜细胞的研究发现,AGE-BSA和CML-BSA通过活化TGF-beta-Smad信号通路促进FN合成[10]。
总之,AGEs可能部分通过激活人腹膜间皮细胞中的PKC,促进人腹膜间皮细胞合成和分泌FN,从而引起腹膜纤维化,最终导致腹膜失超滤。
[1]Davies S J,Mushahar L,Yu Z,et al.Determinants of peri-toneal membrane function over time[J].Semin Nephrol,2011,31(2):172-182.
[2]Boulanger E,Daroux M.Peritoneal aging during PD:implication of RAGE,the receptor for AGEs[J].Nefrologia,2008,28(Suppl 6):5-10.
[3]Takeuchi M,Bucala R,SuzukiT,et al.Neurotoxicity of advanced glycation end-products for cultured cortical neurons [J].J Neuropathol Exp Neurol,2000,59(12):1094-1095.
[4]Kim Y L.Update on mechanisms of ultrafiltration failure[J].Perit Dial Int,2009,29(Suppl 2):S123-127.
[5]Kim J J,Li JJ,Kim K S,et al.High glucose decreases collagenase expression and increases TIMP expression in cultured human peritoneal mesothelial cells[J].Nephrol Dial Transplant,2008,23(2):534-541.
[6]Yokoyama Y,Masaki T,Kiribayashi K,et al.15-Deoxy-Delta12,14-prostaglandin J2 inhibits angiotensin II-induced fibronectin expressionviahepatocyte growth factor induction in human peritoneal mesothelial cells[J].Ther Apher Dial,2010,14(1):43-51.
[7]Ha H,Yu M R,Lee H B.High glucose-induced PKC activation mediates TGF-beta 1 and fibronectin synthesis by peritoneal mesothelial cells[J].Kidney Int,2001,59(2):463-470.
[8]Lee H B,YuM R,Song JS,et al.Reactive oxygen species amplify protein kinase C signaling in high glucose-induced fibronectin expression by human peritoneal mesothelial cells[J].Kidney Int,2004,65(4):1170-1179.
[9]Lee BH,Kim M S,Rhew J H,et al.Transcriptional regulation of fibronectin gene by phorbol myristate acetate in hepatoma cells:a negative role for NF-kappaB[J].J Cell Biochem,2000,76(3):437-451.
[10]Fukami K,Ueda S,Yamagishi S,et al.AGEs activate mesangial TGF-beta-Smad signalingviaan angiotensin II type I receptor interaction[J].Kidney Int,2004,66(6):2137-2147.
