急性减压病大鼠肺组织粘附分子的变化*
2012-08-30包晓辰方以群
包晓辰,方以群,马 骏,孟 淼
(海军医学研究所,上海 200433)
随着深海石油及水下作业的开发,潜水在经济建设中的作用日益突出。但是潜水减压病限制了应用潜水技术的发展。减压病(decompression sickness,DCS)是机体在某一气压环境下,暴露一定时间后,由于减压不当导致机体组织内原来溶解的惰性气体游离为气相,形成气泡,从而导致的一系列病理反应的疾病[1]。目前对减压病的发病机理尚未完全了解,有文献认为血管内皮屏障的破坏、粘附分子及炎性介质的上调可能在减压病发病中起着重要作用[2]。为了解减压病时血管内皮屏障通透性及粘附分子的表达改变,我们设计了本实验。
1 材料与方法
1.1 实验动物
70只健康雄性SD大鼠购自上海西普尔毕凯实验动物有限公司,平均体重250 g,海军医学研究所动物饲养中心饲养。观察和检疫一周正常后进行实验。
1.2 主要试剂
大鼠种属特异性细胞间粘附分子-1(intercellular adhesion molecule-1,ICAM-1)、E-选择素(E-selectin)、主要组织相容性复合体-II(major histocompatibility complex class II molecule,MHC-II)抗体购自美国Santa Cruze公司。Evans Blue溶液及甲酰胺购自美国sigma公司。ABC试剂盒及DAB显色试剂盒购自上海生工生物工程技术服务有限公司。
1.3 急性减压病大鼠模型建立及评价
70只雄性 SD大鼠,随机分为四组:对照组、减压后30 min观测组、减压后6 h观测组、减压后24 h观测组。减压组大鼠置于加压舱内,舱底铺设新鲜钠石灰,压缩空气在3 min内匀速加压至0.7 MPa,停留60 min后,3 min内快速减压出舱。期间每隔20 min通风一次,每次1 min,保持舱内氧浓度在19%以上,二氧化碳浓度在相当于常压下的0.5%以下。出舱后观察急性减压病的症状,评价包括:行走困难、不正常的呼吸、前/后肢瘫痪及死亡。对照组大鼠也置于加压舱内,在1ATA下保持1 h。减压后30 min取出现减压病症状大鼠及对照组大鼠的肺、肝、脑组织,甲醛溶液固定、石蜡包埋、切片、HE染色后观察病理变化。
1.4 肺血管渗透性测定
在减压后6 h、24 h前30 min,每组取5只大鼠,尾静脉注射2%evans blue溶液(20 mg/kg)。30 min后,生理盐水进行灌注,取肺组织,观测组织蓝染程度。肺组织匀浆后溶于2倍体积的甲酰胺中,60℃孵育16 h后,5 000×g离心30 min,取上清液100 μ l加入96孔板中,分光光度计吸收波长620 nm分析;OD650/g(肺组织重量)的比值可用来衡量体内血管的渗透性。
1.5 免疫组化测定肺组织粘附分子表达
在减压后 30 min、6 h、24 h,每组取 5只大鼠,1%戊巴比妥钠麻醉后,生理盐水灌注后,4%多聚甲醛灌注固定。取肺组织,后固定1.5 h,10%蔗糖浸泡24 h,组织在恒冷箱切片机切14 μ m的切片。分别加入下列一抗ICAM-1(1∶25)、E-selectin(1∶250)、MHC-II(1∶100),4℃孵育 24 h,PBS冲洗后,加入种属特异性二抗(1∶200),室温孵育3~4 h,加入AB混合液后,室温孵育3 h,DAB显色、脱水、透明、封片。光镜下观测阳性表达率。
1.6 统计学分析
2 结果
2.1 急性减压病大鼠模型的建立
大鼠在不安全减压后均出现懒动、反应迟钝、呼吸急促的症状,少数大鼠出现肢体瘫痪。这些症状在减压后30 min内最为显著,其中有约50%的大鼠在减压后15 min内出现呼吸急促、抽搐、死亡;10%的大鼠出现瘫痪、呼吸急促,在出舱后12 h内死亡;其余大鼠在减压后出现呼吸急促、懒动、竖毛等症状,在2 h内恢复。
2.2 急性减压病大鼠的组织病理表现
组织病理显示:出现急性减压病症状大鼠的肺、肝及大脑皮层均出现不同程度的病变:肺脏组织明显充血水肿,肺泡结构破坏,肺泡间隔增厚,支气管旁大量炎性细胞侵润;肝脏呈现显著的淤血,但肝小叶结构完整;大脑皮质呈现轻微的水肿,软脑膜有少量的淤血,余无异常表现(图1)。

Fig.1 Tissue pathology of the lung,liver and cerebral cortex of rats sufferedwith DCS(HE stain ×200)
2.3 急性减压病大鼠肺组织血管渗透性测定
Evans blue可以与血中白蛋白结合,正常生理状态的血管内皮作为一道屏障可以阻碍其与血中白蛋白结合,当血管内皮损伤时,Evans blue因可和渗漏出的白蛋白结合,使组织染色。因而被广泛用于评估体内外血管渗透性。在本实验中,我们应用该染色方法探讨急性减压病时大鼠肺血管渗透性的改变。结果发现:急性减压病大鼠肺组织的蓝染程度显著增加,减压后6 h显著,24 h仍蓝染明显(图2A)。定量分析发现,相对于对照组的OD620值(6.53±1.32),减压后 6 h及 24 h肺组织中Evans blue的含量显著增加(OD620值分别为12.78±0.69,10.34±1.27,P<0.05,图2B)。

Fig.2 Vascular leakage in the lungs was assessed in SD rats post decompression(±s,n=5)
2.4 急性减压病可引起肺组织粘附分子的表达上调
E-selectin表达在减压后30 min及6 h在肺组织中表达上调,在减压后24 h恢复至接近基值;ICAM-1在减压后6 h在肺组织中表达上调,在减压后24 h仍上调显著;MHC-II在减压后6 h表达上调明显,24 h回复基值(表1)。
Tab.1 Immunostaining for E-selectin,ICAM-1 and MHC-II protein in the lung of rats post decompression(IOD value,±s,n=5)
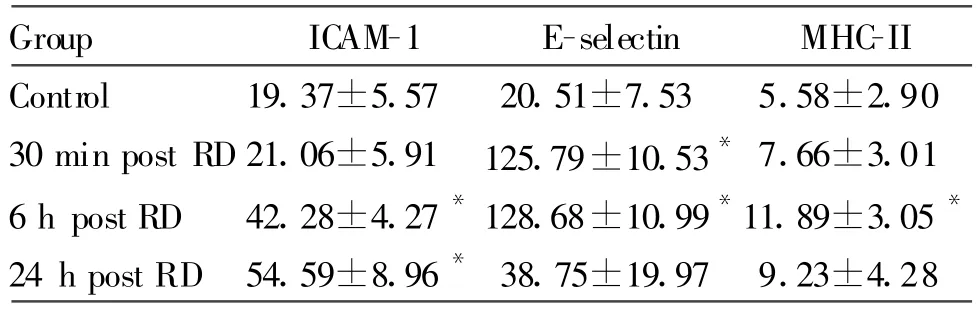
Tab.1 Immunostaining for E-selectin,ICAM-1 and MHC-II protein in the lung of rats post decompression(IOD value,±s,n=5)
IOD:Mean area×mean density;RD:Rapid decompression*P<0.05 vs control group
Group ICAM-1 E-selectin MHC-II Control 19.37±5.57 20.51±7.53 5.58±2.90 30 min post RD 21.06±5.91 125.79±10.53*7.66±3.01 6 h post RD 42.28±4.27*128.68±10.99*11.89±3.05*24 h post RD 54.59±8.96*38.75±19.97 9.23±4.28
3 讨论
Eckmann等报导不安全减压产生的大量气泡可聚集在血管,导致血管阻塞及增加内皮细胞间的缝隙连接。血管长时间的阻塞,可导致内皮组织缺血缺氧,内皮细胞激活,血管内的炎性细胞聚集至内皮细胞表面,释放氧自由基、蛋白酶,进一步损害内皮组织,激活炎症介质的释放,使机体呈现一前致炎性状态[3-4]。因此Madden等提出假设:气泡导致的,细胞因子介导的内皮损伤可能是急性减压病的发病原因之一[5]。
内皮细胞的受损可导致细胞激活,内皮细胞激活状态下可诱导粘附分子的表达。这些内皮细胞激活标记可表达在不同阶段。如P-selectin在激活后几分钟内就可出现,从而促进细胞粘附的进展,而E-selectin在激活后4~6 h达到高峰。ICAM-1及VCAM-1的增高可持续数天[6]。因为DCS表现出类似于系统性炎症反应的症状[7],因此我们推测不安全减压后机体产生的细胞因子可介导内皮细胞的激活,引起粘附分子表达上调。我们在本部分实验中采用免疫组化的方式检测肺组织中 E-selectin、ICAM-1及MHC-II的表达变化。之所以选择了肺组织,因为肺是减压病的靶器官,是静脉气泡的早期过滤器,因为压力比体循环中低,因此更容易在减压过程中形成气泡。Nyquist等报道重型减压病时肺组织是炎性细胞聚集最为显著的地方,也支持这一观点[8]。
结果发现肺组织中粘附分子表达上调,且在减压后30 min至6 h最为显著。其中,ICAM-1表达在减压后6 h在肺组织中表达上调,在减压后24 h仍上调显著。E-selectin在减压后30 min及6 h在肺组织中表达上调,在减压后24 h恢复至接近基质。MHC-II在减压后6 h表达上调明显,24 h后回复基值。这和上述文献结果相符合。ICAM-1在正常状态下极微量的表达于内皮细胞表面,在TNF-α和IFN-γ的刺激下,血管内皮细胞表面的ICAM-1可增高,且增高可持续数天[9],因此,在本实验中,ICAM-1的表达在减压后24 h仍增高明显。ICAM-1激活时可和白细胞表面的LFA-1受体相结合,从而介导白细胞和内皮细胞的粘附。E-selectin只表达在经炎症因子激活的内皮细胞表面,可促进白细胞粘附至受损的内皮细胞上,可被TNF-α和IL-1所激活。E-selectin在激活后4~6 h达到高峰,在本实验中,我们发现E-selectin在减压后6 h达高峰。IFN-γ可激活血管内皮细胞表面表达MHC-II类分子,介导白细胞和内皮细胞的结合[8],本实验中,MHC-II表达在减压后6 h上调明显。
粘附分子的增高趋势和组织的病理表现及大鼠的临床症状呈现一致性。组织病理显示:肺、肝及大脑皮质均在减压后30 min内病损最为显著,表现为肺组织的充血水肿、肺泡结构的消失;肝脏淤血;大脑皮质的水肿及淤血。该现象和我们前期发现的急性减压病兔的病理表现相一致,提示快速减压后1 h为重型减压病抢救的关键时期[10]。同时提示我们,除了肺组织是减压病的靶器官之外,肝脏及中枢神经系统的损伤也较明显,因此在后期的实验中,应对减压病导致的其它系统的损伤进行进一步研究。
为更进一步检测减压病时肺血管内皮屏障的破坏,在本实验中,我们也采用了evans blue染色法。结果发现急性减压病大鼠肺组织的血管渗透性明显增加,即使在减压后24 h,大鼠无明显症状体征时,肺脏血管渗透性仍显著增加。该现象提示肺血管内皮屏障显著破坏,同时提示即使是无明显症状的大鼠,肺组织的损伤还是存在的。
因此,根据上述实验结果,我们认为不安全减压产生的大量气泡,可导致血管内皮受损,受损的血管内皮,可诱导内皮细胞粘附分子表达上调,白细胞粘附至内皮细胞表面,进一步损伤血管内皮屏障。
[1]Vann R D,Thalmann E D.Decompression physiology and practice.In:Bennett PB,Elliott DH(editors):The physiology and medicine of diving[M].London:WB Saunders.1993,376-432.
[2]Little T,Butler B D.Pharmacological intervention to the inflammatory response from decompression sickness in rats[J].Aviat Space Environ Med,2008,79(2):87-93.
[3]Eckmann D M,Armstead S C.Influence of endothelial glycocalyx degradation and surfactants on air embolism adhesion[J].Anesthesiol,2006,105(6):1220-1227.
[4]Brodsky S V,Zhang F,Nasjletti A,et al.Endothelium-derivedmicroparticles impair endothelial functionin vitro[J].AmJ Physiol Heart Circ Physiol,2004,286(5):H1910-1915.
[5]Madden L A,Laden G.Gas bubbles may not be the underlying cause of decompression illness-The at-depth endothelial dysfunction hypothesis[J].Med Hypotheses,2009,72(4):389-392.
[6]Yusuf-Makagiansar H,Anderson M E,Yakovleva T V,et al.Inhibition of LFA-1/ICAM-1 and VLA-4/VCAM-1 as a therapeutic approach to inflammation and autoimmune diseases[J].Med Res Rev,2002,22(2):146-167.
[7]Martin J D,Thom S R.Vascular leukocyte sequestration in decompression sickness and prophylactic hyperbaric oxygen therapy in rats[J].Aviat Space Environ Med,2002,73(6):565-569.
[8]Nyquist P A,Dick EJ Jr,Buttolph T B.Detection of leukocyte activation in pigs with neurologic decompression sickness[J].Aviat Space Environ Med,2004,75(3):211-214.
[9]Yang L,Froio R M,Sciuto T E,et al.ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alphaactivated vascular endothelium under flow[J].Blood,2005,106(2):584-592.
[10]包晓辰,方以群,李 慈,等.兔实验性重型减压病时组织的病理变化[J].中华航海医学与高气压医学杂志,2010,6(16):321-324.
