黄芪多糖对缺血性脑损伤大鼠的神经保护作用及其机制研究*
2012-08-30周庆华
颜 玲,周庆华
(1.湖北民族学院医学院,恩施 445000;2.荆楚理工学院医学院,湖北荆州 434000)
目前认为中枢神经退行性疾病的发病机制与神经细胞凋亡、神经递质紊乱、自由基损伤等有关[1]。中枢神经系统(central nervous system,CNS)神经细胞凋亡后的修复与再生较为复杂,现有资料认为其再生是损伤或病变神经元轴突沿损伤方向重新生长,之后予以重建突触与功能联系,而不是损伤或死亡神经元的简单被替换。现大量研究表明,神经轴突的生长特点是通过一种嘌呤敏感性机制予以控制的一个特征性的基因表达程序[2]。在成熟的CNS神经元中,这种特征性的基因表达程序可以被再次激活而诱导轴突生长并予以延伸[3]。有研究报道,海马颗粒细胞在短暂性脑缺血后,其神经细胞粘附分子(neural cell adhesion molecule,NCAM)的表达明显增加[4]。这就间接说明,至少NCAM是促进神经结构的重塑并刺激神经生长的因子之一。黄芪多糖是从黄芪(astragalus,AG)中提取的活性化合物,其脂溶性好,易透过血脑屏障。具有抗氧化、延缓衰老、维护脑细胞代谢和免疫调节等多种作用[5]。为探究AG对中枢神经的保护作用及机制,本研究采用AG干预大鼠缺血性脑损伤模型,研究AG对大脑和海马神经元修复的影响。
1 材料与方法
1.1 材料
动物系经过行为学实验筛选合格的封闭群Wister雄性大鼠100只(体重180~220 g),购于重庆医科大学实验动物中心。黄芪多糖(Sigma Aldrich公司,S07477-286);NCAM单克隆抗体(Sigma Aldrich公司,1∶200);全自动生化分析仪(美国思博名科学器材公司,TMS-1024i/Biolis);立体显微镜(日本,SZX6745-J4);多普勒血流探测仪(日本,ES-1000spm);原位细胞凋亡检测试剂盒TUNEL(广州博理生物科技有限公司,TBD2020POD);β-actin引物(批号20100651)和 c-fos引物(批号 20100618)上海生工生物工程技术服务有限公司提供;MK3型酶标仪(芬兰,00120F006001);单道可调加样枪(德国Tripette);MG96G型PCR仪(YK0202023)杭州朗基科学仪器有限公司提供;LG2020D型凝胶成像分析系统、JY300+型电泳仪及JY-SCZ2型电泳槽由北京君意东方电泳设备有限公司提供;A1301026型低温离心机上海艾测电子科技有限公司提供;美国DQ300型Hoefer核酸蛋白荧光定量分析仪(上海吉泰生物科技有限公司)。
1.2 动物分组与给药
将大鼠随机分成假手术组(SOG),模型组(MG-1d,3d,7d)、低剂量黄芪多糖治疗组(L-AGTG-1d,3d,7d)和高剂量黄芪多糖治疗组(H-AGTG-1d,3d,7d),每组10只。L-AGTG和H-AGTG缺血2 h后分别每日2次ip AG 5 mg/kg和15 mg/kg(以生理盐水稀释成2 ml),直至处死取材。SOG与MG缺血2 h后分别每日2次注射等容量生理盐水(ip)。
1.3 动物处理[5]
动物10%水合氯醛麻醉(300 mg/kg,ip),仰卧固定,右腹股沟切开暴露股动脉插管备用。颈正中纵行切开约1~1.5 cm,逐层分离,暴露右侧颈总动脉、颈内动脉及颈外动脉。MG、L-AGTG和H-AGTG组结扎并切断颈外动脉及分支,随后沿颈内动脉根部结扎其颅外分支(翼腭动脉),应用Koizumi等[6]线栓法,由右颈外-颈内动脉插入丝线(5-0,头端粘有硅胶,连续光滑,直径0.21~0.27 mm),制造右大脑中动脉阻塞(right middle cerebral artery occlusion,RMCAO)再灌注模型[5]。随后沿着颈外动脉残端插入同样丝线,沿颈外动脉与颈总动脉分叉处,轻轻向颈内动脉推进至颈内动脉颅内分叉处,进线长度约(1.7±0.2)cm,使流入大脑中动脉血流被阻断。在MG、L-AGTG和H-AGTG组缺血2 h后,轻拔栓线至颈总动脉,按文献[6]要求,缺血性脑损伤组选择再灌注时间点为1 d、3 d和7 d。SOG只暴露血管即缝合。术后室温保持在25℃左右,维持肛温(37±0.5)℃。除去术后死亡大鼠,经NIPs评分最后得合符要求大鼠分别为:SOG 10只,MG和L-AGTG-1d,3d,7d各10,8,9只;H-AGTG-1d,3d,7d各8,9,8只。
1.4 神经功能缺损评分(NIPs)
按Bederson等神经功能缺损评分(neurologic impairment score,NIPs)法[4],在造模前和处死取材前评分。即:0分:无神经功能缺失;1分:脑缺血的对侧前肢出现屈曲;2分:自由活动时不向对侧转圈,手推脑缺血的对侧肩部时,其肌抵抗力降低;3分:自由活动时向对侧转圈,手推脑缺血的对侧肩部时,其肌抵抗力降低。
1.5 病理学检查与凋亡神经元计数
于各个时间点(1 d、3 d和 7 d)断头取脑,迅速将完整大脑置于生理盐水培养皿中,剥离完整海马,取一半海马组织,浸于4%多聚甲醛固定,常规脱水 、透明 、浸蜡、包 埋 、切 片 、脱蜡 ,Bielschow-sky 染色,光镜下观察端脑皮质及海马各区的病理变化。另一半海马组织从前端开始连续冠状大脑切片和海马CA1区切片各3张(厚2 mm),立即放入2%TTC液中,在恒温37℃状态下,避光染色,30 min后观察切片。每张片每个部位取10个视野,在光学显微镜下观察神经元凋亡情况,用图像分析仪统计细胞凋亡率(凋亡率=凋亡数/总数×100%)。
1.6 免疫组织化学研究
按文献[6]用4%多聚甲醛将脑预固定12 h,放进25%蔗糖溶液浸泡沉底后,剥离出完整的海马。将海马CA1区和大脑连续冠状冰冻切出20μ m厚的切片。用0.3%H2O2甲醇处理大脑前囟1.2~1.6 mm间的切片(清除内源性过氧化物酶),再浸入TritonX-100的PBS(浓度0.01 mol/L),用正常马血清封闭0.5 h,防止非特异性IgG结合。用ABC法进行免疫组化染色,单克隆抗体按1∶200 NCAM放入湿盒,于冰箱孵育 36 h(恒温 4℃)后,用PBS冲洗 5 min,连续3次,用马抗小鼠IgG(1∶200生物素结合)和过氧化物酶复合物(1∶100卵白素-生物素)孵育。当显色底物DAB(diaminobenzidine)呈色10 min后用水冲洗,苏木素复染,梯度酒精脱水。Xylene(二甲苯)透明,GUM(中性树胶)封片,镜下观察。
1.7 海马组织总RNA提取与鉴定
按文献[5]用RT-PCR法半定量分析海马c-fos mRNA水平(用Trizol试剂提取海马组织总RNA)。首先吸取60~80mg海马组织,加入Trizol 1 ml,用匀浆器匀浆至液态。将匀浆置入1.5 ml离心管中,于25℃静置3 min后,4 000 r/min(4℃,离心力12 000×g)离心10 min,吸取上清液放入新的离心管,去除不溶组织沉淀。向上清液中加入氯仿200 μ l,颠倒混匀15 s,于25℃静置3 min,按上述操作继续离心15 min。小心吸取上清液,加入到另一离心管中,加入异丙醇500 μ l,摇匀。于25℃静置10 min后,按上述操作继续离心10 min,去除上清液,以1 ml 75%乙醇洗涤RNA沉淀,混匀后,以4℃离心力7 500×g离心5 min,去除上清液,于25℃干燥,沉淀RNA 5~10 min,用DEPC(二乙基焦磷酰胺)处理过的50 μ l无菌水溶解 RNA,55℃水浴助溶10 min。取 5 μ l进行琼脂糖甲醛变性胶电泳鉴定,再取5 μ l加入DEPC处理的45 μ l无菌水,用核酸蛋白荧光定量分析仪测定RNA含量,余下的RNA液存于-85℃冰箱备用。
1.8 c-fos基因的扩增
反转录在20 μ l反应体积中进行。按文献[7]用AMV 反转录酶 0.5 μ l(10 U/μ l),dNTP2 μ l(10 mmol/L),Rnasin 0.7 μ l(30 U/μ l),于 42℃和 95℃中分别变性45 min和5 min。PCR反应体系于 50 μ l中进行。其方法为:c-fos mRNA于 94℃、62℃、72℃和 55℃中分别延伸 45 s、45 s、1 min 以及 5 min。β-actin mRNA于94℃、58℃、72℃和55℃中分别延伸1 min、1 min、1 min以及5 min延伸。共循环30次。β-actin的PCR产物长度为200 bp,β-actin上游引物为5'-TCG AAT GGC TCC TAC ATT3',β-actin下游引物为 5'-AGG TCA ACC AGA ACG GCA3'。c-fos基因的PCR产物长度为400 bp,c-fos基因上游引物为5'-ACG GCA CTT TAT ATT GAC3',c-fos基因下游引物为5'-TCC GGC TAT TAA AAT GAT3'。
1.9 图像与数据处理
用CMIAS-008型(航空航天大学医学图像分析管理系统)检测NCAM阳性细胞吸光度。各数据均以均数±标准差(±s)表示,用SPSS 10.0统计软件进行方差分析。
2 结果
2.1 AG对脑缺血/再灌注大鼠NIPs和海马 CA1区NCAM表达的影响
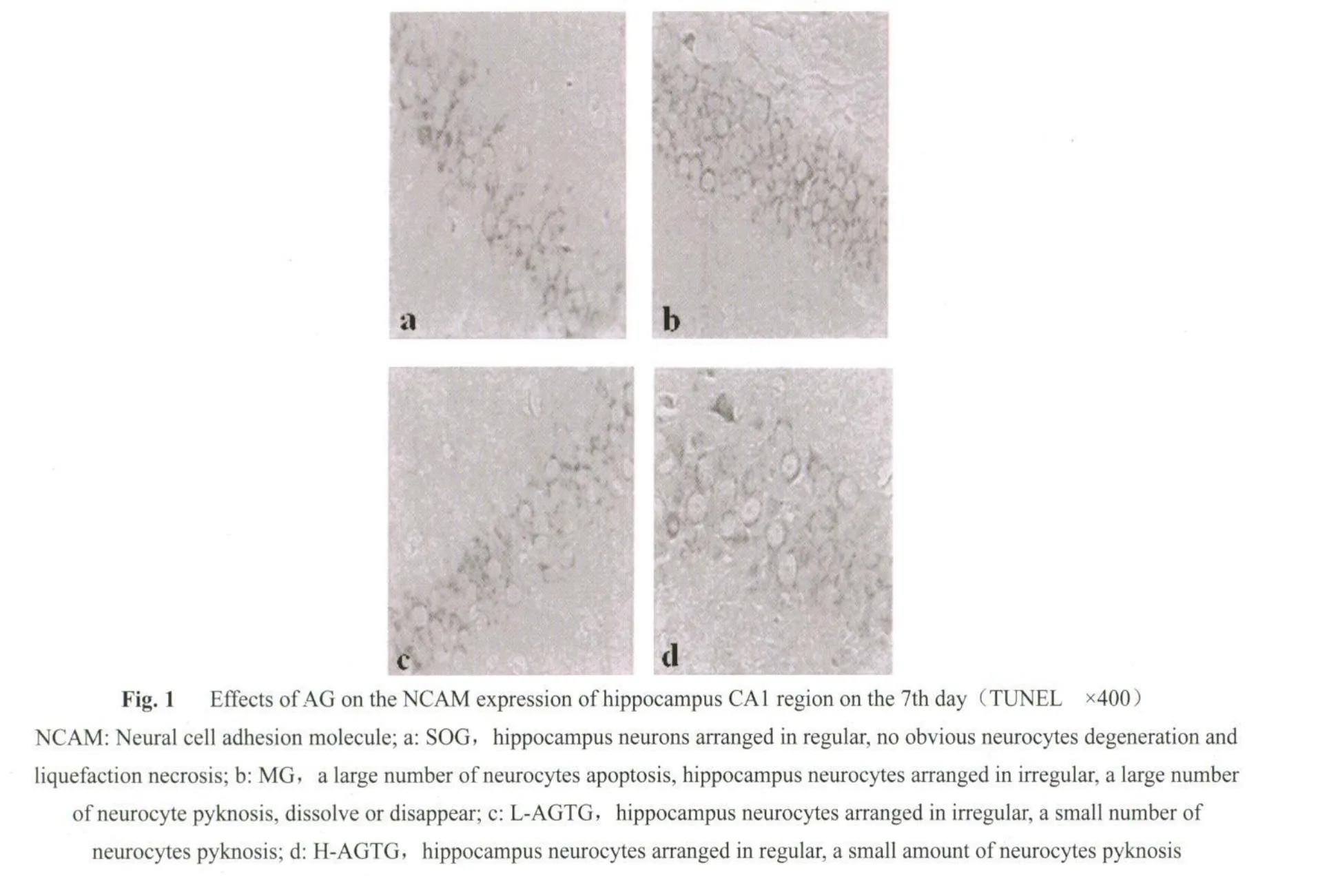
随时间延长,各组NIPs显著减少。L-AGTG和H-AGTG的NIPs明显少于MG,H-AGTG又少于LAGTG(P<0.05或P<0.01)。海马神经元NCAM的表达随时间变化出现明显差异,其差异顺序为:SOG<MG<L-AGTG<H-AGTG(P<0.05或P<0.01),有剂量依赖趋势(表1,图1见彩图页Ⅵ)。
Tab.1 Effects of AG on the NIPs and expression of the NCAM of hippocampus CA1 region after the RMCAO in rats(±s)
Tab.1 Effects of AG on the NIPs and expression of the NCAM of hippocampus CA1 region after the RMCAO in rats(±s)
AG:Astragalan;NIPs:Neurologic impairment score;NCAM:Neural cell adhesion molecule;RMCAO:Right middle cerebral artery occlusion;SOG:Sham operated group;MG:Model group;L/H-AGTG:Low and high dose astragalan treatment groups*P<0.05,**P<0.01 vs MG;#P<0.05,##P<0.01 vs itself 1 d or 3 d;△P <0.05,△△P<0.01 vs L-AGTG at the same time segmental
Group n NIPs Expression of NCAM SOG 10 0 0.143±0.011 MG 1 d 102.19±0.13 0.156±0.012 3 d 8 2.92±0.14# 0.191±0.014#7 d 92.59±0.11# 0.193±0.018##L-AGTG 1 d 102.41±0.09* 0.142±0.013*(5 mg/kg)3 d 81.41±0.08*##0.212±0.021*##7 d 91.08±0.16*##0.226±0.028**##H-AGTG 1 d 8 2.01±0.19** 0.188±0.027**△△(15 mg/kg)3 d 9 1.13±0.13*##0.268±0.022**##△△7 d 80.22±0.06**##0.281±0.023**##△△
2.2 大鼠海马CA1区病理观察与神经元凋亡情况
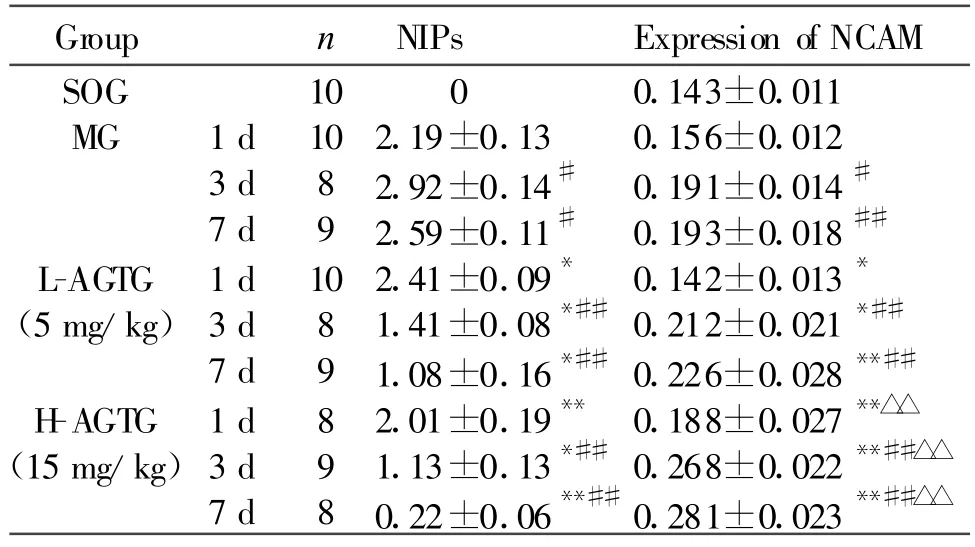
SOG未发现明显病理改变,神经原纤维排列有序、稀疏,无神经纤维缠结(neurofibrillary tangles,NFT),海马锥体神经元呈锥形,外形规则,细胞膜完整,见较大顶树突,细胞核多为圆形或椭圆形,核染色质均匀清晰;MG神经原纤维密集、排列紊乱,部分融合,凝集成宽带状,银染加深,可见大量NFT,锥体细胞胞浆轻度肿胀,细胞核固缩,核染色质浓缩,核膜不清;L-AGTG-7d神经原纤维排列部分紊乱,部分密集,可见少许NFT;H-AGTG-7d神经元纤维排列有序,密集程度缓解,未见NFT。SOG神经元凋亡不明显,其他各组随时间推移,神经元凋亡明显增多(P<0.05),在同一时间,凋亡神经元有显著差异,SOG<L-AGTG<H-AGTG<MG(P<0.05或P<0.01,表2,图2见彩图页Ⅵ)。
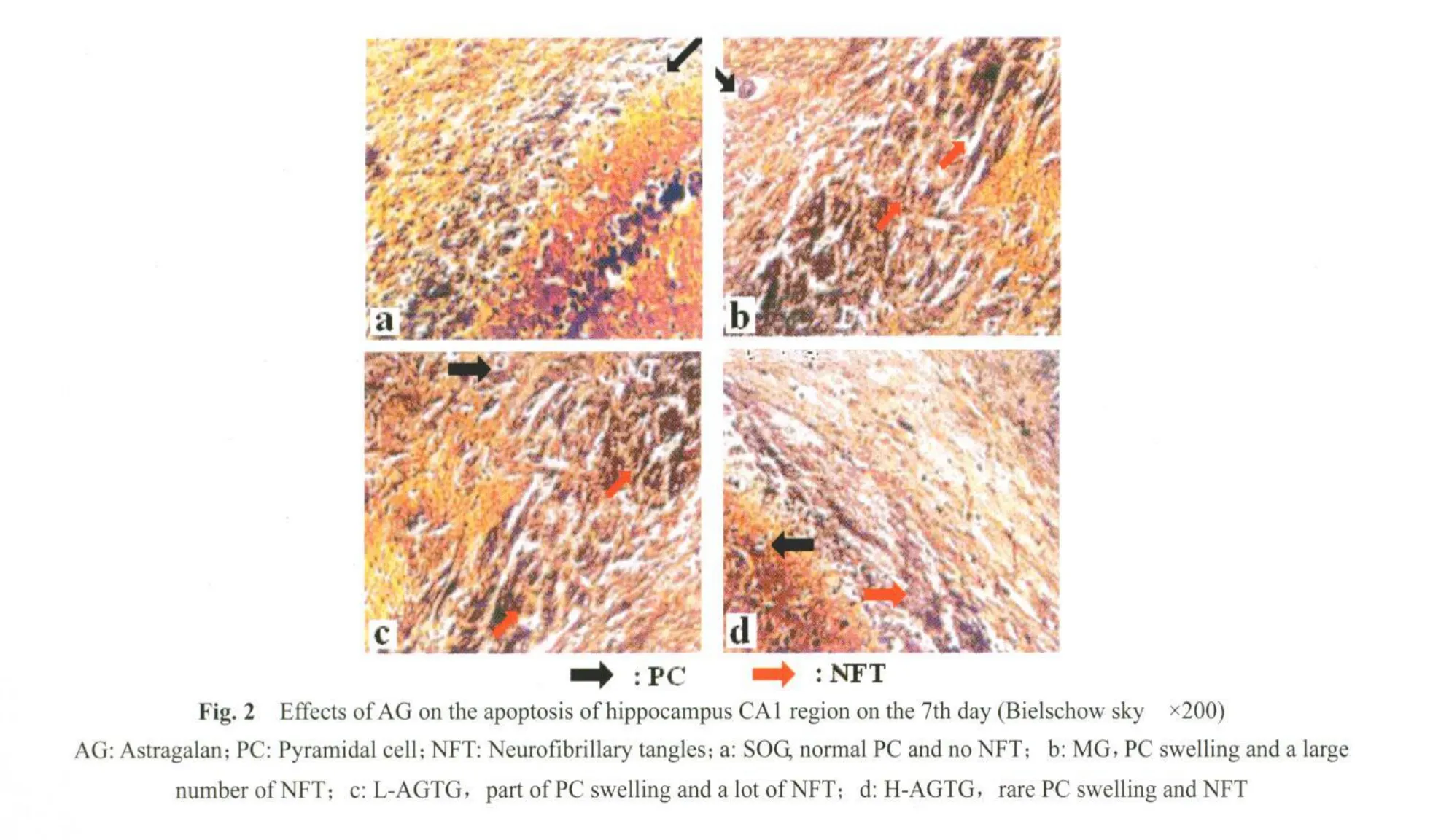
2.3 脑缺血/再灌注大鼠海马CA1区β-actin与cfos mRNA电泳结果
各图泳道排列为从左至右依次是SOG、MG-7d、L-AGTG-7d、H-AGTG-7d及 DNA marker。海马 RNA甲醛琼脂糖变性胶电泳为三条带,即28S、18S和5S,前两条荧光信号较强,后一条带荧光信号较弱。RNA光吸收值分别为A250和270,比值为0.926,提示RNA的纯度可靠(图3)。c-fos mRNA电泳条带结果表明,L-AGTG-7d与H-AGTG-7d荧光信号显著强于SOG和MG,而且H-AGTG-7d强于L-AGTG-7d(图3)。提示AG能显著促进c-fos mRNA的表达。
Tab.2 Effects of AG on the apoptosis population of hippocampus CA1 region after the RMCAO in rats(±s)

Tab.2 Effects of AG on the apoptosis population of hippocampus CA1 region after the RMCAO in rats(±s)
AG:Astragalan;RMCAO:Right middle cerebral artery occlusion;SOG:Sham operated group;MG:Model group;L/HAGTG:Low and high dose astragalan treatment groups*P<0.05,**P<0.01 vs MG at the same time segmental;#P<0.05 vs itself 1 d or 3 d;△P<0.05 vs L-AGTG at the same time segmental
Group n Apoptosis population SOG 10 3.56±1.08 MG 1 d 10 43.47±4.32 3 d 8 51.19±3.67 7 d 9 57.12±6.02#L-AGTG 1 d 10 37.14±5.09(5 mg/kg) 3 d 8 41.34±4.62*7 d 9 43.48±6.48**H-AGTG 1 d 8 30.82±4.61**(15 mg/kg) 3 d 9 33.61±3.75**△7 d 8 35.19±5.84**△
Fig.3 Expression straps of hippocampus mRNA
2.4 大鼠海马内c-fos基因表达RT-PCR半定量测定
结果表明,MG脑缺血/再灌注后,随时间的推移,海马c-fos灰度值/β-actin灰度值逐渐增加;LAGTG海马c-fos灰度值/β-actin灰度值增加显著强于MG而弱于H-AGTG(P<0.05或P<0.01,表3)。
3 讨论
脑缺血首先导致脑急性能量代谢障碍,使得神经细胞内外离子平衡失调,细胞内积聚大量钠钙,导致细胞水肿,甚至破裂[8]。其中,海马神经元对缺血缺氧性损害极其敏感,特别是CA1区[9]。而海马又是学习记忆的高级中枢,老年性痴呆就与海马退行性病变相关[10]。缺血损伤消除后,损伤的神经元就会逐渐修复,其修复的本质就是神经元的再发育过程,这种发育过程必然伴随相关物质的表达[7]。神经元表面有一种具有介导细胞黏附与识别,并能加速神经元的修复与再生的糖蛋白,这种糖蛋白就是NCAM[6]。故此,研究NCAM 的表达,能够促使人们更深层次的认识神经元及神经纤维再生的机制[9]。本研究发现AG能显著减少缺血性脑损伤再灌注大鼠神经功能缺损评分,改善损伤大鼠神经功能,其作用机制可能是:
Tab.3 Effects of AG on the c-fos-grayscale/β-actin-grayscale of the hippocampus CA1 region after the reperfusion rats in cerebral ischemia(±s)
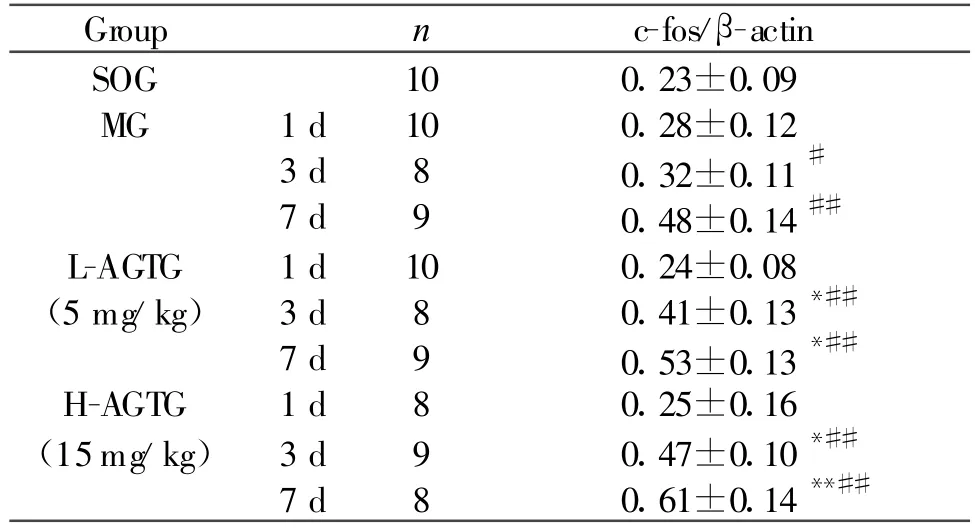
Tab.3 Effects of AG on the c-fos-grayscale/β-actin-grayscale of the hippocampus CA1 region after the reperfusion rats in cerebral ischemia(±s)
AG:Astragalan;SOG:Sham operated group;MG:Model group;L/H-AGTG:Low and high dose astragalan treatment groups*P<0.05,**P<0.01 vs MG or L-AGTG at the same time segmental;#P<0.05,##P<0.01 vs itself 1 d or 3 d
Group n c-fos/β-actin SOG 10 0.23±0.09 MG 1 d 10 0.28±0.12 3 d 8 0.32±0.11#7 d 9 0.48±0.14##L-AGTG 1 d 10 0.24±0.08(5 mg/kg) 3 d 8 0.41±0.13*##7 d 9 0.53±0.13*##H-AGTG 1 d 8 0.25±0.16(15mg/kg) 3 d 9 0.47±0.10*##7 d 8 0.61±0.14**##
3.1 上调海马NCAM的表达,减轻神经元凋亡而减轻神经功能缺损
有研究证实,成年后NCAM只存在于嗅神经和有生理性塑形区[8]。NCAM是单链跨膜免疫球蛋白,其特征是含有α-2,8键相连多聚唾液酸糖链(polysialylate,PSA)[9]。PSA可直接或间接地调节细胞之间的粘附功能[6],这种粘附性依赖于其本身的拼接方式和糖化状态,还依赖于其周围神经元、细胞外基质和胶质细胞中的配体表达[7]。NCAM在胶质细胞和雪旺细胞中表达后,形成神经元生长通道[9]。神经干细胞(neural stem cell,NSC)的发育到达迁移阶段时,NCAM的高度表达,就促成了神经轴突的生长、突触塑形和拼接,同时加速神经元环路的形成和NSC的迁移。有研究表明,NCAM的表达就是神经干细胞迁移的标志[8]。本研究表明,大鼠脑缺血/再灌注24 h后,在神经功能开始恢复的同时,NCAM的表达逐渐增强,符合神经功能恢复的规律[7]。提示神经轴突再生和突触重建与NCAM存在着密切关联,至少能说明NCAM的高表达是促进脑缺血损伤后神经功能恢复的促进因素之一[6]。本研究表明,AG能呈剂量依赖性增强大鼠脑缺血/再灌注损伤后海马CA1区神经元NCAM的表达。病理观察也发现,AG能显著减轻大鼠脑缺血/再灌注损伤后海马CA1区锥体细胞肿胀,增加锥体细胞顶树突和正常神经元数量,显著减少NFT。明显减少神经元凋亡数量,表明AG对海马神经元病理改变具有阻滞和部分逆转作用,其机制可能与NCAM的高度表达直接相关。海马与人类学习记忆密切相关,因此,本研究为AG在老年性痴呆和其他神经功能损伤性疾病的防治中显示出良好的应用前景。
3.2 上调海马c-fos基因的表达,加快下游基因的表达,保护神经细胞而减轻神经功能缺损
脑缺血损伤消除后,受到损伤神经元会逐渐修复,其修复再生过程必然伴随相关物质表达[10]。有研究报道,对记忆力具有双向影响作用的c-fos mRNA在一定范围内的表达,能改善学习记忆力[4]。cfos早期在脑中参与神经元信号的整合、转导、分析与凋亡,与学习记忆及认知功能相关[5]。其中低水平的c-fos表达,可能直接参与了神经元的分化、生长、学习记忆以及神经突触的可塑性变化等多种生理过程[9]。其机制是c-fos基因影响转录和翻译控制下游靶基因转录,从而合成新蛋白质,影响学习记忆编码有利于学习记忆[8]。有研究报道,单纯脑缺血/再灌注,海马CA1区c-fos原癌基因产物Fos有较高的表达,能促进损伤神经元的再生与重塑,加速缺血损伤后神经元的修复[10]。表明诱导脑内c-fos基因表达,能增强人脑学习记忆。本研究发现,使用AG治疗大鼠的海马CA1区神经原纤维病变较模型组明显减轻,神经原纤维随剂量增加和时间推移逐渐排列有序,密集程度明显缓解,NFT最后消失,正常神经元数量明显多于模型组(P<0.05或P<0.01)。表明AG呈剂量依赖趋势的部分逆转海马神经元病理改变。研究还发现,假手术组海马的c-fos mRNA表达显著低于模型组(P<0.05或P<0.01),c-fos灰度值/β-actin灰度值也增加。表明脑缺血因素导致海马c-fos表达增强,通过促进下游基因表达而保护神经细胞。AG治疗组海马c-fos表达均高于模型组(P<0.05或P<0.01),且c-fos灰度值/β-actin灰度值增加显著强于模型组(P<0.05或P<0.01)。表明,AG可上调c-fos mRNA表达。由此推论,AG减少损伤神经功能评分,改善脑功能状态,部分逆转海马神经元病理改变,至少与其加速cfos基因的表达相关[8]。
[1]郑青立,李 翔,张美增,等.脑缺血后神经细胞黏附分子和生长相关蛋白-43的表达与神经功能恢复的关系[J].中华物理医学与康复杂志,2005,27(8):464-466.
[2]靳 榕,蒋新颖,马 行,等.γ-羟基丁酸受体在大鼠局灶性脑缺血再灌注损伤中的作用[J].药学学报,2007,42(8):838-842.
[3]李 花,邓常清,陈北阳,等.三七总皂苷对大鼠脑缺血再灌注后Caspase表达的影响[J].中国药理学通报,2006,22(2):189-193.
[4]黄德斌,董 志.尼莫地平对缺血性脑损伤大鼠神经细胞黏附分子表达的影响[J].中国药理学通报,2008,24(5):640-643.
[5]许杜娟,陈敏珠.黄芪多糖的抑瘤作用及其机制[J].中国医院药学杂志,2005,25(10):923-927.
[6]Ning X,Liu Q,Zhao H.Nimodipine for treatment of perifocal edema following aspiration and drainage in patients with cerebra lhemorrhage[J].Neural Regeneration Res,2007,2(5):310-313.
[7]Chung Y H,Shin C M,KimM J,et al.Enhanced expression of L-type Ca2+channels in reactive astrocytes after ischemic injury in rats[J].Neurosci Lett,2001,302(2-3):93-96.
[8]袁恒杰,陈宇华,任 耘,等.丹参素钠对大鼠脑缺血再灌注损伤耐缺氧作用研究[J].中国医院药学杂志,2010,30(18):1545-1547.
[9]Hou X Y,Zhang G Y,Yan J Z,et al.Activation of NMDA receptors and L-type voltage-gated calcium channelsmediates enhanced formation of Fyn-PSD95-NR2A complex after transient brain ischemia[J].Brain Res,2002,955(1-2):123-132.
[10]苏 方,张 培,姜治伟,等.海马神经元缺血/再灌注后自噬的表达及其作用[J].中国应用生理学杂志,2011,27(2):187-190.
