慢性吗啡依赖大鼠条件性位置厌恶模型杏仁中央核蛋白激酶A表达变化*
2012-08-30宋秀花李文强冯玉芳张景丹石玉中张瑞岭
宋秀花,李文强,冯玉芳,张景丹,石玉中△,张瑞岭,李 毅
(1.新乡医学院第二附属医院,河南新乡 453002;2.武汉市精神卫生中心,湖北 武汉 430022;3.青岛市精神卫生中心,山东青岛 266034)
成瘾物质在与成瘾相关脑区如伏隔核,海马及前额皮质引起蛋白持久性的表达变化已有大量研究,而在杏仁核区蛋白表达变化却较少报道[1-3]。条件性位置厌恶(conditioned place aversion,CPA)试验动物模型被广泛用于急、慢性阿片成瘾戒断所致的厌恶性动机的生物学机制研究,试验敏感、成熟。蛋白激酶A(protein kinase A,PKA)是第二信使传导通路的关键分子之一。物质依赖戒断后CPA建立的过程中,有厌恶动机/情绪的产生,那么特定脑区内PKA的表达变化是不是CPA的分子基础,目前尚不明了。本实验通过对慢性吗啡成瘾雄性SD大鼠纳洛酮催瘾戒断后CPA动物模型的建立,定位于杏仁中央核区(central amygdaloid nuclei,CeA),测定CPA建立前后、消退后及重建后PKA蛋白表达水平。以此为毒品成瘾的防治提供理论依据。
1 材料与方法
1.1 仪器与试剂
YD-1058B石蜡切片机(浙江金华益迪医疗设备厂),Motic病理图像分析系统(厦门麦克奥迪实业集团有限公司),盐酸吗啡注射液(morphine hydrochloride injection,东北制药集团公司沈阳第一制药厂生产,批号为100305-1),盐酸纳洛酮注射液(naloxone hydrochloride injection,北京四环制药有限公司生产,批号为20100207),兔抗大鼠PKA多克隆抗体(美国Millipore公司,批号07-1468),山羊抗兔二抗(北京中杉公司,批号SP9001)。
1.2 动物及分组
选用72只SPF雄性SD大鼠(郑州大学实验动物中心提供,许可证号SCXK(豫)2005-0001),10周龄,体质量(200±20)g,独立通风笼具系统饲养,颗粒型清洁级饲料[许可证号:SCXK(豫)-2005-0001]饲喂,室温(20±2)℃,自然昼夜循环,非直接光照,所有实验均在8∶00—20∶00完成。在整个实验过程中,大鼠自由饮水及进食。人道主义对待实验动物。本研究共分为3组,研究组:慢性吗啡注射+纳洛酮催瘾组(morphine+naloxone,MN),简称MN组;对照组:慢性吗啡注射+生理盐水“催瘾”组(morphine+saline,MS)和慢性生理盐水注射+纳洛酮催瘾组(saline+naloxone,SN),分别简称MS和SN组。
1.3 慢性吗啡注射
从第1天(Day1)至第7天(Day7)的上午(共计注射6.5 d),每天两次(8AM;8PM),每次每千克体重为10 mg,腹腔注射(ip)。慢性生理盐水注射:按同期对照的原则,注射的均为生理盐水。纳洛酮催瘾注射:在慢性吗啡注射的第6天(Day6),0.3 mg/kg,腹腔注射一次。
1.4 慢性吗啡依赖纳洛酮催瘾戒断CPA的建立
即应用成瘾戒断所致的厌恶动机与特定的信号(cues,非条件刺激)结合,建立条件性反射后,形成此反射的对象再次暴露于相同或相似的信号时,表现出明显的厌恶动机,并出现回避行为。行为训练大致可以分为三个阶段:条件化前期(preconditioning session)、条件化期(conditioning session)条件化后CPA测试期(test session)训练均在受声光控制的环境进行:照明40 lux,排气扇白噪音(masking white noise,白噪声:在一定频率范围内,功率密度和频率无关的噪声)50 dB。具体方法参考文献[4]。
1.5 免疫组化标本的制备
每组大鼠于CPA测评前后90 min,均随机选取6只,腹腔注射戊巴比妥钠(40 mg/kg bw)麻醉,胸腹腔联合切开,暴露心脏,经左心室插管于升主动脉,剪开右心耳,先用无菌生理盐水150 ml快速灌注,直至流出液清亮。然后用4%多聚甲醛250 ml以先快后慢原则灌注固定30 min,取脑并将脑组织置于相同固定液中后固定2 h(4℃),参照大鼠脑部解剖图谱,将固定后的脑组织冠状切面取含AcbSH厚约2~3 mm脑组织切片,自来水下冲洗24 h,经过乙醇脱水、二甲苯透明、浸蜡,最后进行包埋,使用石蜡切片机将脑组织由前到后作厚度5 μ m的冠状切片。PBS漂洗,室温下正常山羊血清封闭1 h并振荡,分别加一抗(兔抗PKA一抗的工作液浓度1/100),4℃孵育过夜。PBS漂洗,分别加生物素化的二抗,2 h后PBS漂洗、加ABC复合物,室温下反应2 h,PBS漂洗、DAB显色,显微镜下控制反应,显色满意后0.01 mol/L PBS充分漂洗终止反应。贴片,常规脱水透明、中性树胶封片。阴性对照是以正常山羊血清取代一抗,其余步骤不变。
1.6 免疫组化结果的观察与图像分析(PKA蛋白表达测定)
每组每只动物随机选取含有各靶区的免疫组织化学染色切片各4张。使用Motic病理图像分析系统(厦门麦克奥迪实业集团有限公司)测量阳性神经元的平均灰度值。
1.7 统计处理
2 结果
2.1 三组大鼠CPA评定的结果
CPA条件化后,MN组实验鼠在伴药侧的时间较条件化前期明显减少,结果显示差异有显著性,MN组大鼠形成了明显的CPA,MS组和SN组在伴药侧的时间结果显示两者之间的差异无统计学意义(表1)。
2.2 三组大鼠戒断体征评定结果
可数性戒断体征评分:直接以30 min内出现的总的次数表示;不可数戒断体征(腹泻):以30 min内有阳性体征的实验鼠数目与观察总数的比例来表示。MN组较对照组有明显的湿狗样抖动(1.67±1.23)、躯体拉伸(1.22±0.67)、跳跃(1.56±1.33)和腹泻(22/24)的表现,而直立三组之间差别不显著(表2)。
Tab.1 Aversion scores and time in naloxone-paired compartment at preconditioning session and test session(s,±s,n=24)
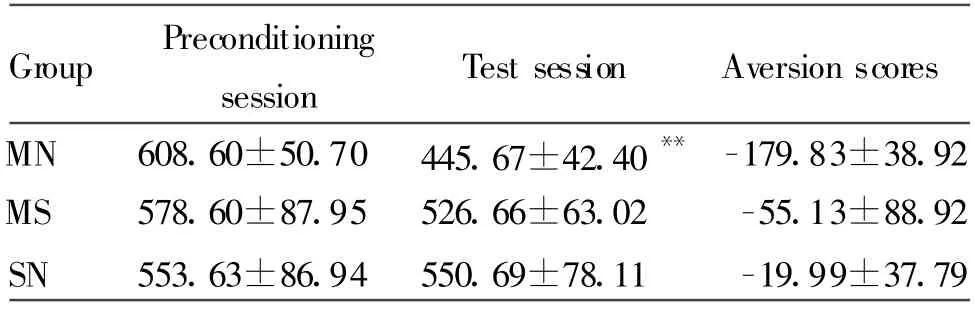
Tab.1 Aversion scores and time in naloxone-paired compartment at preconditioning session and test session(s,±s,n=24)
MN:Morphine+naloxone;MS:Morphine+saline;SN:Saline+naloxone**P<0.01 vs preconditioning session
Group Preconditioning session Test session Aversion scores MN 608.60±50.70 445.67±42.40**-179.83±38.92 MS 578.60±87.95 526.66±63.02 -55.13±88.92 SN 553.63±86.94 550.69±78.11 -19.99±37.79
Tab.2 Withdrawal symptoms of three groups(±s,n=24)

Tab.2 Withdrawal symptoms of three groups(±s,n=24)
MN:Morphine+naloxone;MS:Morphine+saline;SN:Saline+naloxone**P<0.01 vs MN group;##P<0.01 vs MN group
Group Wet dog shakes Stretching Rearing Jumping Diarrhea MN 1.67±1.23 1.22±0.67 3.89±4.10 1.56±1.33 22/24 MS 0.67±0.71** 0** 1.89±1.83 0** 0/24##SN 0.56±0.53** 0** 4.44±3.78 1.00±0.87** 0/24##
2.3 大鼠杏仁核复合体区PKA蛋白表达水平
MN组PKA蛋白表达水平在CPA建立后(134.43±4.48)、消退后(141.01±3.36)及重建后(137.18±40.33)低于建立前(124.48±6.72)分别为8%,13.3%,10.2%,差异具有显著性,CPA建立后MN组PKA蛋白表达水平高于MS组(130.67±2.40)和SN组(128.00±1.41),差异有显著性 (图1见彩图页Ⅴ)。

3 讨论
目前对厌恶动机的分子机制的研究主要集中在生物信息转导通路方面,研究较多的途径主要是腺苷酸环化酶(adenylic acid,AC)-环磷酸腺苷(cAMP)-PKA-cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)途径、鸟苷酸环化酶-环磷酸鸟苷-蛋白激酶 G途径和Ca2+-钙调节蛋白(calmodulin,CaM)-钙调节蛋白依赖的蛋白激酶(Ca2+/calmodulin-dependent protein kinase,CaMK)-CREB等途径,其中,PKA通路的上调是经典途径之一。吗啡和其他成瘾药物反复刺激神经元,慢性使用阿片类药物造成胞内信号cAMP-PKA传导系统适应性上调,从而导致胞内生活过程的一系列继发性的改变。
本研究表明,MN组实验鼠在伴药侧的时间较条件化前期明显减少,MN组大鼠形成了明显的CPA,CPA建立后,MN组有明显的湿狗样抖动、躯体拉伸、跳跃和腹泻的表现,Tzavara[5]等人的研究认为慢性给予小鼠四氢大麻酚(THC),停药后又快速给予大麻素受体拮抗剂发现躯体戒断症状如湿狗样抖动次数也会相应增加。
AC/cAMP系统内部存在一个正反馈调节,即AC/cAMP的上调激活了PKA,而PKA不仅能启动信号通路的下游信号反应,如使CREB磷酸化而改变一些基因的表达水平,还能反过来使上游信号通路中的AC受到磷酸化调节而使AC活性进一步增强。AC/cAMP-PKA系统的这一正反馈调节可能与维持或上调,以及使神经元处于过度激活状态有关,因此可能是形成和维持吗啡依赖状态的一个重要机制。
研究结果表明,CPA建立后MN组CeA的PKA的表达明显降低。杏仁中央核(CeA)是杏仁核复合体中唯一参与泛杏仁核结构的组分,对负性情感以及物质使用的动机状态有调节作用,是吗啡依赖纳洛酮催瘾戒断CPA建立的重要结构基础,结果有可能启动信号通路的下游信号反应,如使CREB磷酸化从而下调其靶基因(如NPY)的转录,导致焦虑样行为[6],易化了CPA的建立。
有研究者使用兴奋性毒素以非连续的方式毁损双侧杏仁中央和基底外侧核,来观察上述处理对给予吗啡依赖大鼠纳洛酮催瘾后所建立的CPA的影响,发现毁损杏仁核复合体中央核后,明显影响了上述CPA的形成,而对杏仁基底外侧核的毁损对CPA几乎无影响。有力支持了杏仁中央核在吗啡戒断的负性情感成分的表达中起到关键作用。
PKA可促进药物诱导的突触可塑性[7],长期滥用药物造成大脑神经适应性改变,这些改变导致行为变化并成为药物复吸的驱动力[8]。研究表明可卡因依赖大鼠的记忆再巩固过程与杏仁核PKA是紧密联系的。目前神经突触可塑性双向作用原理认为神经生物物质如NMDA,AMPA受体等是关键决定因子,提示PKA可能通过此机制增强物质依赖戒断后CPA的神经可塑性。
总之,本实验研究结果提示CeA内PKA蛋白的低表达导致厌恶的中枢状态,可能是CPA建立的关键的神经机制;CeA内PKA的适应性变化可能是物质依赖戒断后CPA相关神经可塑性变化的重要分子基础。
[1]Borgkvist A,Usiello A,Greengard P,et al.Activation of the cAMP/PKA/DARPP-32 signaling pathway is required for morphine psychomotor stimulation but not for morphine reward[J].Neuropsychopharmacol,2007,32(9):1995-2003.
[2]Self D W,McClenahan A W,Beitner-Johnson D,et al.Biochemical adaptations in the mesolimbic dopamine system in response to heroin self-administration[J].Synapse,1995,21(4):312-318.
[3]Bao G,Kang L,Li H,et al.Morphine and heroin differentially modulatein vivohippocampal LTP in opiate-dependent rat[J].Neuropsychopharmacol,2007,32(8):1738-1749.
[4]Li Y,Liu X,Chen H,et al.Development,extinction and reinstatement of morphine withdrawal-induced conditioned place aversion in rats[J].Addict Biol,2007,12(3-4):470-477.
[5]Tzavara E T,Valjent E,Firmo C,et al.Cannabinoid withdrawal is dependent upon PKA activation in the cerebellum[J].EurJ Neurosci,2000,12(3):1038-1046.
[6]Pandey S C.The gene transcription factor cyclic AMP-responsive element binding protein:role in positive and negative affective states of alcohol addiction[J].Pharmacol Ther,2004,104(1):47-58.
[7]Man H Y,Sekine-Aizawa Y,Huganir R L.Regulation of{alpha}-amino-3-hydroxy- 5-methyl-4-isoxazolepropionic acid receptor trafficking through PKA phosphorylation of the Glu receptor 1subunit[J].Proc Natl Acad Sci USA,2007,104(9):3579-3584.
[8]Koob G F,Volkow N D.Neurocircuitry of addiction[J].Neuropsychopharmacol,2010,35(1):217-238.
