仿生化提取人参皂苷类成分的初步研究Δ
2012-08-29陈新胡朝奇张洪长孙艳长春中医药大学药学院长春07长春中医药大学研发中心长春07通化万通药业股份有限公司吉林通化4000
陈新,胡朝奇,张洪长,孙艳(.长春中医药大学药学院,长春07;.长春中医药大学研发中心,长春 07;.通化万通药业股份有限公司,吉林通化 4000)
人参为五加科植物人参Panax ginsengC.A.Meyer.的干燥根与根茎,人参皂苷为其主要成分之一。传统溶剂提取法以水、乙醇作为溶剂,采用煎煮法、渗漉法、回流提取等方法进行提取,近年来许多新的提取技术用于人参皂苷,如超声提取法、微波提取法、超临界二氧化碳提取法与超高压提取法等[1,2]。上述提取方法的原理主要基于化学浸提的“相似者相溶”原则。提取溶剂、条件与人体消化系统的生理条件有很大差别,因此得到的有效成分或部位存在体外有效,但进入体内却无效的现象,而有些在体外无效的成分却被作为杂质弃去或根本没有从中药中提取出来,但这些成分可能在体内胃肠液作用下发生转化或代谢,而其转化的成分或代谢产物则具有良好活性,且易于被吸收入血发挥作用,因此传统方法筛选有效成分的效率较低,且浪费巨大。基于口服药物的体内运转过程,笔者提出仿生化提取构想,即建立一种与人体胃肠生理学环境相接近的胃肠道模拟法,提取条件较化学浸提法更接近人体真实的胃肠生理条件,提取溶剂依据胃液和肠液的组成,人工制备成系列提取溶媒,提取温度在37℃,搅拌动态提取。在国外,胃肠系统的体外模拟试验已成为一种非常有效的评估污染物方法,目前国际上已有十余种胃肠模拟方法[3]。本研究以人参超微粉为原料,分别以仿生溶媒和水为提取溶剂,以人参总皂苷、人参皂苷Rg1和人参皂苷Re含量之和为考察指标,比较2种提取法的提取率,为仿生化提取中药化学成分可行性提供科学依据。
1 仪器与试药
LC-10AT高效液相色谱(HPLC)仪,包括SPD-10Av检测器(日本岛津公司);Spectrumlab752S紫外-可见分光光度计(上海棱光技术有限公司);ZF-6三用紫外分析仪(上海嘉鹏科技有限公司);BMF-6超微粉碎机(济南倍力粉工程有限公司);飞鸽LXJ-ⅡB低速大容量多管离心机(上海安亭科学仪器厂);DZKW-4电子恒温水浴锅(北京中兴伟业仪器有限公司);KQ-250B超声波清洗器(昆山市超声仪器有限公司,功率:250W,频率:40kHz);7321电动搅拌机调速器(上海标本模型厂)。
人参采于吉林省抚松市,经长春中医药大学中药鉴定室鉴定为真品。人参皂苷Re(批号:110754-200822)、人参皂苷Rg1(批号:110703-200221)对照品购于中国食品药品检定研究院;胃蛋白酶(1∶3000,上海源叶生物科技有限公司);乙腈(色谱纯,美国Fisher公司);水为蒸馏水,其他试剂均为分析纯。
2 方法
2.1 提取方法
2.1.1 仿生化提取方法 取人参超微粉(药材60℃真空干燥,超微粉碎,过300目筛)适量,精密称定,加入仿生溶媒(0.2%氯化钠、0.32%胃蛋白酶、0.7%盐酸加水配制成100mL溶液)25倍,置37℃水浴中,搅拌,提取1h,离心,上清液用水饱和正丁醇振摇提取3次,合并正丁醇液,减压回收,低温真空干燥,得人参仿生化提取物。
2.1.2 水提取方法 取人参超微粉适量,精密称定,加入水25倍,置37℃水浴中,搅拌,提取1h,离心,上清液用水饱和正丁醇振摇提取3次,合并正丁醇液,减压回收,低温真空干燥,得人参水提取物。
2.2 人参总皂苷含量测定方法
2.2.1 对照品溶液的制备 取人参皂苷Re对照品适量,精密称定,用甲醇定容于100mL容量瓶中,制成浓度为0.2mg·mL-1的人参皂苷Re对照品溶液。
2.2.2 检测波长的选择 精密吸取对照品溶液1.0mL,置具塞试管中,将试管置于冰水浴中,再加入0.5mL 8%香草醛乙醇溶液和77%硫酸5mL,摇匀,混合物置60℃恒温水浴中加热10min后,立即在冰水浴中冷却15min;并在另一试管中加甲醇1.0mL,加随行试剂,作空白对照,在400~760nm波长范围内测定人参皂苷Re的吸光度。结果,人参皂苷Re在544nm波长处有最大吸收,故选择544nm为检测波长。
2.2.3 线性关系的考察[4]精密吸取人参皂苷Re对照品溶液0.2、0.4、0.6、0.8、1.0mL,分别置于具塞试管中,将试管置于冰水浴中,分别加入0.8、0.6、0.4、0.2、0mL甲醇后,再加入8%香草醛乙醇溶液0.5mL和77%硫酸5mL,摇匀,混合物置60℃恒温水浴中加热10min后,立即在冰水浴中冷却15min,每个样品做3个平行样,并在另一试管中加甲醇1.0mL,加随行试剂,作空白对照,在544nm波长处测吸光度。以人参皂苷Re进样量(X,mg·mL-1)为横坐标,吸光度(Y)为纵坐标,进行线性回归,得回归方程为Y=3.3318X+0.0284(r=0.9996)。结果表明,人参皂苷Re进样量在0.044~0.220mg范围内与吸光度呈良好线性关系。
2.3 人参皂苷Rg1和人参皂苷Re含量测定方法[5]
2.3.1 色谱条件色谱柱:Zorbax XDB-C18(250mm×4.6mm,5μm);填充剂:十八烷基硅烷键合硅胶;流动相:乙腈-0.05%磷酸溶液(20∶80);流速:1.0mL·min-1;检测波长:203nm;柱温:室温;进样量:10μL。理论板数按人参皂苷Rg1峰计算应不低于6000。
2.3.2 混合对照品溶液制备 分别精密称取人参皂苷Rg1对照品、人参皂苷Re对照品适量,加甲醇制成每1mL分别含人参皂苷Rg10.24mg、人参皂苷Re0.36mg的混合对照品溶液,摇匀,即得。
2.3.3 线性关系考察 分别精密吸取2、5、10、15、20μL混合对照品溶液,注入液相色谱仪,记录峰面积积分值。分别以人参皂苷Rg1、人参皂苷Re进样量(X,μg)为横坐标,峰面积积分值(Y)为纵坐标,进行线性回归,得人参皂苷Rg1、人参皂苷Re的回归方程分别为Y=1323.7X-15395(r=0.9998)、Y=1659.4X+5200.8(r=0.9999)。结果表明,人参皂苷Rg1、人参皂苷Re进样量分别在0.48~4.80、0.72~7.20μg范围内与峰面积积分值呈良好线性关系。
3 结果
3.1 不同提取方法下人参总皂苷提取率的比较
分别取人参仿生化提取物与水提取物适量,精密称定,加甲醇制备成0.5mg·mL-1的供试品溶液。按“2.2”项下方法测定,并根据回归方程计算总皂苷含量,照下式计算总皂苷提取率:提取率=提取物中总皂苷含量/药材中总皂苷含量×100%。结果,人参超微粉经仿生化提取后,总皂苷提取率较水提取法高出13%,详见表1。

表1 不同提取方法下人参总皂苷提取率的比较(n=3)Tab 1 Comparison of extraction rate of TSPG bydifferent extraction methods(n=3)
3.2 不同提取方法下人参皂苷Rg1和人参皂苷Re总提取率的比较
分别取人参皂苷仿生化提取物和水提取物适量,精密称定,加甲醇制备成每1mg·mL-1的溶液,摇匀,经微孔滤膜(0.45μm)滤过,作为供试品溶液。分别精密吸取2种供试品溶液10μL,注入液相色谱仪,按“2.3”项下方法测定,外标一点法计算含量,并按下式计算提取率:提取率=提取物中人参皂苷Rg1与人参皂苷Re含量之和/药材中人参皂苷Rg1与人参皂苷Re含量之和×100%。结果,人参超微粉经仿生化提取后,人参皂苷Rg1,与人参皂苷Re提取率较水提取法高出45%。色谱见图1;提取率测定结果见表2。
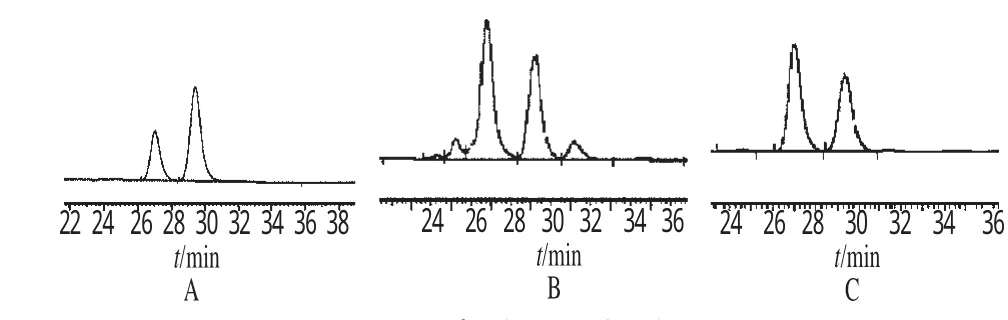
图1 高效液相色谱图A.人参皂苷Re和人参皂苷Rg1混合对照品;B.仿生提取物;C.水提取物Fig 1 HPLC chromatogramsA.mixed control of ginsenoside Rg1and Re;B.biomimetic extract;C.water extract

表2 不同提取方法下人参皂苷Rg1与人参皂苷Re含量之和及其提取率测定结果(n=3)Tab 1 Results of the content and extraction rate of the sum of ginsenoside Re and Rg1by different extraction methods(n=3)
4 讨论
决定中药中的一个、一种或一组化学物质是否为有效化学成分、有效效应物质,由它或它们在体内的行为来确定,其在胃肠内和肝内的行为尤为重要,这已成为中药实验医学中的关键性基础科学问题[6]。Odani T等[7]发现,人参皂苷Rg1的口服生物利用度仅为1.9%~20%。但人参皂苷Rg1可在胃液作用下水解掉一分子葡萄糖生成代谢产物人参皂苷Rh1和人参皂苷F1,而且其代谢产物在血液中浓度较高,这可能是人参皂苷Rg1发挥益智和抗衰老作用的主要活性成分[8]。仿生化提取法得到的提取物HPLC图显示,在人参皂苷Rg1和人参皂苷Re色谱峰前后分别出现新的色谱峰,提示在该提取条件下可能有成分转化或有未被水提取出来的成分,对该成分的确定有待进一步研究。
基于动态模拟人体生理机能的仿生化提取法,本研究主要进行体外模拟胃生理环境条件下对人参皂苷类成分进行提取,仿生化提取结果取决于以下几个因素:(1)提取溶媒,它是该方法的核心。不同于传统的提取溶剂,仿生提取溶媒由酶、酸、碱和无机盐等组成,可按照不同组成和比例配制成系列仿生提取溶媒。胃在不同状态下pH值不同,如在空腹状态下pH值一般为1.5左右,饱腹状态下为4.0左右。而pH值对成分的溶解析出影响很大,仿生提取溶媒可调成不同pH值进行提取。(2)温度。虽然增加温度能使扩散系数加大,扩散速度增加,但人体温度为37℃,故本研究在该温度下进行提取。国外的十几种体外胃肠模拟试验温度均确定在37℃[5]。(3)提取方式。依据人体消化过程,一方面人体胃是不断蠕动消化的,在消化和吸收过程中是动态过程;另一方面,根据提取扩散公式[9]G=D×F(c1-c2)t/δ,浓度差(c1-c2)对提取率有明显影响,因此选择搅拌提取。
基于人参皂苷Re在人参药材中含量较高,文献报道[10]对人参药材中总皂苷含量测定亦是选择该成分作为对照,以此标示人参药材中总皂苷含量。故笔者以人参皂苷Re作为人参总皂苷含量测定的标示物。
综上所述,笔者选择模拟胃生理条件提取人参总皂苷,经仿生化提取的人参皂苷类成分应更易于被人体吸收,从而具有良好的生物利用度。后期研究一方面要进一步考察如压力或无氧条件对化学成分提取的影响;另一方面将通过动物实验,证明仿生化提取物的安全性和有效性。
[1] 张 晶,陈全成,弓晓杰,等.不同提取方法对人参皂苷提取率的影响[J].吉林农业大学学报,2003,25(1):71.
[2] 陈瑞战,张守琴,王长征.常温超高压提取人参总皂苷[J].化工学报,2005,56(5):911.
[3] 张东平,余应新,张 帆,等.环境污染物对人体生物有效性测定的胃肠模拟研究现状[J].科学通报,2008,53(21):2537.
[4] 王利胜,袁爱贤,韩 坚,等.HPLC法测定川芎嗪在小鼠血浆、脑、肝中的含量[J].中国药房,2008,19(9):654.
[5] 国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:8.
[6] 杨秀伟.中药实验医学中的关键基础科学问题[J].中西医结合学报,2005,3(2):154.
[7] Odani T,Tanizawa H,Takino Y.Studies on the absorption,distribution,excretion and metabolism of ginseng saponinsⅡ.The absorption,distribution and excretion of ginsenoside rglin the rat.[J].Chem Pharm Bull(Tokyo),1983,31(1):292.
[8] 冯 亮,胡昌江,余凌英.人参皂苷Rg1及其代谢产物的药代动力学研究[J].药学学报,2010,45(5):636.
[9] 屠锡德,张钧寿,朱家璧.药剂学[M].北京:人民卫生出版社,1985:634.
[10] 陈发奎.常用中草药含量测定[M].北京:人民卫生出版社,1997:11-13.
