不同浓度的吗啡与5-氟尿嘧啶联合应用对MCF-7乳腺癌细胞凋亡与细胞周期的影响
2012-08-22王志学孙立新李汝泓于铁莉邱利飞闫彩云
王志学 孙立新 李汝泓 雷 燕 于铁莉 邱利飞 闫彩云
(承德医学院附属医院麻醉科,河北 承德 067000)
由于手术、化疗、放疗、内分泌治疗及免疫治疗等综合治疗措施的实施,乳腺癌病人的死亡率开始下降,生存期得以延长。但是乳腺癌患者中疼痛的发生占有很大的比例,因此解除或减缓癌症病人的疼痛是一项重要的任务,吗啡(Morphine)作为阿片类药物的一种,目前仍然是癌痛治疗的主要手段。近年来人们发现,吗啡在镇痛的同时,会影响细胞的增殖和凋亡,主要通过阻滞细胞周期(抑制细胞周期G1→S期进展)、诱导促凋亡蛋白表达、增强肿瘤细胞对凋亡信号敏感性而发挥抑癌活性〔1~3〕。但由于癌症病人的疼痛治疗往往不是单独实施,常与癌症病人的化疗同时进行,而吗啡与化疗药物联合应用对抗癌效果的影响尚未见报道。5-氟尿嘧啶(5-Fu)是各期乳腺癌的基础化疗药物,目前仍广泛应用于临床一线。因此,本研究以5-Fu为代表,研究吗啡与5-Fu联合应用对MCF-7乳腺癌细胞凋亡和细胞周期的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 Annexin V-EGFP,南京凯基生物科技发展有限公司;胎牛血清,天津血液学研究所;RPMI1640培养基,GIBCO BRL公司;胰蛋白酶,中国医学科学院血研所科技公司;碘化丙啶,美国Sigma公司。FACSCalibur流式细胞仪,美国B&D公司;YT-CJ-1N超净工作台,北京亚泰科隆实验科技开发中心;CO2电热恒温培养箱,日本SANYO公司;QL-901振荡器,中国其林贝尔;LD5-IA低速离心机,北京雷勃尔离心机有限公司;光学显微镜、倒置显微镜,日本OLYMPUS;荧光倒置显微镜,日本尼康。
1.1.2 药物 吗啡注射液,东北制药集团公司;5-Fu注射液,上海旭东海普药业有限公司。
1.1.3 细胞 MCF-7乳腺癌细胞,购于南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 细胞培养 细胞复苏成功后,调整浓度为1×106/ml接种于培养瓶,静置于37℃、5%CO2、100%湿度的培养箱内,用RPMI1640完全培养液进行培养,隔日换液。观察待贴壁70% ~80%时,用0.25%胰蛋白酶消化传代。
1.2.2 分组 共分为8组,分别用含不同药物的RPMI1640完全培养液培养。N组(对照组)为非药物处理组,LM组为50μmol/L吗啡处理组,MM组为250μmol/L吗啡处理组,HM组为1 250μmol/L吗啡处理组,F组为500μmol/L 5-Fu处理组,LM+F组为50μmol/L吗啡与500μmol/L 5-Fu联合处理组,MM+F组为250μmol/L吗啡与500μmol/L 5-Fu联合处理组,HM+F组为1 250μmol/L吗啡与500μmol/L 5-Fu联合处理组。
1.2.3 FCM检测Annexin V-EGFP/PI染色的细胞凋亡情况取对数生长期的细胞,调整细胞浓度约5×105/ml,传至25 ml细胞培养瓶,共32瓶。常规培养24 h后,根据分组情况更换为含不同药物的培养液5 ml,每组4瓶,分别孵育48 h。吸弃上清,消化、PBS洗涤,收集细胞(约106/ml以上)于离心管;4℃低速离心(1 500 r/min、5 min)后弃上清,重悬于 500μl的Binding Bufferr溶液,加入 5 μl Annexin V-EGFP 及5 μl PI,混匀,室温避光反应15 min;1 h内流式细胞仪上机检测。
1.2.4 FCM检测细胞周期 另取对数生长期的细胞,接种、培养、药物处理、分组标识、细胞收集同1.2.3;每管加75%酒精4 ml,4℃固定 24 h;4℃低速离心(1 500 r/min、5 min),彻底去除酒精;PBS洗涤,震荡,PI染色,室温避光放置30 min,流式细胞仪上机检测。
1.3 统计学分析 所有数据资料以x±s表示。采用SPSS11.5统计学软件进行处理,进行单因素方差分析(ANOVA)与析因设计方差分析,两两比较用LSD-t检验。
2 结果
2.1 吗啡、5-Fu及联合应用对细胞早期凋亡的影响 单独应用吗啡处理48 h,早期凋亡率随着吗啡浓度的增加依次增加(P<0.05,P<0.01),浓度为250及1 250μmol/L时,早期凋亡率〔(3.660±0.606)%,(5.343±0.625)%〕较未处理组〔(1.595±0.620)%〕明显增加(P<0.01),表明 250及1 250μmol/L浓度的吗啡能诱导MCF-7细胞凋亡,且吗啡对MCF-7细胞早期凋亡的剂量依赖关系已经显现。50μmol/L时,早期凋亡率〔(2.350±0.550)%〕与未处理组比较无显著性差异(P>0.05)。不同浓度吗啡与5-Fu联合用药时,早期凋亡率随着联合用药中吗啡浓度的增加依次增加〔(8.793±0.975)%,(12.545±1.008)%,(17.245±0.806)%,P<0.01〕。三组吗啡与5-Fu联合应用,均具有协同作用(P<0.05,P <0.01)。见图1。
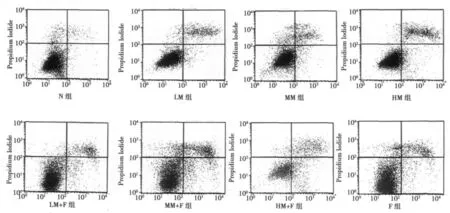
图1 培养48 h后流式细胞仪检测各组细胞早期凋亡率
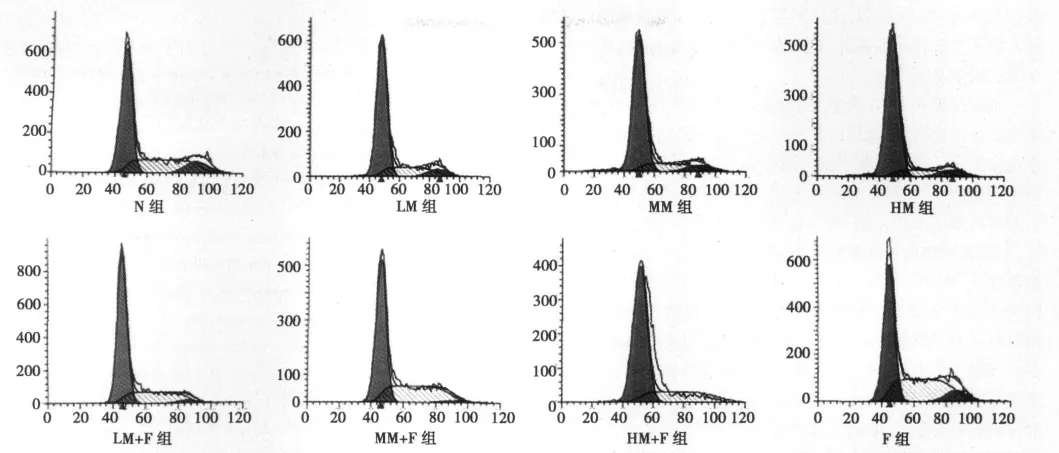
图2 培养48 h后流式细胞仪检测各组细胞周期
2.2 吗啡、5-Fu及联合应用对细胞周期的影响 见图2。单独应用吗啡处理时,G0/G1期细胞比例随着吗啡浓度的增加依次增加(P<0.01),S期细胞比例随着吗啡浓度的增加依次降低(P<0.01),而G2M期细胞比例无明显变化(P>0.05),表明吗啡可以剂量依赖地诱导MCF-7细胞主要被阻滞于G0/G1期。单独应用500μmol/L 5-Fu处理时,G0/G1期细胞比例减少(P<0.01),S期细胞比例增加(P<0.01),G2M期细胞比例减少(P<0.05),表明5-Fu可以使细胞循环周期主要被阻滞于S期。不同浓度的吗啡与5-Fu联合用药时,G0/G1期细胞比例随着联合用药中吗啡浓度的增加依次增加(P<0.05,P<0.01),较该浓度的吗啡单独处理组均减少(P<0.01);S期细胞比例随着吗啡浓度的增加依次降低(P<0.05,P<0.01),较该浓度的吗啡单独处理组均增加(P<0.01);G2M期细胞比例随着联合用药中吗啡浓度的增加依次降低(P<0.05,P<0.01),较该浓度的吗啡单独处理组均减少(P<0.01);三组吗啡与5-Fu联合应用,均具有协同作用(P<0.01)。表明两药联合应用既抑制了G0/G1期到S期的转化,又抑制了S期向G2M期的转化,也与其中吗啡的浓度有一定的剂量依赖关系。见表1。
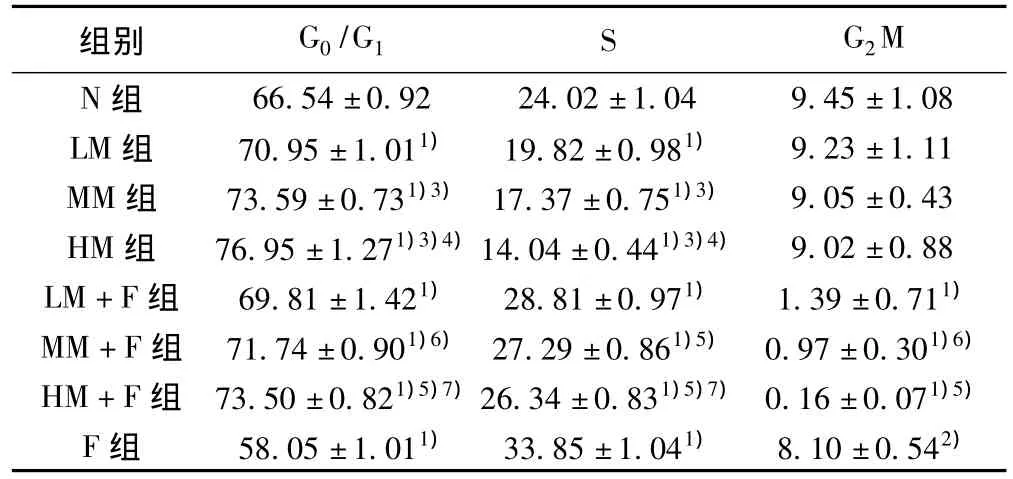
表1 不同药物处理48 h后对MCF-7细胞周期的影响(x ± s,n=4,%)
3 讨论
肿瘤的发生发展是一多基因、多步骤、多阶段的复杂过程,凋亡在肿瘤的发生发展过程中主要起负调控作用,可以遏制肿瘤细胞迅速生长〔4〕。近年来的共识是,细胞凋亡的抑制比细胞过度增殖在恶性肿瘤发生和发展过程中所起的作用更重要〔4,5〕。因此针对肿瘤细胞凋亡失衡对肿瘤细胞凋亡进行干预性调节,提高细胞凋亡/增殖的比值就不失为一种肿瘤治疗策略,大多数抗肿瘤药物是通过诱导细胞凋亡来发挥它们的抗肿瘤效应〔6〕。
本文采用此种Annexin V&PI双染法,可有效地对细胞凋亡进行定量检测,灵敏度高,并可区分坏死细胞〔7〕。本实验中选取作用48 h时检测。单独应用不同浓度吗啡处理时,吗啡浓度为50μmol/L时,尚不能证明细胞凋亡率增加,其他各处理组的细胞早期凋亡率均有明显增加,并且随着吗啡浓度的提高,有明显的浓度依赖关系;单独应用500μmol/L 5-Fu,早期凋亡率也显著增加;各浓度吗啡与500μmol/L 5-Fu两药联合应用情况下,早期凋亡率亦均显著增加,并且随着其中吗啡浓度的增加呈现明显浓度依赖关系。经过析因设计方差分析,各浓度吗啡与500μmol/L 5-Fu联合应用对早期凋亡率增加均具有协同作用。
临床上在应用吗啡癌痛治疗时,常常是一个剂量逐步增长的长期用药过程。在慢性长期用药或相对高浓度时(>250μmol/L持续用药48 h以上;50~250μmol/L或作用更短时间也可能有效,但本研究没能进一步证明),吗啡会抑制肿瘤细胞增殖,促进凋亡。在使用化疗药5-Fu(其他化疗药有待研究)化疗过程中,一定浓度以上的吗啡(>50μmol/L持续用药48 h以上,0~50μmol/L或作用更短时间有待研究)会显著强化5-Fu诱导的增殖抑制和细胞凋亡。虽然临床上目前尚未证实阿片类药物对化疗病人的转归有何影响,但是从协同促进细胞凋亡这一角度,吗啡应用的益处并不仅限于止痛。但基于离体实验之局限性,确切临床效果还有待于进一步证实。
细胞增殖抑制及细胞凋亡与细胞周期受阻密切相关。一个亲代细胞依次经历分裂间期和分裂期后,形成两个遗传物质完全相同的子代细胞,完成其增殖过程〔8,9〕。在恶性肿瘤细胞群体中一部分处于活性增殖状态,另外的细胞则会停滞在静止期(G0期)〔10〕。周期素(cyclin)和周期素依赖性激酶(Cdks)复合物作为细胞周期的“发动机”,驱动着细胞有条不紊地依次经过G1→S→G2→M期,完成其增殖过程。而细胞周期调控的异常将导致细胞周期紊乱,增殖失控,最终发生癌变,是肿瘤发生的生物学基础〔11〕。
细胞分裂和DNA合成是细胞周期的两个主要事件,细胞增殖的促进或抑制,最终必然通过调节细胞周期各阶段的DNA含量来实现。流式细胞仪就是通过测定细胞DNA的含量检测细胞周期的〔12〕。本实验结果表明,吗啡可以诱导MCF-7细胞主要被阻滞于G0/G1期,并且这种细胞周期阻滞存在剂量依赖性,即随着吗啡剂量的逐渐增加,G0/G1期的细胞比例也随之逐渐增加,S期细胞逐渐减少,G2M期细胞比例基本不变。这说明吗啡抑制了MCF-7乳腺癌细胞周期从G1期到S期的转化,从而导致了G1期阻滞。G1期是细胞质复制的主要阶段,也易接受外界因子的影响。G1期末有一个限制点特定时期,在细胞外条件适宜的情况下,细胞一旦通过限制点,即便撤去刺激生长和分裂的外界信号,仍能沿着细胞周期向前运转,成为一个自主过程直至完成细胞分裂。而在不适于分裂增殖的细胞外条件下,细胞会延长停留在G1期,甚至暂时退出细胞周期,进入G0期。吗啡处理后能使细胞周期阻滞在G0/G1期,引起细胞DNA合成减少,增殖受到抑制,阻滞在G0/G1期的细胞一旦进入细胞周期,则可引起周期基因不适当的活化,不是导致增殖,反而诱导凋亡〔13〕。
5-Fu的主要作用靶点是DNA,其在体内转变为氟尿嘧啶脱氧核苷酸(5-FdUTP)后,与胸腺嘧啶核苷酸合成酶(TS)特异性结合,干扰了细胞DNA的合成。DNA损伤严重不能被修复系统修复时,细胞便进行下一事件——凋亡,最终导致细胞死亡〔14,15〕。本实验结果显示,5-Fu可以促进 MCF-7细胞从 G1期到S期的转化,使细胞循环周期主要被阻滞于S期。并且,由于细胞周期被抑制,使处于分裂期的细胞(G2/M)比例显著减少。这也再次证实了5-Fu是细胞周期特异性药物,主要作用于S期,这一点从细胞凋亡率上反映的更为明显。
两药联合使用后,既抑制了G1期到S期的转化,又抑制了S期向G2M期的转化,这种协同作用与吗啡造成G0/G1期阻滞和5-Fu致S期阻滞有关,使处于G2M的细胞比例显著减少。并且这种细胞周期阻滞存在剂量依赖性,即随着联合用药中吗啡剂量的逐渐增加,G0/G1期的细胞比例也随之逐渐增加,G2M的细胞比例逐渐减少,S期细胞组间有减少趋势。这种结果当然是两药分别影响细胞周期联合作用的体现,也正与细胞凋亡率的变化相吻合。
本研究中吗啡、5-Fu作用于乳腺癌细胞,通过影响细胞周期可调节细胞增殖和诱导凋亡。目前已经发现了许多参与肿瘤细胞周期调控的分子靶点,例如控制细胞从G1期到S期转化的cyclinD/Cdk4,6 cyclinE/Cdk2,通过S期的过程需要的cyclinA/Cdk2,cyclinB/Cdk1…… 这些分子靶点可以作为肿瘤治疗的基础〔16~18〕。吗啡、5-Fu调节细胞周期的机制如何,及其相关的酶、蛋白之间的相互作用都有待于进一步研究。
1 Gupta K,Kshirsagar S,Chang L,et al.Morphine stimulates angiogenesis by activating proangiogenic and survival promoting signaling and promotes breast tumor growth〔J〕.Cancer Res,2007;62:4491-8.
2 Lin X,Li Q,Wang YJ,et al.Morphine inhibits doxorubicin-induced reactive oxygen species generation and nuclear factor kappaB transcriptional activation in neuroblastoma SH-SY5Y cells〔J〕.Biochem,2007;406:215-22.
3 Pharmazentrum F,Klinische P.G protein-independent G1 cell cycle block and apoptosis with morphine in adenocarcinoma cells:involvement of p53 phosphorylation〔J〕.Cancer Res,2009;63:1846-52.
4 Srivastava RK.Intracellular mechanisms of TRAIL and its role in cancer therapy〔J〕.Mol Cell Biol Res Commun,2009;4(2):67-75.
5 Eva B,Andrea H,Jin P,et al.Nuclear topography and expression of the BCR/ABL fusion gene and itsp rotein level influenced by cell differentiation and RNA interference〔J〕.Leuk Res,2005;29:901-13.
6 Nicholson DW,Thornberry NA.Apopotosis:Life and death decisions〔J〕.Science,2003;299(6504):214-5.
7 Du C,Fang M,Li Y,et al.Smac,amitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition〔J〕.Cell,2008;102(1):33-42.
8 Alberts B.Molecular biology of the cell〔M〕.New York:Garland Publishing Inc,2002:15-27.
9 Martinou JC,Desagher S,Antonsson B.Cytochrome c release from mitochondria:all or nothing〔J〕.Nat Cell Biol,2006;2(3):41-3.
10 Macaluso M,Montanari M,Cintiqgiordano A.Modulation of cell cycle components by epigenetic and genetic event〔J〕.Semin Oncol,2005;32(5):452.
11 李志琴,章静波.细胞周期调控与肿瘤〔J〕.癌症进展杂志,2004;2(1):70-5.
12 Sueoka E,Sueoka N,Kai Y,et al.Anticancer activity of morphine and its synthetic derivative,KT-90,mediated through apoptosis and inhibit of NF-kappaB activation〔J〕.Biochem Biophys Res Commun,2008;252(3):566-70.
13 Rubin LL,Philpott KL,Brcoks SF.Apoptosis:The cell cycle and cell death〔J〕.Curr Biol,1993;3:391-4.
14 薛立娟,卜丽莎,杨绍娟,等.5-Fu对人结肠癌细胞凋亡过程中DNA损伤修复基因表达的影响〔J〕.中国生物制品学杂志,2006;19(2):159-61.
15 Abraham RT.Cell cycle checkpoint signaling through the ATM and ATR kinases〔J〕.Genes Dev,2007;15:2177-96.
16 Franko J,Pomfy M,Prosbova T.Apoptosis and cell death mechanisms,pharmacology and promise for the future〔J〕.Acta Medica,2010;43(2):63-8.
17 邵荣光.以细胞周期调控分子为靶点的肿瘤治疗〔J〕.中国肿瘤,2005;14(11):706-8.
18 Eastman A.Cell cycle checkpoints and their impact on anticancer strategies〔J〕.Cell Biochem,2008;91:223-31.
