斯氏并殖吸虫抗原致大鼠脑组织病变的光镜、电镜观察*
2012-08-21黄玉清李珍炼陈文碧佘俊萍杨朝鲜程基焱王光西
黄玉清,李珍炼,陈文碧,佘俊萍,杨朝鲜,程基焱,王光西
2.泸州医学院病原生物学教研室,泸州 646000;
3.泸州医学院医学基础科研中心,泸州 646000
斯氏并殖吸虫散在流行于我国四川、重庆、甘肃、福建等15个省、市、自治区,是重要的食源性寄生虫病病原体,由于人不是斯氏并殖吸虫的正常宿主,童虫不能在人体内发育至性成熟产卵,很少进入肺脏形成典型囊肿[1]。因生食或半生食含囊蚴的溪蟹而感染,童虫钻过肠壁移行至皮下或组织器官,引起游走性皮下结节,还侵犯脑和脊髓,引起颅内占位、破坏、出血、水肿,可表现为癫痫、偏瘫等,严重者可终身残疾[2]。虫体移行的机械破坏作用、代谢分泌物等抗原的致敏作用是其主要致病机制。
本文通过脑立体定位仪微量注射斯氏并殖吸虫成虫抗原至大鼠大脑皮质,模拟肺吸虫脑病大鼠模型,通过光镜和电镜观察病理变化。
1 材料与方法
1.1 材料与仪器
1.1.1 实验动物 健康雄性SPF级SD雄性大鼠,体重(360±20)g,共6只,由泸州医学院实验动物中心提供。
1.1.2 主要试剂 多聚甲醛,骨蜡购自上海三友外科器械有限公司;二甲苯、中性多聚甲醛、无水乙醇购自四川航嘉生物医药科技有限公司。
1.1.3 主要仪器 脑立体定位仪(NARISHIGESN-3型,日本);透射电子显微镜(JEM-1400,日本);超薄切片机(莱卡2150)。
1.2 方法
1.2.1 获取斯氏并殖肺吸虫成虫,制备抗原 采取斯氏并殖吸虫病流行区溪蟹;研碎、多次换水沉淀至清;解剖显微镜下分离获取囊蚴,鉴定为斯氏并殖吸虫囊蚴,采用腹腔注射法感染家犬,每只犬注射200个囊蚴,共感染3只犬,饲养观察3个月。解剖犬,无菌条件下从犬肺及肝虫囊中取出成虫。虫体经灭菌生理盐水洗净、剪碎、干燥、研磨、脱脂,再经冷浸;3 000 r/min离心,取上清,测其蛋白含量6.735 mg/mL,分装冰箱(-20℃)保存备用。
1.2.2 大鼠并殖吸虫脑病模型[3]实验组和对照组各3只大鼠,用1%的戊巴比妥钠用腹腔注射麻醉,实验组:脑立体定向仪下15 min内缓慢注射并殖吸虫抗原50μL,在无菌条件下进行;饲养观察24 h。
1.2.3 大鼠的灌注固定和脑组织取材 大鼠麻醉后,开胸,灌注4℃的4%多聚甲醛磷酸缓冲液400~600 m L,以进针中心取鼠脑,置入10%中性福尔马林液中固定。
1.2.4 组织病理学观察 取脑组织,经固定、石蜡包埋,4 μm切片后常规脱水、苏木素-伊红染色、脱水透明、封片镜检。
1.2.5 电镜观察 将脑组织置4%戊二醛液固定1 h;以0.1 mol/L磷酸缓冲液冲洗3次,每次30 min;后用1%四氧化锇固定1 h,同样方法冲洗3次;丙酮系列脱水,丙酮:包埋剂Epon 8l2环氧树酯(1∶1和1∶2)与纯包埋剂系列渗透,包埋聚合;超薄切片;经铀铅双重染色;在电子显微镜下观察。
2 结 果
2.1 光镜检查
2.1.1 正常对照组 大鼠脑神经元和尼氏小体完整,见图1。
2.1.2 实验组 大鼠脑血肿周围脑组织水肿明显(组织疏松、细胞间隔增宽),且局灶状坏死;毛细血管轻度增生、充血;神经元皱缩,尼氏小体溶解,周围出现间隙,神经突呈浅淡或消失;可见嗜酸性粒细胞,单核细胞及胶质细胞反应,见图2。
2.2 电镜观察
2.2.1 对照组 大鼠皮质神经元核仁清晰,核膜完整;染色质均匀,线粒体无肿胀,线粒体嵴结构正常;粗面内质网结构正常。
2.2.2 实验组 大脑皮质可见暗细胞。大脑皮质中神经元胞体肿胀,核移位且形状不规则,核膜凸凹不平、模糊、断续甚至溶解消失,核质溢出;常染色质为不均匀的絮状,异染色质多,呈浓密的团块状,核仁绒球形;线粒体电子密度增高,肿胀,嵴断裂;粗面内质网扩张呈囊泡化;高尔基复合体扁囊扩张、结构紊乱;溶酶体少见;脂褐素、糖原较多;神经胶质细胞核核膜清晰,异染色质多,见图3-5。
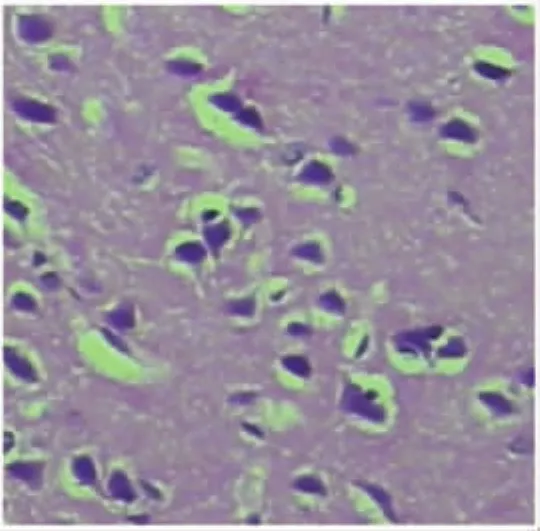
图1 对照组鼠脑组织神经元和尼氏小体完整,HE×100Fig.1 Intact neurons and nissl in rat brain in normal group,HE×100
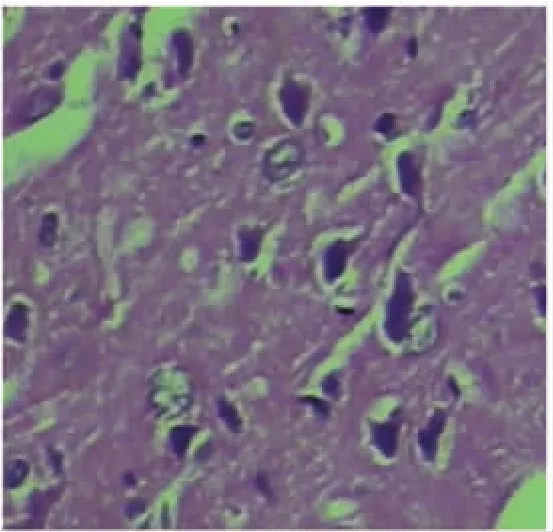
图2 实验组鼠脑皮质H神经元固缩,HE×200Fig.2 Cortex neuron pyknosis in rat brain in antigen injection group,HE×200
3 讨 论

图3 实验组鼠脑皮质神经元细胞核水肿(A),染色质溶解(C),核膜(D),核仁(b)形态正常,核周间隙(E)清晰,细胞器大面积水肿,线粒体水肿,嵴破坏(F),×10000Fig.3 Cerebral cortical neurons in the nucleus edema(A),the chromatin solution (C),the nuclear membrane(D),nucleolus(B),perinuclear space(E),and cristae damage(F)in the rat brain in antigen injection group,×10 000
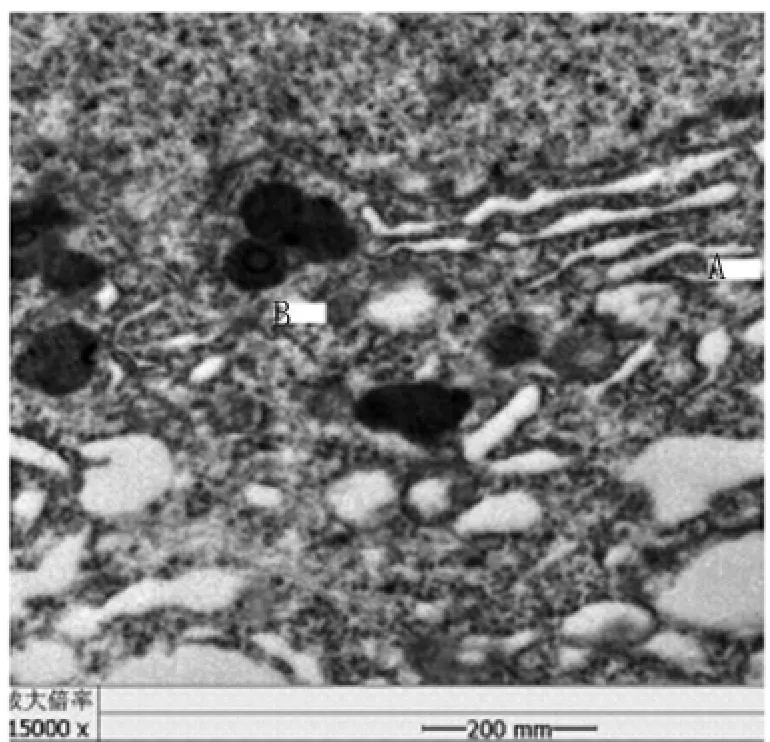
图4 实验组鼠脑皮质神经元中内质网扩张(A),脂褐素明显(B),×15000Fig.4 Neurons in the endoplasmic reticulum expansion(A),and significant lipofuscin(B)in rat brain cortex in antigen injection group,×15 000
肺吸虫的致病主要由童虫及成虫的机械性损伤及虫体代谢产物等抗原物质导致的免疫病理反应引起,临床表现多样,有胸肺型、皮肤型、脑脊髓型、腹型、肝型、心包型、眼型、阴囊肿块型、亚临床型[4]。斯氏并殖吸虫童虫移行侵入脑内,包括脑膜、脊髓膜、脑实质,造成脑型肺吸虫病。临床多表现为头痛、发热、呕吐、颈强直及颅内高压症状与局限性神经体征,难与脑膜炎、脑肿瘤准确区分。有关肺吸虫引起脑损伤的机制报道不多。由于很难取得并殖吸虫对脑组织损害标本,本实验通过脑立体定位仪微量注射并殖吸虫抗原至大鼠大脑皮质,模拟并殖吸虫损伤脑组织;在光镜、电镜观察其所致的病理变化。实验鼠脑组织水肿明显,且局灶状坏死,神经元皱缩,尼氏小体溶解,神经突呈浅淡或消失,可见单核细胞及胶质细胞反应。表明斯氏并殖吸虫脑病模型大鼠脑组织有严重炎症病理反应。电镜观察到抗原注射大鼠大脑皮质神经元胞体肿胀,核移位且形状不规则,核膜凸凹不平,线粒体肿胀,粗面内质网扩张,脂褐素较多。表明肺吸虫抗原注射大鼠脑可引起脑组织超微结构改变:细胞肿胀,线粒体肿胀,内质网扩张。肺吸虫的机械破坏和细胞毒素抗原等炎症分子,引起大鼠脑组织和细胞超微结构病理改变。
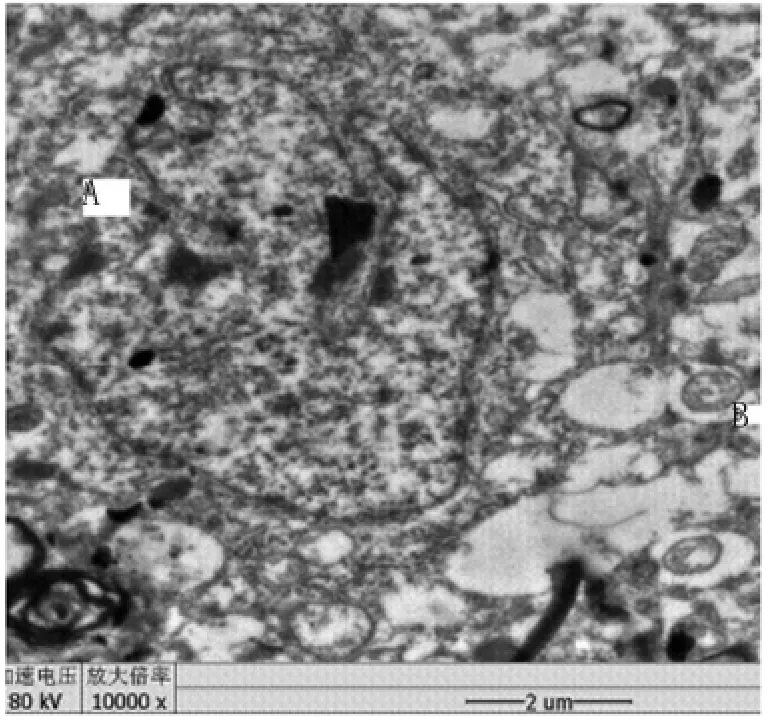
图5 实验组鼠脑皮质神经元线粒体(B)水肿嵴断裂、空泡化,细胞核不规则,核膜溶解,凹凸不平(A)×10 000Fig.5 Mitochondria edema crest fracture(B),vacuolization,nuclear irregularity,nuclear membrane dissolves,uneven surfaces(A)in rat brain cortex in antigen injection group,×10 000
[1]Liu Q,Wei F,Liu W,et al.Paragonimiasis:an important foodborne zoonosis in China[J].Trends Parasitol,2008,24(7):318-323.DOI:10.1016/j.pt.2008.03.014
[2]Lee JC,Cho GS,Kwon JH,et al.Macrophageal/microglial cell activation and cerebral injury induced by excretory-secretory products secreted byParagonimuswestermani[J].Neurosci Res,2006,54(2):133-139.DOI:10.1016/j.neures.2005.11.001
[3]Yang CX,Zhou L,Gao XQ,et al.The expression and significance of proliferating cell nuclear antigen in brain tissue of rats following experimental intracerebral hemorrhage[J].Chin J Neuroanat,2008,24(5):533-537.(in Chinese).
杨朝鲜,周玲,高小青,等.增殖细胞核抗原在实验性脑出血大鼠脑组织中的表达及其意义 [J].神经解剖学杂志,2008,24(5):533-537.
[4]Shen YP,Shao XY,Li YS,et al.Practical paragonimiasiology[M].2nd ed,Beijing:People's Medical Publishing House,2008:124-129.(in Chinese)
沈一平,邵向云,李友松,等.实用肺吸虫病学[M].2版.北京:人民卫生出版社.2008:124-129.
