我国G2型人蛔虫和猪蛔虫的遗传多样性*
2012-08-21周春花彭卫东
周春花,彭卫东
2.南昌大学生命科学与食品工程学院生物技术系,南昌 330031
人蛔虫(Ascarislumbricoides)和与其同属的猪蛔虫(A.suum,)是具有重要社会经济意义的常见土源性线虫,其分类学地位一直存有争议,而近20年来分子分型的研究对这两种蛔虫的遗传结构、流行病学和种群演化等方面提供了丰富的信息[1]。比如,用ITS1对我国蛔虫的基因分型,发现共有5种基因型(G1-G5),在人蛔虫种群以G1型为主(约占70%);而猪蛔虫种群中则以G3为主(约80%);各基因型的在不同地区同一宿主内的分布频率基本上相同,而在不同宿主之间的分布明显不同[2]。线粒体DNA的2个基因片段COX1和NAD1的筛选也得到类似结果[3]。进一步用来自人体的G1型和来自猪体的G3型蛔虫分别实验感染C57BL/6小鼠和猪,结果表明,不同基因型的蛔虫具有不同的宿主寄生特异性[4-6]。
G2型是人蛔虫和猪蛔虫共有的基因型,其在人蛔虫种群中占25.5%,而在猪蛔虫占15.2%[2]。如果说,G1和G3型在各宿主的分别偏好提示了人型蛔虫和猪型蛔虫的不同宿主特异性,那么G2型是否也存在某种差异性?有趣的是,初步实验感染结果表明,来自人体的G2型蛔虫不能在猪体内发育为成虫,而来自猪的G2型蛔虫却能够在猪体内发育为成虫[6];鉴于ITS1标记不能进一步区分G2型蛔虫,故有必要借助其它分子标记对其遗传变异进行进一步研究。微卫星在基因组中数量多、分布广、多态性丰富、呈孟德尔共显性遗传等特点而被广泛应用于动物种群间亲缘关系、群体内和群体间遗传变异等的检测。近年来使用微卫星标记,发现了人蛔虫和猪蛔虫杂交个体的存在[7-8]以及猪蛔虫一妻多夫现象[9];另外,谱系地理学研究提示人蛔虫线粒体COX1的H9单倍体可能是猪蛔虫远古祖先[10]。这些都表明人蛔虫和猪蛔虫之间的关系并非是仅仅“同种或者异种”那么简单。尤其是对人和猪共有的占有种群相当比例的同为G2型的蛔虫,其遗传变异情况尚不了解。因此,本研究通过20个常染色体微卫星座位对中国G2型蛔虫进行遗传多样性研究,以揭示G2型人蛔虫和G2型猪蛔虫遗传学差异及其在流行病学方面的可能启示。
1 材料与方法
1.1 材料 本研究所用的69个G2型蛔虫样本均来自Peng等自我国6省(自治区)采集的标本[2],其中48条来自人体,21条来自猪体内。
1.2 主要试剂和仪器 蛔虫组织DNA提取试剂盒(WizardSVGenomicDNAPurificationSystem)购自Promega公司,荧光引物由上海英骏生物技术有限公司合成,DNA Taq酶(PremixTaqVersion 2.0)购自宝生物工程(大连)有限公司。热循环仪为德国Eppendorf公司产品。STR扫描由上海生工生物技术有限公司完成。
1.3 方法
1.3.1 基因组DNA的提取 从卡洛氏液中取出蛔虫样本,剪下一小段(约5 mm)用滤纸吸去固定液并浸泡于双蒸水中回水24 h以上,其间更换双蒸水至少6次,吸干管中的液体,于50℃烘干15 min。参照试剂盒的操作步骤提取基因组DNA。
1.3.2 微卫星扩增 采用20对常染色体微卫星引物进行扩增。反应体系为20μL,上下游引物各0.2μmol/L,1μL DNA模板,加水至20μL。反应条件为94℃预变性5 min,先进行5个循环的高温PCR:94℃变性45 s,退火30 s,72℃延伸1 min,再进行30个循环的低温PCR:94℃变性45 s,退火30 s,72℃延伸1 min,最后72℃延伸7 min。引物及退火温度详见表1。
1.3.3 等位基因分型 PCR扩增产物先用1.5%琼脂糖电泳检测是否有扩增产物,以及扩增产物是否在所需的长度范围内。再送往上海生工生物技术有限公司进行STR扫描,由该公司利用测序仪进行毛细管电泳,配合Genemapper软件分析确定微卫星片断长度。
1.3.4 数据分析 通过 CERVUS V2.0[11]计算各个位点的等位基因数、等位基因频率、观测杂合度(observed heterozygosities,H O)、期望杂合度(expected heterozygosities,H E)和多态信息含量(polymorphism information content,PIC)。利用软件GENETIX V4.05[12]计算人蛔虫和猪蛔虫间的遗传分化程度FST和基因流Nm。应用ARLEQUIN V3.11[13]进行分子变异方差分析(analysis of molecular variance,AMOVA),估测遗传变异在种群间和种群内的分配情况。
2 结 果
2.1 G2型人蛔虫和G2型猪蛔虫的等位基因及频率差异 G2型人蛔虫共检出378个等位基因,范围在3~31,平均每对引物可检测18.9个等位基因;G2型猪蛔虫共检出229个等位基因,范围在5~19,平均每对引物可检测11.45个等位基因。G2型人蛔虫的等位基因频率在0~0.821之间;G2型猪蛔虫的等位基因频率在0~0.833之间。20个微卫星座位共检测到433个等位基因,变化范围为5~38,平均每个位点等位基因数21.65个。在G2型人蛔虫中位点19的多态性最丰富,有31个等位基因,在G2型猪蛔虫中位点18的多态性最丰富,有19个等位基因;最少的在G2型人蛔虫中有3个等位基因,在G2型猪蛔虫中有5个等位基因,均为位点15。从各微卫星基因座位的等位基因频率来看,各个等位基因频率分布不均匀,每个基因座位都有一种相对优势等位基因存在。20个基因位点中有14个位点在2个蛔虫种群中的优势等位基因一致,6个基因位点(位点1、6、10、12、16和17)在2个蛔虫种群中的优势等位基因不一致。部分等位基因在不同蛔虫种群中所占的比例存在较大的差异。两个种群在除位点13G2型猪蛔虫无特有等位基因,位点15G2型人蛔虫无特有等位基因外,其它位点中均存在各自的特有等位基因,其中G2型人蛔虫有204个特有等位基因,G2型猪蛔虫有55个特有等位基因,见表2。

表1 20对微卫星引物及退火温度Tab.1 Twenty pairs of microsatellite primers and annealing temperature
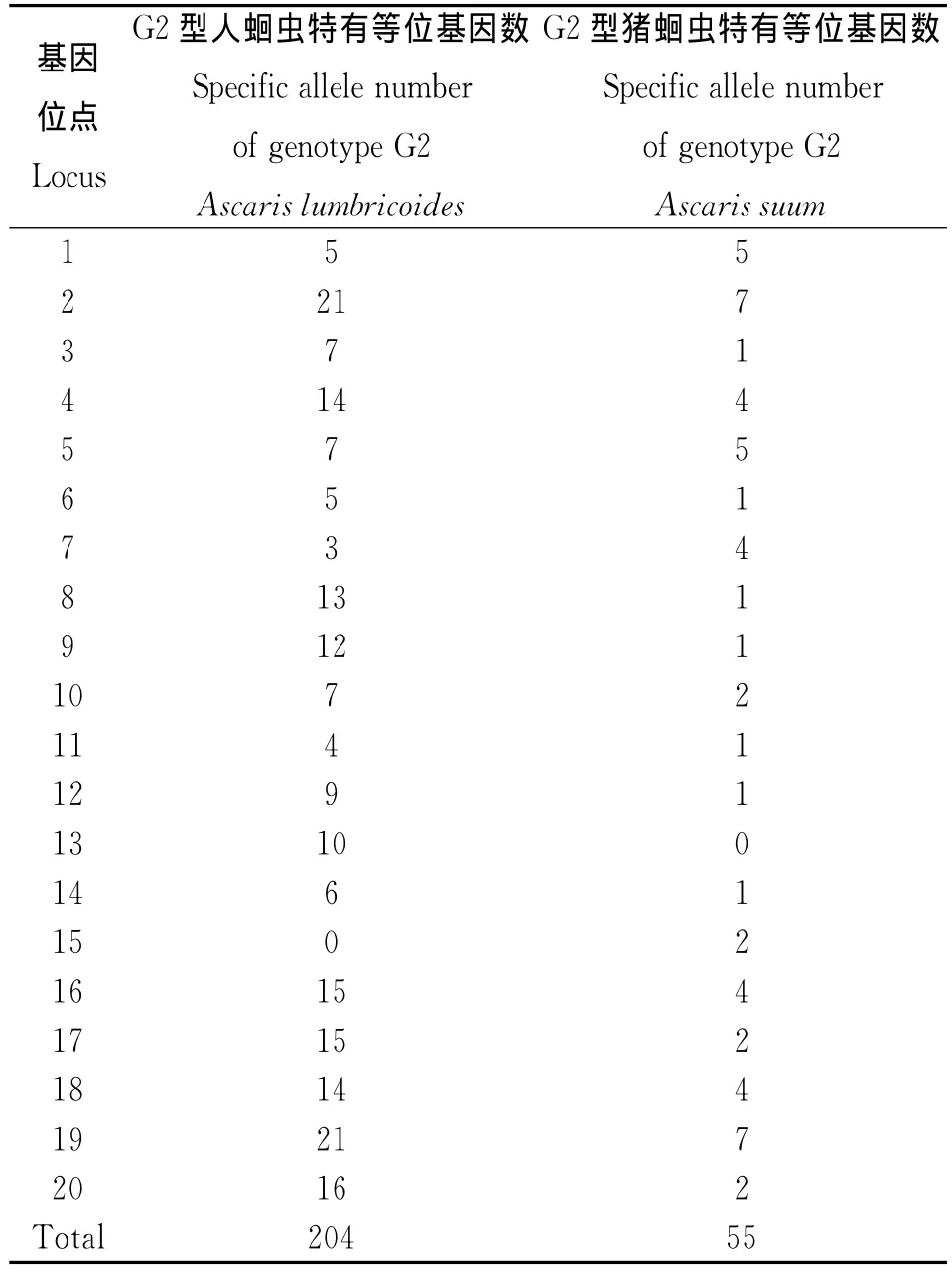
表2 G2型人蛔虫和猪蛔虫各位点特有等位基因数Tab.2 Number of unique alleles in Ascaris from humans and pigs with genotype G2
2.2 G2型人蛔虫和猪蛔虫的遗传多样性参数G2型人蛔虫和猪蛔虫的观测杂合度H O,期望杂合度H E,多态信息含量PIC,详见表3。结果表明,G2型人蛔虫在各位点的观测杂合度H O、期望杂合度H E和多态信息含量PIC分别为0.262~0.909、0.324~0.951和0.312~0.937,均值分别为0.565、0.802和0.779;G2型猪蛔虫在各位点的观测杂合度H O、期望杂合度H E和多态信息含量PIC分别为0.143~0.950、0.307~0.937和0.291~0.908,均值分别为0.533、0.777和0.737。
2.3 蛔虫种群遗传分化和遗传结构 本实验对两个蛔虫种群的F统计量计算为:0.3218(F IT),0.3031(FIS),0.0268(FST)。两种群间的基因流Nm值为9.08。分子变异方差分析(AMOVA)发现,仅有2.6%的遗传变异来自于种群间,其余68.6%的变异均来自于个体间,个体间遗传变异大于种群间的遗传变异(表4)。

表3 G2型人蛔虫和猪蛔虫的观测杂合度(HO)、期望杂合度(H E)和多态信息含量(PIC)Tab.3 Observed heterozygosity(HO),expected heterozygosity(H E),and polymorphic information content(PIC)in Ascaris from humans and pigs with genotype G2
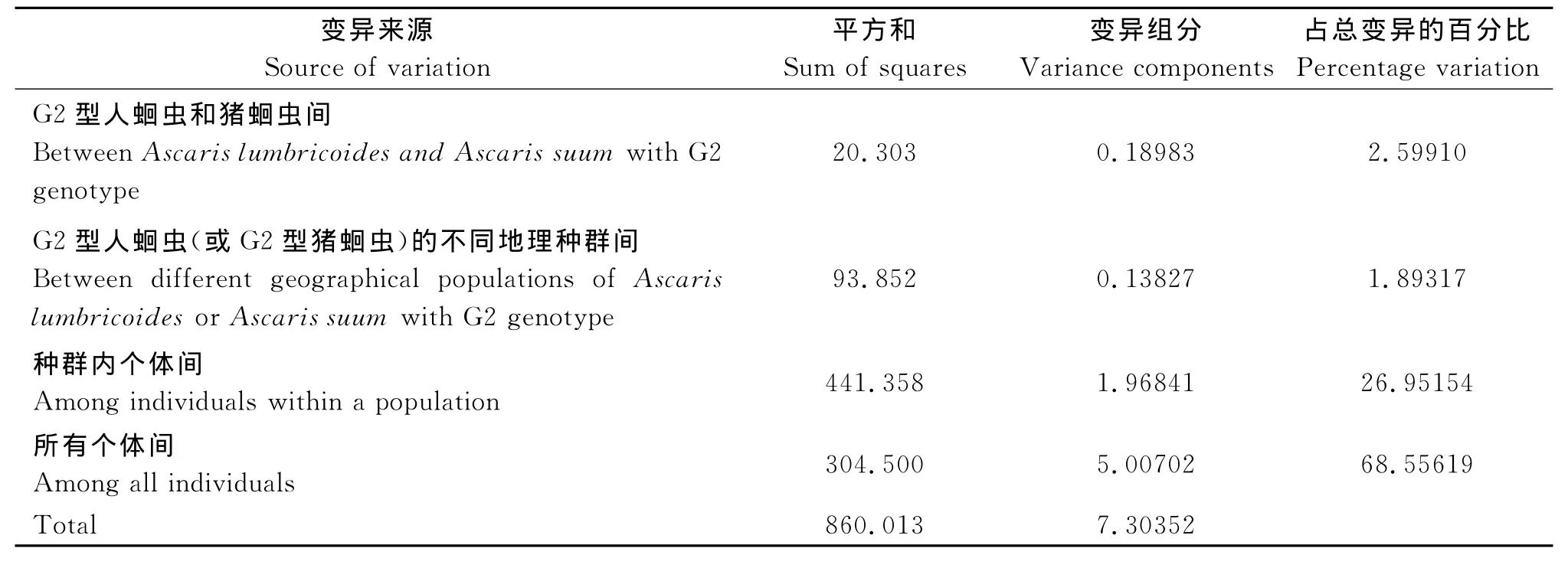
表4 G2型人蛔虫和猪蛔虫种群的分子变异方差分析Tab.4 Analysis of molecular variation of two Ascaris populations
3 讨 论
3.1 蛔虫微卫星标记和等位基因 本研究结果表明所用的20个微卫星位点具有较丰富的遗传多态性。从各位点的等位基因频率来看,其频率分布不均,每个位点都有一种或几个优势等位基因(即频率最高的等位基因)存在。在20个基因位点中,有14个位点在2个蛔虫种群中的优势等位基因一致,6个不一致。此外,位点中均存在各自的特有等位基因(表2)。种群中的优势等位基因往往是该物种中最保守和最原始的,而其余的等位基因则是优势等位基因在进化过程中因DNA突变等机制而形成。G2型的人蛔虫和猪蛔虫优势等位基因的不同以及特有等位基因的差异,可能和它们在宿主选择上的差异[4-6]有关。
3.2 G2型人蛔虫和猪蛔虫种群遗传多样性 在微卫星标记技术中,期望杂合度H E和多态信息含量PIC是用于估测种群遗传多样性的重要指标。G2型人、猪蛔虫的平均H E分别为0.802和0.777(表3),说明各自都存在较大的遗传变异。PIC是表示微卫星位点变异程度高低的一个指标,本文中G2型人、猪蛔虫种群在20个微卫星位点都有较高的多态性。在人蛔虫种群有4个中度、16个高度多态基因位点;而猪蛔虫种群有2个中度、18个高度多态基因位点(表3)。同一微卫星座位在不同蛔虫宿主种群间以及同种宿主种群不同微卫星座位间的多态信息含量都存在差异。前者反映了G2型人、猪蛔虫间遗传多样性之间的差异,这种差异可能与宿主有关;而G2型人蛔虫或G2型猪蛔虫中不同的微卫星座位之间的多态信息的差异,可能和长期的自然和人为的选择过程中(如驱虫药的使用),不同的微卫星座位所受的选择压力不同有关。从G2型人蛔虫和G2型猪蛔虫在各位点的观测杂合度H O、期望杂合度H E和多态信息含量PIC来看,G2型人蛔虫的遗传多样性和G2型猪蛔虫的相似,均有较高的遗传多样性,而G2型人蛔虫的遗传多样性稍高于G2型猪蛔虫。
3.3 G2型人蛔虫和猪蛔虫间的种群遗传分化和基因流分析 种群间的遗传分化系数FST是反映各种群遗传分化的重要指标。本研究得出G2型人蛔虫和G2型猪蛔虫间的FST值为0.0268,根据Wright对FST值4个分级来判断[14],说明G2型的两种蛔虫间遗传分化水平较低,这不仅与现有种群内高的遗传多样性有关,还可能与种群间的基因流有关。基因流是种群遗传结构均质化的主要因素之一,具有高水平基因流的物种往往比具有有限基因流的物种遗传分化小,当Nm>4时,种群间的基因交流比较充分,均质化作用足以抵制遗传漂变的作用,可以防止种群间遗传分化的产生;当Nm<1,遗传漂变为种群遗传结构变化主要因素[15]。本研究G2型人蛔虫和猪蛔虫间的Nm为9.08,说明在蛔虫进化过程中,遗传漂变未成为群体遗传结构变化的主要因素,G2型人、猪蛔虫基因交流机会较多,这和从线粒体基因研究得出的结果一致[10],而G2型人、猪蛔虫杂交个体的客观存在,即是这两种蛔虫之间较高水平基因流的证明[8]。
[1]Peng W,Criscione CD.Ascariasis in people and pigs:new inferences from DNA analysis of worm populations[J].Infect Genet Evol,2012,12(2):227-235.DOI:10.1016/j.meegid.2012.01.012
[2]Peng W,Yuan K,Zhou X,et al.Molecular epidemiological survey ofAscarisgenotypes in China based on single strand conformation polymorphism analysis of ribosomal DNA[J].Electrophoresis,2003, 24 (14): 2308-2315. DOI: 10.1002/elps.200305455
[3]Peng W,Yuan K,Hu M,et al.Mutation scanning-coupled analysis of haplotypic variability in mitochondrial DNA regions reveals low gene flow between human and porcineAscarisin endemic regions of China[J].Electrophoresis,2005,26(22):4317-4326.DOI:10.1002/elps.200500276
[4]Peng W,Yuan K,Hu M,et al.Experimental infections of pigs and mice with selected genotypes ofAscaris[J].Parasitology,2006,133(Pt 5):651-657.DOI:10.1017/S0031182006000643
[5]Peng W,Yuan K,Peng G,et al.Ascaris:Development of selected genotypes in mice[J].Exp Parasitol,2012,131(1):69-74.DOI:10.1016/j.exppara.2012.03.006
[6]Peng W,Yuan K,Hu M,et al.Recent insights into the epidemiology and genetics ofAscarisin China using molecular tools[J].Parasitology,2007,134(Pt 3):325-330.DOI:10.1017/S0031182006001521
[7]Criscione CD,Anderson JD,Sudimack D,et al.Disentangling hybridization and host colonization in parasitic roundworms of humans and pigs[J].Proc Boil Sci,2007,274(1626):2669-2677.DOI:10.1098/rspb.2007.0877
[8]Zhou C,Li M,Yuan K,et al.PigAscaris:An important source of human ascariasis in China[J].Infect Genet Evol,2012,12(6):1172-1177.DOI:10.1016/j.meegid.2012.04.016
[9]Zhou C,Yuan K,Tang X,et al.Molecular genetic evidence for polyandry inAscarissuum[J].Parasitol Res,2011,108(3):703-708.DOI:10.1007/s00436-010-2116-3
[10]Zhou C,Li M,Yuan K,et al.Phylogeography ofAscarislumbricoidesandA.suumfrom China[J].Parasitol Res,2011,109(2):329-338.DOI:10.1007/s00436-011-2260-4
[11]Marshall TC,Slate J,Kruuk LE,et al.Statistical confidence for likelihood-based paternity inference in natural populations[J].Mol Ecol,1998,7(5):639-655.DOI:10.1046/j.1365-294x.1998.00374.x
[12]Belkhir K,Borsa P,Chikhi L,et al.GENETIX,a WindowsTMbased software for population genetic analyses[OL].Laboratoire Génome,Populations,Interactions CNRSUMR 5000,Universitéde MontpellierⅡ,Montpellier,France,2000.http://www.univmontp2.fr^genetix/genetix.htm
[13]Excoffier L,Laval G,Schneider S.Arlequin(version 3.0):an integrated software package for population genetics data analysis[J].Evol Bioinform Online,2007,1:47-50.
[14]Wright S.Evolution and the genetics of population,Vol 4.Variability within and among natural populations[M].Chicago:University of Chicago Press,1978.
[15]Whitlock MC,McCauley DE.Indirect measures of gene flow and migration:[J].Heredity (Edinb.),1999,82(Pt 2):117-125.
