2010年-2011年我国五省PRRSV分离株ORF5基因遗传变异分析
2012-08-14刘沫飞王赛赛吴发兴李晓成王洪斌黄保续
刘沫飞,李 蕾,郑 辉,李 岚,王赛赛,吴发兴,李晓成,王洪斌,黄保续*
(1.东北农业大学,黑龙江哈尔滨150036;2.中国动物卫生与流行病学中心,山东青岛266000;3.云南农业大学,云南昆明650201;4.福建农林大学,福建福州350002)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种严重危害养猪业的高度接触性传染病[1-2],临床症状主要为妊娠母猪流产、弱仔、木乃伊胎等繁殖障碍以及各种年龄猪的呼吸系统疾病,俗称猪蓝耳病[3]。PRRSV属动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus),基因组全长约15kb,包括9个开放阅读框(open reading frame,ORF),每个开放阅读框都有不同程度的重叠,分别编码病毒复制酶、糖蛋白、膜蛋白(M蛋白)和核衣壳蛋白(N蛋白)[4]。1987年在美国首先发现此病,1991年在荷兰首次分离到病原,命名Lelystad virus(LV )[5]。1992年美国学者分离到该病毒,命名为 ATTC VR-2332(Wensvoort,1993)[6]。我国首次报道是在1996年,由郭宝清分离到PRRSV。根据抗原性及基因序列差异将病毒分为欧洲型(原型毒株为LV)和美洲型(原型毒株为VR-2332)两大类,欧洲型PRRSV主要流行于欧洲地区,而美洲型PRRSV主要流行于美洲和亚太地区[7],两者核苷酸序列同源性约为60%,其中ORF5同源性仅为54%。猪是PRRSV的惟一天然宿主,血清学和流行病学调查结果表明野猪同样也可自然感染。各种年龄段的猪只都可被感染,尤其妊娠母猪和仔猪更加易感。但在人工感染试验中,部分禽类(如绿头鸭)对PRRSV特别易感,但是属于无症状感染[8]。
本病的流行给全球养猪行业带来巨大的经济损失,特别是我国2006年发生的高致病性PRRS[9],由于其变异程度较大,造成猪群大批量死亡。本研究通过对2010年-2011年分离自我国部分省的PRRSV,通过对PRRSV的分离鉴定以及ORF5的基因序列进行分析,了解我国部分省PRRSV感染情况和基因的变异情况,研究毒株的遗传演化特点,为我国本病防控工作提供参考。
1 材料与方法
1.1 材料
1.1.1 病料 采集于我国辽宁(LN)、河北(HB)、河南(HN)、山东(SD)、安徽(AH)五省不同类型的发病猪场的疑似发病样品和屠宰场的样品15份,样品为猪的肺、脾、肾、淋巴结等组织。
1.1.2 细胞 Marc-145细胞,由中国动物卫生与流行病学中心检测室保存,外源病原检测结果为纯净。1.1.3 菌株与克隆载体 PGEM-TEasy载体克隆试剂盒为Promega公司产品,DH 5α大肠埃希菌为宝生物工程(大连)有限公司产品,置-80℃保存备用。
1.1.4 主要试剂 DMEM培养基,新生小牛血清为Hy Clone公司产品;Trizol为Invitrogen公司产品;AMV 酶、RNA 酶 抑 制 剂、DNA Marker DL 2 000、DNA Marker DL 15 000、r Taq 酶、dNTP、BamHⅠ及HindⅢ限制性内切酶均为宝生物工程(大连)有限公司产品;DNA胶回收试剂盒为上海生工生物工程技术服务有限公司产品,其余试剂均为分析纯产品。
1.2 方法
1.2.1 病料处理方法 无菌操作剪取2.0g组织,加入少量的DMEM(含青霉素、链霉素1 000U),研磨至糊状,再加入3倍体积的DMEM稀释成悬浊液,分装到无菌离心管中,样品在-80℃和37℃反复冻融3次,置-80℃冻存备用。
1.2.2 引物设计与合成 参考GenBank中收录的PRRSV JXA1、VR-2332、CH-1a、HUB1的基因序列,设计出扩增ORF5(603bp)基因全序列的特异性引物。
1.2.3 病毒分离 将冻存的组织悬液10 000 r/min离心5min,取上清液1mL,用0.22μm滤器过滤除菌,接种到单层的Marc-145细胞,37℃吸附1.5h后,加入6mL细胞维持液(含20mL/L新生小牛血清的DMEM培养基),将培养瓶置于体积分数为5%CO2培养箱中37℃培养,观察记录病变,待约75%的细胞出现典型的CPE(约72h~96h)收获病毒。置-80℃冻存备用。
1.2.4 PRRSV总RNA提取 按Invitrogen公司的Trizol reagent RNA提取试剂盒操作说明书,提取病毒基因组总RNA。将处理好的样品每份取250μL,然后加750μL Trizol,剧烈混匀,室温放置5min;再加入200μL氯仿,振荡混匀,4℃放置10min;12 000 r/min、4℃离心15min;取上清500μL,加等体积低温的异丙醇,混匀,室温静置10min,12 000r/min、4℃离心12min;弃上清,加入1mL浓度为750mL/L的乙醇(DEPC处理过的),7 500r/min离心5min;弃上清,倒置20min后,用20μL的DEPC处理水溶解,置-80℃冻存备用。
1.2.5 PRRSV RT-PCR检测 反转录体系:取5μL RNA,5×reverse transcripatase buffer 4μL、dNTP mixture(2.5mmol/L)4μL、RNaseinhibitor 0.5μL、AMV reverse transcrpatase 0.5μL、下游引物1μL(20pmol/μL)、DEPC处理水加至20μL。反应条件为,42℃水浴1.5h,即得cDNA 模板。PCR反应体系:cDNA模板3μL、10×PCR buffer 2.5μL、dNTP mixture(2.5mmol/L)2.0μL、ExTaq0.5μL、上、下游引物 PF/PR 各0.5μL,DEPC处理水加至25μL。PCR产物用10g/L琼脂糖凝胶、150V电压40min电泳检测。1.2.6 序列分析 用DNA Star中软件对所获得的15株PRRSV分离株ORF5基因序列进行比较分析,与国内已发表的CH-1a、BJ-4、JXA1、HB-1、HB-2、HUN4、CC-1、GD2007、YN2008、SX2009、S1、HuN06、Em2007、SD-JN、SD-LC1、SD-4、SD0612等毒株和国外已发表的标准株LV、VR-2332、MLV等19株参比毒株(表1),共34株毒株分别进行核苷酸序列比较。
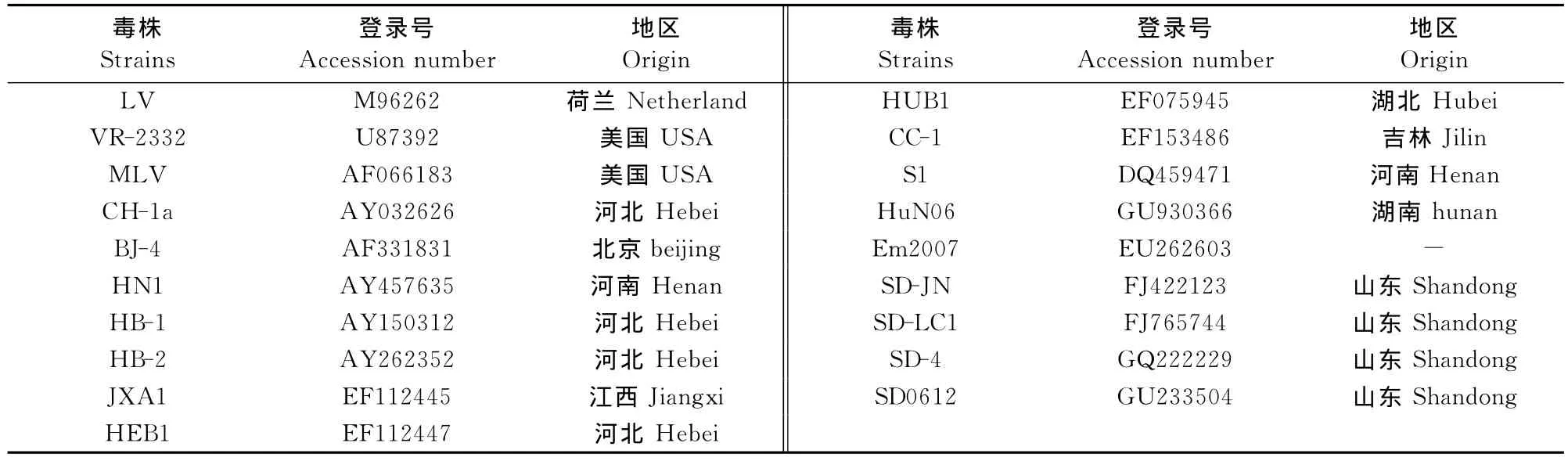
表1 本试验所用的ORF5基因参比毒株Table 1 The ORF5gene reference strains used in this study
2 结果
2.1 病毒的分离与鉴定
将我国5个省份(辽宁、河北、河南、山东、安徽)15株阳性样品接种到细胞后,出现明显细胞病变(CPE)的样品有15株。将样品过滤后的组织悬液接种于Marc-145细胞,传至第1代和第2代均未出现明显的CPE,当病毒传代至第3代时开始出现CPE,病变特征为细胞折光性增强、细胞变圆、膨大,部分细胞发生聚堆现象呈葡萄串状,随后细胞发生皱缩、灶状脱落,最后出现大片空泡,符合PRRSV感染Marc-145细胞所出现的典型CPE。
2.2 分离毒株目的基因的扩增
对经Marc-145细胞增殖的15个分离毒进行ORF5基因的RT-PCR扩增,获得了与预期大小相符的特异性片段(图1)。
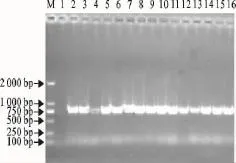
图1 PRRSV阳性样品的ORF5扩增Fig.1 Amplification of ORF5gene PRRSV positive samples
2.3 目的基因序列测定及比对分析
经送样测序获得15株ORF5序列,测序结果经登陆GenBank进行比对分析,证实皆为PRRSV的基因序列。
2.3.1 分离株ORF5基因推导的氨基酸序列同源性分析 通过DNA Star软件分析,测得的15个分离株的ORF5基因所推导氨基酸序列之间的同源性95.5%~99.5%,辽宁4株分离株之间的同源性为96.5%~99.5%,河南3株分离株之间的同源性96.5%~98.5%,安徽2株分离株之间的同源性为96.0%,河北2株分离株之间的同源性为98.0%,山东4株分离株之间的同源性为96.0%~97.5%。与VR2332(美洲型代表株)、MLV(疫苗株)、CH-1a(中国代表毒株)、JXA1(高致病株)、HB-1和 HB-2的ORF5基因推导的氨基酸序列同源性分别为86.1%~88.6%、85.6%~87.6%、90.5%~92.0%、97.5%~98.5%、92.0%~95.5%和88.6%~90.0%,与国内其他毒株 HEB1、CC-1、HuN06、SDJN、SD-4的ORF5基因推导的氨基酸序列同源性分别为97.5%~98.5%、85.1%~87.1%、97.0%~98.5%、97.5%~98.5%、96.5%~99.0%,15株PRRSV分离株与欧洲性代表毒株LV ORF5同源性为63.5%~64.4%。
2.3.2 分离株ORF5基因推导氨基酸序列的变异性分析 应用DNA Star软件中的Protean软件对15个分离株ORF5基因的推导氨基酸序列进行分析,15个分离株的ORF5基因编码200个氨基酸,国内外参考毒株相比,结果发现,所测的分离株的GP5蛋白存在部分氨基酸的突变,分离株ORF5基因编码蛋白GP5的推导氨基酸序列的变异主要发生在9位~39位。GP5氨基酸序列的第13位和第151位被认为是与毒力相关的位点,15个分离株的GP5第13位的R13位均未发生变异,第151位有BFHB1-2011 株、BFHB2-2011 株、BFHN1-2011株、BFHN3-2010株、BFLN1-2010株、BFLN1-2011株、BFLN2-2010株、BFSD1-2010株、BFSD2-2011株9个分离株发生R151→K151的突变,突变结果与参比序列HN1一致,其余6株的R151没发生突变,这与BJ-4、CC-1、S1和MLV等弱毒株或疫苗毒株的R151→G151不同,证明分离株为强致病性毒株。同时,所有毒株均发生A137→S137的突变。目前已确定的GP5抗原表位中包括3个B细胞表位和2个T细胞表位[10]。B细胞表位中,第1个表位(27aa~30aa)是影响免疫的关键表位,为非中和表位,又称诱骗表位(decoy epitope)[11],本研究所获得的15个分离株中BFAH2-2011、BFLN3-2010和BFSD1-2011发生V29→A29突变;第2个表位(37aa~45aa)是 GP5的主要中和表位(primary neutralizingepitope,PNE),15个分离株均未发生突变;第3个表位(180aa~197aa)是非中和表位,15个分离株变异较大,其中BFAH1-2010株、BFHB2-2011株、BFHN1-2010株、BFHN1-2011株、BFSD2-2010株、BFSD2-2011株发生Q196→L196突变,突变后与JXA1一致,BFHB1-2011株、BFHN3-2010株、BFLN1-2010株、BFLN1-2011 株、BFLN2-2010株、BFSD1-2010株发生 Q196→R196,而BFSD1-2011株、BFLN3-2010株、BFAH2-2011株未发生突变。T细胞表位中,所有毒株在第一个表位(117aa~131aa)均未发生突变。另外15个分离株137位aa全部为S,与疫苗(MLV)株的137位aa不同,说明本研究所获得分离株均为野毒株。
2.3.3 GP5遗传进化分析 依据DNA Star软件中的Meg Align,对ORF5基因序列建立系统进化树见图2,将测得15株PRRSV的ORF5基因序列与国内外代表毒株进行对比分析,根据结果可以将PRRSV分为欧洲型和美洲型两个基因型,其中美洲型又可以分为2亚群,所获得的PRRSV分离株与VR2332遗传关系较远,BFLN1-2010等12个分离株与HUB1和JXA1亲缘关系比较近,处于一个亚群;而 BFLN3-2010、BFAH2-2011、BFSD1-2011与CH-1a遗传距离较近。
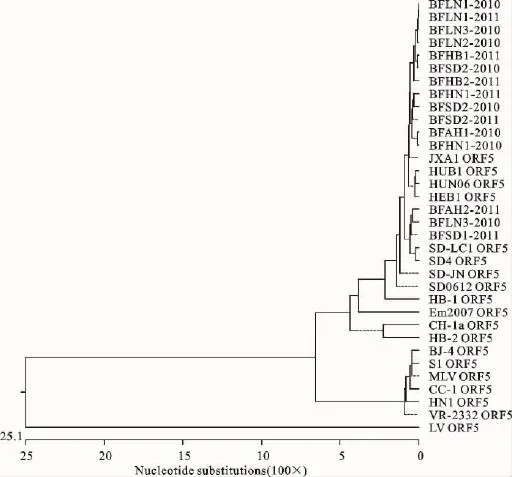
图2 ORF5基因序列遗传进化树Fig.2 Phylogenetic tree of ORF5gene sequence
3 讨论
本研究采用Marc-145细胞进行分离培养。PRRSV通过标准的内噬途径进入宿主细胞,并引起被感染细胞的凋亡[12]。PRRSV不具有血凝活性,不能够凝集哺乳动物或禽类的红细胞。RTPCR鉴定为PRRSV阳性样品,经过滤除菌后,接种到Marc-145细胞上进行细胞传代,第1代细胞毒CPE不明显,第2代细胞毒逐步出现细胞CPE,当传代到第3代时CPE趋于稳定。细胞病变主要表现为:一般在接种48h后可产生明显CPE,细胞发生皱缩、聚堆;72h后出现灶状脱落、折光性增强;96h后大量脱落死亡,形成大片空洞。PRRSV对存在环境的要求较为苛刻,细胞感染性受温度、湿度和pH影响,同时对有机溶剂敏感。所以在分离PRRSV时要尽量选取病毒含量较高的脏器(肺脏、淋巴结),同时要保证新鲜程度,并且要在低温环境下操作,以避免病毒失活。
ORF5基因是病毒的主要结构,其基因编码病毒的囊膜蛋白GP5,也是PRRSV的主要结构蛋白之一,GP5蛋白在病毒感染动物机体方面显示出重要的作用[13]。GP5有特定的亲水区和糖基化位点,该蛋白内部有一段疏水区,可能起到锚定膜的作用[14]。目前研究表明与抗体依赖性增强作用(ADE)相关的蛋白主要为N蛋白和GP5蛋白,而GP3蛋白和 M 蛋白诱导的抗体不具有ADE[15]。ORF5属于PRRSV基因组中高变区,GP5是PRRSV主要的宿主保护性抗原。根据血清学可将PRRSV分为美洲型和欧洲型,两型毒株间核苷酸和氨基酸序列同源性差别较大,同型毒株之间ORF5的核苷酸和氨基酸序列同源性也存在差别[16]。15株PRRSV毒株间ORF5基因所推导氨基酸序列的同源性95.5%~99.5%,辽宁4株分离株之间的同源性96.5%~99.5%,河南3株分离株之间的同源性96.5%~98.5%,安徽2株分离株之间的同源性为96.0%,河北2株分离株之间的同源性为98.0%,山东4株分离株之间的同源性为96.0%~97.5%。与VR2332(美洲型代表毒株)、MLV(疫苗毒株)、CH-1a(中国代表毒株)、JXA1(高致病性毒株)、HB-1和HB-2的ORF5基因推导的氨基酸序列同源性分别为86.1%~88.6%、85.6%~87.6%、90.5%~92.0%、97.5%~98.5%、92.0%~95.5%和88.6%~90.0%,与国内其他毒株 HEB1、CC-1、HuN06、SD-JN、SD-4的 ORF5基因推导的氨基酸序列同源性分别为97.5%~98.5%、85.1%~87.1%、97.0%~98.5%、97.5%~98.5%、96.5%~99.0%。本次研究所获得15株PRRSV均属于美洲型毒株。
GP5蛋白含有2~4个糖基化位点,具有一个由31个氨基酸组成的信号肽。以往研究发现,美洲株N端的信号序列由前25氨基酸组成,这个区域可能存在3个潜在的N-糖基化位点,分别存在于30 aa~32aa,44aa~46aa,51aa~53aa之间的氨基酸残基处,是欧洲株和美洲株高度变异的区域。GP5氨基酸序列中9aa~29aa这个区域变异最大[17],在这个区域内15个分离株的变异程度与JXA1株保持高度的相似。10个分离株氨基酸序列中的第23位为S,而JXA1株为F,另外有5个分离株氨基酸序列中的第29位为A,与JXA1株的V不同。说明获得的15个分离株与JXA1株亲缘关系较近。
GP5氨基酸序列的第13位和第151位被认为是与毒力相关的位点,15个分离株的GP5第13位的R13位均未发生变异,第151位有9个分离株发生R151→K151的突变,突变结果与参比序列HN1一致。同时,所有毒株均发生A137→S137的突变。
B细胞表位中,两个非中和表位发生V29→A29突变和Q196→L196突变,而主要中和表位,15个分离株均未发生突变,与JXA1一致。这些氨基酸的变异可能对GP5蛋白的结构、亲疏水性以及抗原性等造成影响,对机体产生中和抗体过程产生变化,可能降低抗原抗体中和作用,促使抗原逃避机体的免疫应答反应[18],进而可能会增强病毒的致病性。
[1] 杨 帆.PRRS病毒传播途径的识别[J].猪业科学,2010(6):24-26.
[2] 汤德元,曾智勇,李春燕,等.猪场暴发猪繁殖与呼吸综合征的临床诊断及实验室检测[J].中国兽药杂志,2008,42(7):8-12.
[3] Nielsen H S,Liu G,Nielsen J,et al.Generation of an infectious clones of VR-2332,a highly virulent North Americantype isolate of porcine reproductive and respiratory syndrome virus[J].J Virol,2003,3:3702-3711.
[4] Jusa E R,Inaba Y,Kouno M,et al.Hemagglutination with porcine reproductive and respiratory syndrome virus[J].J Vet Med Sci,1996,58:521-527.
[5] Mengeling W L,Lager K M,Vorwald A C.Clinical effects of porcine reproductive and respiratory syndrome virus on pigs during the early postnatal interval[J].Am J Vet Res,1998,59(1):52-55.
[6] Wensvoort G,Terpstra C,Pol M,et al.Mystery swine disease in the Netherlands:the isolation of Lelystad virus[J].Vet Q,1991,13 (3):121-130.
[7] Ostlite K R,Hutchison W D,Hellmich R L.Bt corn and Euro-pean corn borer,long term sussess throth resistance management[D].North Central Region Extension Publication 602U-niversity of Minnesota,St.Paul.1997.
[8] 孙泉云,周锦萍,刘佩红,等.上海地区野鸟和家禽中PRRSV抗体的血清学调查[J].中国兽医学报,2007(3):305-306.
[9] 杨汉春.猪高热综合征的发生与流行概况[J].猪业科学,2007:78-80.
[10] Ostrowski M,Galeota J A,Jara M,et al.Identification of neutralizing and nonneutraliziing epitopes in the porcine reproductive and respiratory syndrome virus GP5ectodomain[J].Virology,2002,76(9):4241-4250.
[11] Plagemann P G W.The primary GP5neutralization epitope of North American isolates of porcine reproductive and respiratory syndrome virus[J].Vet Immonol Immunopathol,2004,102(3):263-275.
[12] Sur J H,Doster A R,Osorio F A.Apoptosis induced in vivo during acute infection by porcine reproductive and respiratory syndrome virus[J].Vet Pathol,1998,35(6):506-514.
[13] 王 猛,刘永生,张 杰.猪繁殖与呼吸障碍综合征病毒结构蛋白的研究进展与应用[J].中国农学通报,2010,26(23):1-6.
[14] Mardassi H,Massie B,Dea S.Intracellular synthesis,processing,and transport of proteins encoded by ORF 5to 7of porcine reproductive and respiratory syndrome virus[J].Virology,1996,221:98-112.
[15] Indik S,Valicek L,Klein D,et al.Variations in the major envelope glycoprotein GP5of Czech strains of porcine reproductive and respiratory syndrome virus[J].Gen Virol,2000,81(10):2497-2502.
[16] 刘 霞,汤德元,曾智勇,等.猪繁殖与呼吸综合征病毒ORF5基因的变异及其基因工程疫苗研究进展[J].畜牧与兽医,2009,41(5):95-99.
[17] 张建武,庄金山,袁世山,等.中国部分地区高致病性猪繁殖与呼吸综合征病毒的分子流行病学研究[J].中国农业科学,2008,41 (6):1822-1831.
[18] Stadejek T,Stankevicius A,Storgaard T,et al.Identification of radically different variants of porcine reproductive and respiratory syndrome virus in Eastern Europe:towards a common ancestor for European and American viruses[J].Gen Virol,2002,83(8):186l-1873.
