鸭坦布苏病毒包膜蛋白的原核表达和间接ELISA 抗体检测方法的建立
2012-08-14郝明飞胡北侠崔言顺张秀美
郝明飞,张 琳,胡北侠,崔言顺,张秀美*
(1.山东农业大学,山东泰安271018;2.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南250100)
自2010年4月以来,我国东南部分省份(包括山东、江苏、浙江、广西等)很多鸭场暴发了一种以产蛋严重下降为主要特征的传染病,给中国的养鸭业带来了极大的经济损失,后来证实该病是由黄病毒科黄病毒属蚊媒病毒类恩塔亚病毒群中的鸭坦布苏病毒(Duck tembusu virus,DTMUV)所引起[1-3]。
鸭坦布苏病毒的病毒粒子直径40nm~50nm,有脂质囊膜。病毒基因组为单股正链RNA,大小为10.9kb。5′端和3′端各有一非编码区,其余基因为一个开放阅读框,从5′-3′依次编码C蛋白(核衣壳蛋白)、prM/M 蛋白(囊膜蛋白)、E 蛋白(包膜蛋白)、非结构蛋白 NS1-NS2-NS3-NS4-NS5[4]。其中E基因全长1 503bp,氮端含有的内部信号肽,为prM/M基因的一部分[5]。E蛋白是黄病毒主要的结构蛋白,在病毒吸附、与宿主细胞膜融合以及病毒组装过程中具有重要的作用。同时E蛋白也是黄病毒主要的病毒抗原,含有多种抗原表位,可通过诱发中和抗体产生保护性免疫应答[6-8]。
本研究对鸭坦布苏病毒E基因进行了克隆表达、免疫原性的检测,并初步建立了快速检测DTMUV抗体的间接ELISA方法,为该病的快速检测和流行病学调查提供了技术手段。
1 材料与方法
1.1 材料
1.1.1 毒株、菌种及质粒 鸭坦布苏病毒毒株由山东省畜禽疫病防治与繁育重点实验室分离、鉴定、保存;E.coli DH5α、BL21(DE3)为北京全式金生物技术有限公司产品;pMD18-T vector为宝生物工程(大连)有限公司产品;原核表达载体pET-21a(+)为山东省动物疫病防治与繁育重点实验室保存。
1.1.2 主要酶和试剂 RT-PCR一步法试剂盒、质粒小量快速提取试剂盒、DNA纯化试剂盒、His·Bind Purification Kit、AMV反转录酶、dNTP、RNA酶抑制剂、DNA Marker、X-gal、IPTG、EcoRⅠ酶、XhoⅠ酶、T4DNA连接酶,以及r Taq DNA聚合酶均为宝生物工程(大连)有限公司产品;ECL显色试剂盒为Novagen公司产品;鸭坦布苏病毒阳性血清由山东省动物疫病防治与繁育重点实验室制备和保存;HRP标记的山羊抗鸭IGg为KPL公司产品;TMB显色液为武汉博士德公司产品;ELISA酶标板为北京朋远有限公司产品;其他试剂均为国产分析纯。
1.1.3 SPF鸭 SPF鸭种蛋购自中国农业科学院哈尔滨兽医研究所,由山东省家禽所孵化场孵化。
1.2 方法
1.2.1 引物设计与合成 设计E基因表达引物E exp-1:CCGGAATTCTTCAGCTGGCTGGGCATG CAGAA(包含EcoRⅠ酶切位点),E exp-2:CCGCTCGAGGGCATTGACATTTACTGCCAGG(包含XhoⅠ酶切位点)由上海生工生物工程技术服务有限公司合成。
1.2.2 病毒RNA的提取 按常规方法从鸭胚尿囊液中提取病毒RNA。
1.2.3 基因的克隆及表达载体的构建 以RNA为模板,按常规方法进行反转录,之后进行PCR扩增。PCR反应体系为50μL,包括10×Ex Taq buffer 5μL,dNTP(2.5mmol/L)4μL,上游引物和下游引物(100pmol/μL)各1μL,Ex Taq酶1μL,病毒cDNA一链1μL,ddH2O补足50μL。扩增程序如下:97℃5min;94℃50s,53℃50s,72℃90s,30个循环;72℃延伸10min,16℃终止反应。
PCR产物经10g/L琼脂糖电泳鉴定,对扩增条带进行切胶回收,用EcoRⅠ、XhoⅠ双酶切PCR产物,获得E片段与经EcoRⅠ、XhoⅠ双酶切的pET-21a(+)载体,用T4DNA连接酶16℃连接过夜,连接产物转化大肠埃希菌BL21(DE3),涂布含有100 mg/L氨苄青霉素的LB琼脂平板,37℃培养过夜后,挑取单菌落,经PCR鉴定和酶切鉴定正确后,获得含目的片段的阳性重组质粒命名为PET21a-E。阳性质粒送宝生物工程(大连)有限公司进行测序鉴定。
1.2.4 重组蛋白的诱导表达 对筛选出阳性重组质粒的单菌落,接种于氨苄青霉素LB液体培养基中,37℃振荡培养至OD600为0.6~0.8时,加入终浓度为0.8mmol/L的IPTG,于37℃进行诱导表达。将诱导表达的菌体收集后超声波破碎,12 000r/min离心20min,收集上清液和沉淀,进行SDS-PAGE电泳。
1.2.5 表达产物的纯化和Western blot分析 按照His·Bind Purification Kit说明书进行表达产物的纯化。将需要纯化的溶液加入到已平衡好的Ni+柱中,收集洗脱液,即为含有目的蛋白的纯化液。按文献[9]介绍的Western blot方法分析表达产物。
1.2.6 间接ELISA检测方法的建立
1.2.6.1 ELISA操作步骤 将纯化后的E蛋白用包被液稀释后,包被到酶标板上,100μL/孔,37℃作用2h后置于4℃过夜(10h~12h);用PBST洗涤3次,每孔200μL;加入20mL/L BSA封闭液,200 μL每孔,37℃封闭2h;洗涤3次,加入一定稀释倍数的阳性血清和阴性血清,100μL/孔,37℃作用2h;洗涤3次,加入1∶2 000稀释的酶标抗体,100 μL/孔,37℃作用2h;洗涤同以前,加入TMB底物液,每孔100μL,避光显色5min~20min后,加入2 mol/L H2SO4(100μL/孔)终止反应,立即于 450 nm波长的酶标仪中测OD450nm值,求出P/N值。
P/N=(被检血清OD450nm值-空白对照OD450nm值)/(阴性血清OD450nm值-空白对照OD450nm值)
1.2.6.2 抗原包被浓度及抗体稀释度的确定 以纯化的重组E蛋白为包被抗原,将重组蛋白测定浓度后用包被液按1∶20倍比稀释到1∶160,每孔100μL包被96孔板,37℃作用2h后置于4℃过夜;常规方法洗涤、封闭后,将阴性和阳性血清分别按1∶80倍比稀释到1∶640,倍比稀释,每孔100 μL,组成方阵,HRP-山羊抗鸭IgG按1∶2 000稀释,37℃反应2h,后面步骤按常规方法进行测定,分别确定最佳抗原包被浓度及血清的最佳稀释倍数[10]。
1.2.6.3 间接ELISA方法的优化 参照文献[11]的方法分别对酶标二抗作用浓度、血清作用时间、酶标二抗作用时间及底物最佳作用时间等条件进行优化。
1.2.6.4 判定标准的确定 按照已经确立的ELISA方法对收集的30份阴性血清样品进行测定,每份样品重复3孔,计算样本OD450nm值的平均值(¯X)及标准差(SD),根据统计学原则:阴阳性临界值=¯X+2SD,计算出临界值,从而确定判定标准,大于此值判为阳性,小于此值判为阴性[12-13]。
1.2.6.5 特异性试验 在相同条件下,用建立的间接ELISA方法分别检测鸭坦布苏病毒(DTMUV)、鸭病毒性肝炎病毒(DHV)、鸭源新城疫病毒(NDV)、禽流感病毒(AIV)、番鸭呼肠病毒(ARV)、产蛋下降综合征病毒(EDSV)阳性血清,每份样品重复3孔,以验证本试验建立的间接ELISA方法是否对其他病毒的阳性血清有交叉反应性,对该方法的特异性进行分析。
1.2.6.6 重复性试验 用同时包被和不同时包被的酶标板对不同抗体水平的6份血清样品(包括3份阳性血清,3份阴性血清)分别进行4次批内和批间重复性检测,按照参考文献[14]进行,计算批内和批间的变异系数,分析结果有无明显差异。
1.2.6.7 初步应用于临床样品的检测 应用已建好的ELISA方法对采自山东各地区的120份鸭血清进行检测并分析检测结果,分析鸭坦布苏病毒的感染情况。
2 结果
2.1 PET21a-E重组质粒的构建
RT-PCR扩增出E全长基因,用EcoRⅠ和XhoⅠ双酶切,与同样经EcoRⅠ和XhoⅠ双酶切的PET-21a经凝胶回收纯化后进行连接,将连接产物转化大肠埃希菌BL21(DE3),提取质粒经EcoRⅠ和XhoⅠ双酶切得到5 400bp和1 500bp的片段,电泳结果与预期结果一致(图1)。将阳性重组质粒送宝生物工程(大连)有限公司测序,结果表明E基因片段已成功连接到pET-21a载体中。
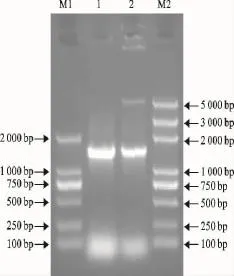
图1 pET21a-E酶切鉴定图Fig.1 pET21a-E enzyme digestion
2.2 表达产物的SDS-PAGE电泳分析
将转化pET21a-E的BL21菌经IPTG诱导表达,表达产物经SDS-PAGE检测,发现在55ku位置处有明显表达带,目的蛋白主要出现在细菌超声裂解后离心沉淀物中(图2)。
2.3 E蛋白的纯化及Western blot结果
表达的E蛋白经镍柱亲和纯化后SDS-PAGE电泳检测,获得均一的重组蛋白,纯化的E蛋白经Western blot分析(图3),结果显示在55ku附近有一条清晰的蛋白印迹,说明表达的重组蛋白具有良好的免疫原性。
2.4 间接ELISA方法的建立
2.4.1 抗原与血清最佳稀释度的确定 用蛋白测定仪测得纯化后的E蛋白浓度为0.28mg/mL。方阵显示(表1),当抗原的稀释浓度为1∶40,即包被抗原的浓度为7μg/mL时,血清的稀释度为1∶320,阳性血清的OD450nm值可达0.532 6,而阴性血清的OD450nm值为0.186 4,阴性与阳性血清的OD450nm值相差最大(P/N=2.857 3)。因此,7μg/mL为抗原的最佳包被浓度,1∶320为最佳血清稀释度。
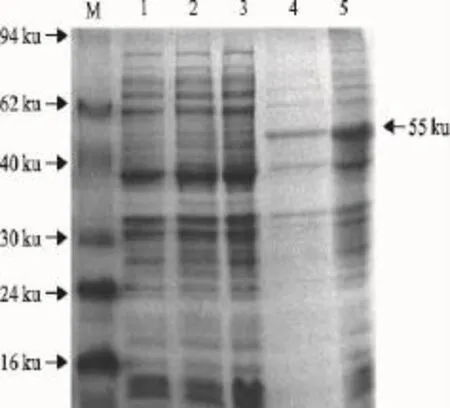
图2 E蛋白表达产物存在形式的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the existence of the fusion protein
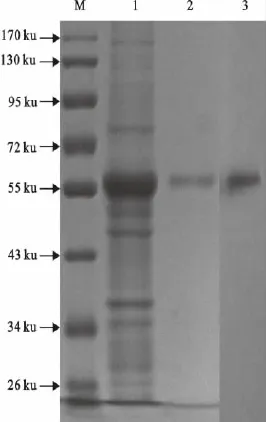
图3 重组蛋白纯化产物的SDS-PAGE及其免疫印迹分析Fig.3 SDS-PAGE and Western blot analysis of purified recombinant protein
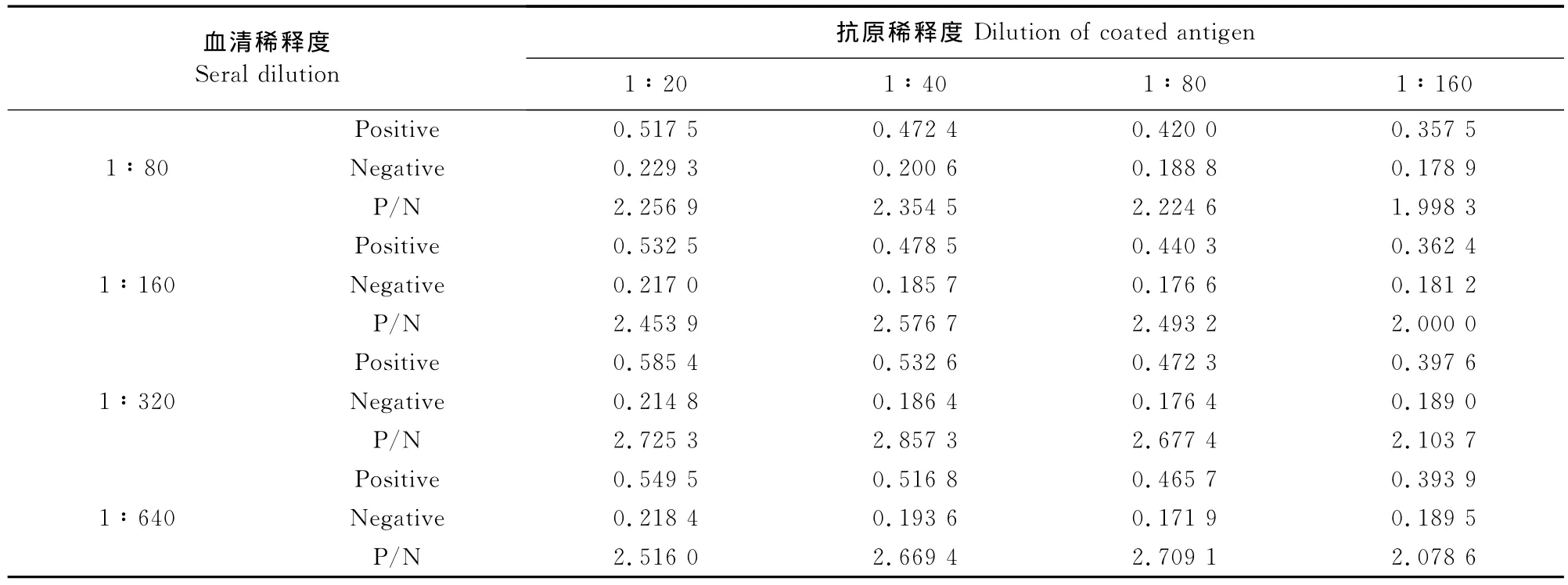
表1 E抗原和血清最佳稀释度的方阵试验结果Table 1 The result of optimal dilutions of Eantigen and serum by checkerboard titration(E)
2.4.2 最佳酶标抗体工作浓度的优化 用0.05 mol/L碳酸盐缓冲液(pH9.6)将抗原作稀释至7 μg/mL后包被酶标板,37℃作用2h后4℃过夜。血清作1∶320稀释,将酶标抗体做500、1 000、2 000、4 000倍稀释,100μL/孔,按照2.5.1ELISA方法进行操作,记录结果(表2)。试验确定最佳酶标抗体工作浓度为1∶1 000倍稀释。
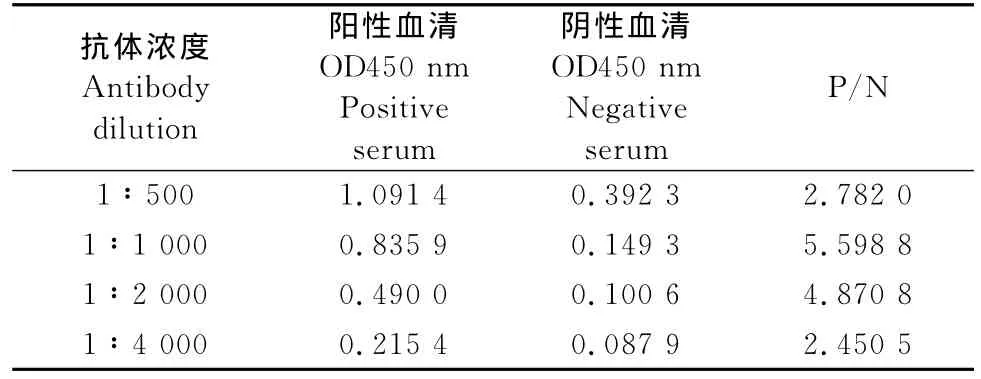
表2 最佳酶标抗体工作浓度的选择Table 2 Optimization of enzyme-labled antibody dilutions
2.4.3 最佳被检血清和酶标抗体作用时间的优化试验确定最佳被检血清作用时间为37℃孵育2h(表3),最佳酶标抗体作用时间的为37℃孵育1h(表4)。
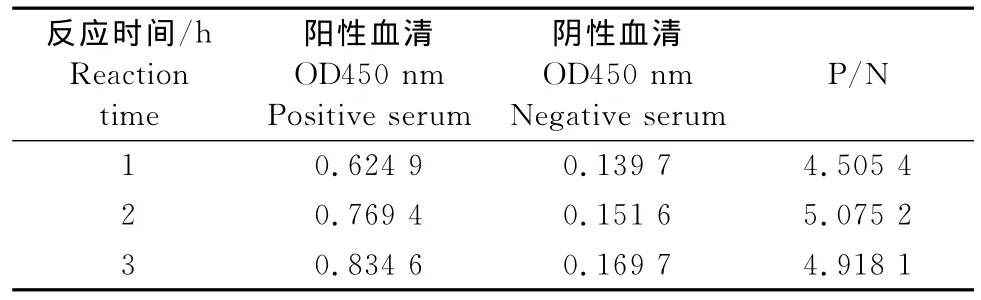
表3 最佳被检血清作用时间的选择Table 3 Optimization of serum incubation time
2.4.4 最佳显色时间的优化 本试验最终确定最佳显色条件为室温(20℃),显色10min(表5)。
2.4.5 判定标准的确立 对实验室保存的30份鸭血清(已知DTMUV阴性血清),按上述已优化完成的间接ELISA方法进行检测。求平均值(¯X)为0.206 8,标准差(SD)为0.058 8,根据公式:阴阳性临界值=¯X+2SD,试验临界值为0.324 4。即待测样品的OD450nm值≥0.324 4时为阳性,OD450 nm值<0.324 4则为阴性(图4)。
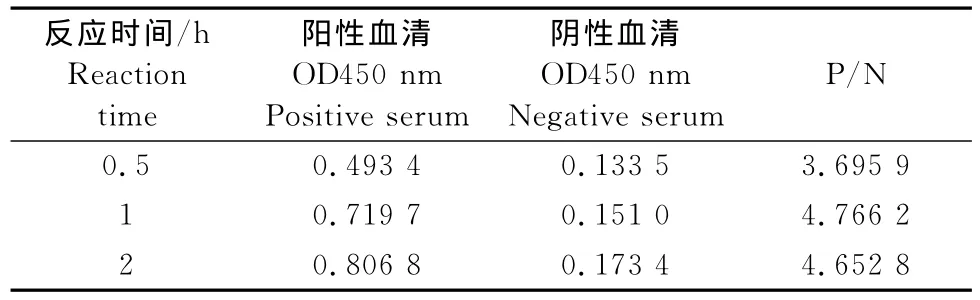
表4 最佳酶标抗体作用时间的选择Table 4 Optimization of reation time of labled antibody
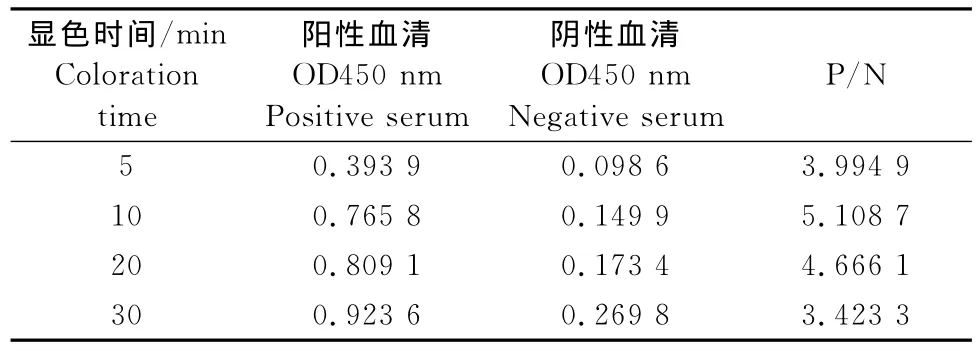
表5 最佳显色时间的确定Table 5 Determination of substrate reaction time
2.4.6 特异性试验结果 用建立的间接ELISA方法对禽流感病毒、番鸭呼肠病毒、鸭源新城疫病毒、鸭病毒性肝炎病毒、产蛋下降综合征病毒和鸭坦布苏病毒的阳性血清进行测定,其OD450nm值分别为0.179 1、0.212 8、0.112 8、0.133 7、0.205 6、0.136 9和0.816 7,其他病毒的阳性血清OD450 nm值均小于阴阳性临界值0.324 4,表明建立的间接ELISA方法具有较好的特异性[15]。
2.4.7 批内重复性试验结果 取6份不同的血清样品进行4次批内重复试验(表6),检测结果变异系数不超过9%,说明建立的间接ELISA检测方法具有良好的重复性。
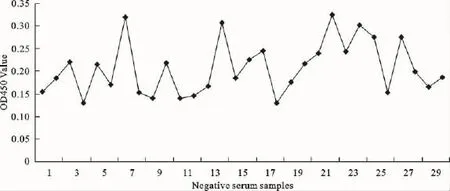
图4 30份鸭阴性血清间接ELISA检测结果Fig.4 The detection results of 30negative serum samples by indirect ELISA
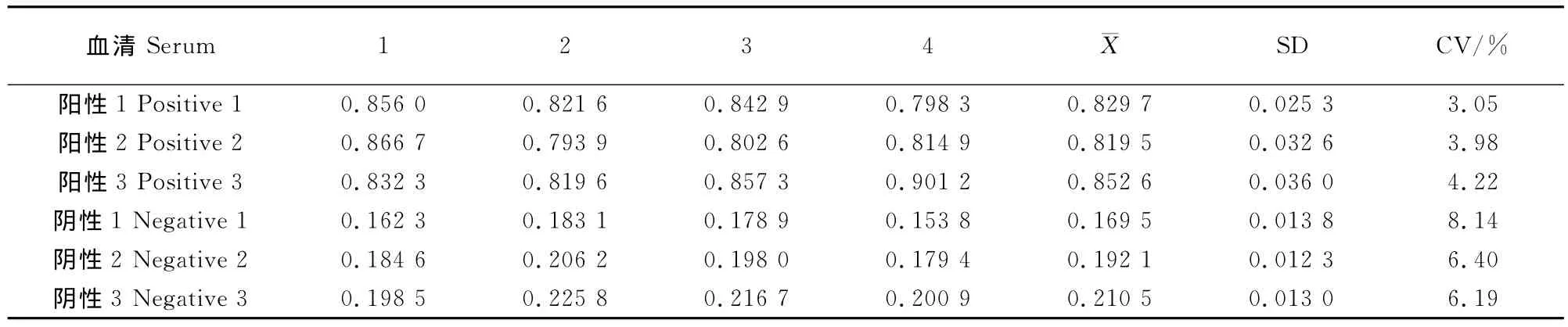
表6 批内重复试验Table 6 The repeat test of ELISA within a batch
2.4.8 批间重复性试验结果 批间重复性试验是将不同批次抗原按相同浓度包被酶标板,分别用4个不同批次冻存包被的酶标板来作重复检测,其4次检测结果基本一致,变异系数控制在10%以下,表明同一样品在不同批次抗原试验中变异程度很小,具有良好的重复性。
2.4.9 样品检测结果 按建立的ELISA方法,检测采自山东各地区的鸭血清120份,其中阳性22份,阴性98份。
3 讨 论
鸭坦布苏病毒自2010年发病以来给中国养鸭业造成了巨大的经济损失,由于是新发黄病毒病,基因信息较少,各蛋白基因分割位点还不是很明确,加之活力较低,滴度下降快,给病毒检测和疫苗研制带来了极大的难度。
E蛋白是坦布苏病毒体外中和作用的主要靶点和病毒特异性抗体的作用位点,具有中和活性,能够刺激机体产生抗体引发特异性免疫。黄病毒E蛋白可在宿主细胞表面变构形成二聚体或三聚体侵入宿主细胞并与毒力密切相关[16]。本研究在多次尝试不同表达载体之后,采用pET系统成功地构建了E蛋白的原核表达载体,并高效表达了鸭坦布苏病毒E蛋白,重组蛋白大部分以包涵体形式存在,上清中的量很少。Western blot分析结果表明,表达的E蛋白能与抗鸭坦布苏病毒的多抗结合,表明其具有较好的反应原性。
间接ELISA是血清学检测的常用方法,其优点是特异性强,灵敏度高及检测速度快。在建立间接ELISA方法过程中,抗原包被浓度和最佳血清稀释度的确定是关键[10],本研究通过方阵法确定了抗原的最佳包被浓度为7μg/mL,最佳血清稀释度为1∶320。在一定条件下(pH、离子强度)下,为了将固化在酶标板上的蛋白质将被折叠包裹在蛋白质内部的疏水区暴露出来,从而保持其作为检测抗原有良好的特异性、敏感性和重复性,本研究采用了0.05 mol/L(pH9.0)的碳酸盐缓冲液作为包被液。间接ELISA结果的判定方法有多种,如P/N法,终点法和单稀释法等。本研究采用P/N法,如果被检血清的值在0.324 4以上判为阳性,在其以下则判为阴性。在显色时间的优化中,最终选择室温下10 min,虽然OD值较1.0距离稍大,但其P/N最大,而显色20min虽然其P/N较大且OD值较接近于1.0,但其阳性、阴性OD值均过高,且经过试验比较变异系数较大,因此不予选择。该方法中所用的检测试剂(包被液、封闭液等)尚未标准化,所以本研究对所建立的间接ELISA方法未做其敏感性试验,今后将更进一步优化试验条件,以便能够更快的检测该病毒的血清抗体。
本研究探讨了利用重组蛋白作为包被抗原,并初步建立了快速检测鸭坦布苏病毒抗体的间接ELISA方法,实现了应用间接ELISA检测血清鸭坦布苏病毒抗体的可行性,为鸭坦布苏病毒血清学监测提供了技术手段。
[1] Su J,Li S,Hu X,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu related Flavivirus[J].PLoS One,2011,6(3):e18106.
[2] 曹贞贞,张 存,黄 瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[3] 苏敬良.鸭的新型黄病毒BYD引起的产蛋下降综合征[J].兽医导刊,2011(4):27-28.
[4] Leyssen P,De Clercq E,Neyts J.Perspectives for the treatment of infections with Flavivuridea[J].Clin Microbiol Rev,2000,13(1):67-82.
[5] Regina M K,Judith H A,Stephan W A,et al.Mimicking live flavivirus immunization with a noninfectious RNA vaccine[J].Proc Natl Acad Sci USA,2004,101(7):1951-1956.
[6] Mukhopadhyay S,Kuhn R J,Rossmann M G.A structural perspective of the flavivirus life cycle[J].Nat Rev Microbiol,2005,3(1):13-22.
[7] Hurrelbrink R J,McMinn P C.Molecular determinants of virulence:the structural and functional basis for flavivirus attenuation[J].Adv Virus Res,2003,60(1):1-42.
[8] Solomon T.Flavivirus encephalitis[J].N Engl J Med,2004,351(4):370-378.
[9] Sambrook J,Fritsch E F,Maniatis T.分子克隆实验指导[M].2版.金东雁,黎孟枫,译.北京:科学出版社,1996:880-898.
[10] 姬希文,闫丽萍,颜丕熙,等.鸭坦布苏病毒抗体间接ELISA检测方法的建立[J].中国预防兽医学报,2011,33(8):630-634.
[11] 林彦星,孙彦伟,刘镇明,等.应用原核表达的猪圆环病毒Ⅱ型Cap蛋白建立一种间接ELISA诊断方法[J].中国预防兽医学报,2007,29(3):217-221.
[12] 吴 鹏,曹瑞兵,周 斌,等.乙脑病毒非结构蛋白NS1的原核表达及重组蛋白间接ELISA方法的初步建立[J].畜牧与兽医,2010,42(3):5-8.
[13] Alcon S,Talarmin A,Debruyne M,et al.Enzyme linked immunosorbent assay specific to dengue virus type I nonstructural protein NS1reveals circulation of the antigen in the blood during the acute phase of disease in patients experiencing primary or secondary infections [J].Clin Microbiol,2002,(40):3.
[14] 彭秀玲,袁汉英.基因工程实验技术[M].2版.湖南长沙:湖南科学技术出版社,1998:76-381.
[15] 宫晓炜,邱昌庆,蔺国珍,等.牛布氏杆菌间接ELISA检测方法的建立 [J].中国兽医科学,2010,40(6):598-602.
[16] Modis Y,Ogata S,Clements D,et al.Structure of the dengue virus envelope protein after membrane fusion[J].Nature,2004,427(6972):313-319.
