奶牛支原体病的诊断
2012-08-14何生虎杨萌萌蒋魏娟安泓霏付少刚
郭 磊,何生虎*,邵 倩,杨萌萌,蒋魏娟,安泓霏,付少刚
(1.宁夏大学农学院,宁夏银川750021;2.银川市畜牧兽医工作站,宁夏银川750001)
牛支原体(Mycoplasma bovis)是一种能够导致牛产生各种各样疾病和高感染率的的重要病原体。它可以导致牛发生肺炎、关节炎、久治不愈乳腺炎、结膜角膜炎、怀孕母牛流产、生殖器感染等疾病[1]。发生牛支原体肺炎影响集约化牛场的生产,且常常由于高病死率、治疗昂贵以及病牛生长缓慢而给奶牛养殖企业带来巨大的经济损失;美国每年由于牛支原体所致的牛乳房炎和呼吸系统疾病造成高达1.4亿美元的损失,单一牛场最高感染率达70%[2-3]。在我国,1983年黎济申首次报道了从乳房炎牛乳中分离得到牛支原体[4],此后仅少数临床报道证实了牛支原体导致奶牛乳房炎;2008年湖北多地报道了牛支原体可导致肉牛传染性支原体肺炎[5],2010年宁夏报道了肉牛传染性支原体肺炎[6]。在奶牛方面,国内很少见有牛支原体感染的报道。2011年2月开始,宁夏吴忠某奶牛场中国荷斯坦奶牛出现发烧、咳嗽、鼻孔流有铁锈色鼻液、腹泻、关节肿大、蹄部炎症、严重乳房炎、头胎牛发生流产、死胎,新生犊牛在饲喂乳房炎奶牛的乳汁后,逐渐出现关节和蹄部肿大(图1),行走困难,甚至无法站立等症状;经实验室诊断,确诊为牛支原体和牛无乳支原体混合感染,感染率约为35%,现报告如下。

图1 患牛支原体的奶牛关节病理变化Fig.1 The pathological lesions in joints of cows infected with Mycoplasma bovis
1 材料与方法
1.1 材料
1.1.1 病料采集 无菌采集病、死奶牛血液、乳汁、鼻及气管液、肺脏、肝脏、脾脏等。
1.1.2 主要试剂及仪器 新生牛血清购自广东蕊特生物科技有限公司,酵母粉、琼脂、水解乳清蛋白粉等均为美国BD公司产品,醋酸铊为西安市金尊精细化工有限公司产品,青霉素为河北远征药业有限公司产品。BIOK-260牛支原体ELISA抗体检测试剂盒为比利时BIOK公司产品。Taq DNA聚合酶、pMD18-T为宝生物工程(大连)有限公司产品,Primer由上海生工生物工程技术服务有限公司合成。药敏片为北京天坛药物生物技术开发公司生产产品,抗生素类产品标准:YZB/国1748-2006;喹诺酮类产品标准:YZB/国1725-2006。
Biorad-680全自动酶标仪,My Cycler PCR仪,均为美国Biorad公司产品。
1.2 方法
1.2.1 流行病学调查 主要以养牛头数、发病情况、发病率、病死率、临床症状及病理变化观察等内容为主。
1.2.2 病原体分离培养 将无菌采集发病奶牛的气管液、乳汁和关节液样品接种改进的Hayflick支原体液体培养基[7],置37℃恒温培养箱内静置培养4d~6d,待培养基颜色变黄后将培养物连续传代。将稳定传代的培养物接种于支原体固体培养基上,置37℃、体积分数为5%的二氧化碳培养箱中培养2d~6d,待菌落长出后,观察菌落形态。
1.2.3 血清学检测 按照BIOK-260牛支原体ELISA抗体检测试剂盒说明书对10头发病奶牛采集血清进行稀释、血清转换、反复冲洗等步骤,制备出试验所需的微量板,配合美国Biorad 680全自动酶标仪在450nm波长下读取每孔的吸光度值,比照BIOK-260牛支原体ELISA抗体检测试剂盒说明书,计算出校验值(Val),根据0(Val<11.40)、+(11.40<Val<44.64)、+ + (44.64<Val<77.89)、+++(77.89<Val<111.14)、++++(111.14<Val<144.39)、+ + + + + (Val>144.39)判定样品阴性或阳性的强弱。
1.2.4 牛支原体PCR检测
1.2.4.1 支原体核酸的提取 据文献提取方法,从固体培养基上将一小块带有支原体的菌落挑取加入到150mL灭菌水的离心管中,煮沸10min,之后冰浴1min,12 000r/min离心45s,取上清液作DNA模板。
1.2.4.2 引物的设计与合成 根据相关文献报道支原体16SrRNA两端的保守序列、序列特性,设计支原体通用引物,通过PCR方法扩增培养产物中的16SrRNA[8-9]。
上游引物:5′-AAAATGAGAGTTTGATCCTGGCTCA-3′; 下 游 引 物:5′-CCTTGTTACGACTTCACCCCAATC-3′,引物由上海生工生物工程技术服务有限公司合成,预计扩增目的片段的长度为1.5kb左右。
1.2.5 支原体16SrRNA基因的扩增 扩增体系:根据相关文献采用25μL反应体系,其中包含10×PCR buffer 2.5μL,Mg2+1.5μL(25mmol/L),dNTP 0.6μL(10mmol/L),TaqDNA 聚合酶0.3 μL(5U/μL),DNA模板2μL,重蒸水15.2μL,上游和下游引物各1μL(25μmol/L)。
PCR扩增参数:94℃5min;94℃1min,50℃1min,72℃90s,30个循环;72℃ 10min。预期PCR产物大小为1.5kb。扩增产物用10g/L琼脂糖凝胶电泳进行检测,将目的条带用DNA回收试剂盒回收。
1.2.6 支原体16SrRNA基因的测序 将PCR产物克隆到质粒pMD18-T中,委托宝生物工程(大连)有限公司进行基因序列测定。最后将以上测得的序列与GenBank中的标准序列进行比较,挑出经BLAST软件比对同源性最高的序列,确定其类型。
1.2.7 药敏试验 利用药敏纸片法对所分离的病原体进行药敏感试验,所用药敏试纸的种类为β-内酰胺类:氨苄青霉素、头孢西丁、苯唑西林;氨基糖苷类:阿米卡星;大环内酯类:红霉素、克林霉素;四环素类:多西环素、四环素;喹诺酮类:氧氟沙星、诺氟沙星、环丙沙星;以及氯霉素。支原体药敏试验的培养条件同支原体分离培养,根据抑菌圈直径大小判断药物敏感性,判断标准参照产品说明。
2 结果
2.1 流行病学调查结果
自2011年2月开始,该奶牛场部分泌乳牛突然出现精神沉郁,食欲不振(后废绝),体温39.5℃~40.5℃,场内技术人员采用青霉素钾、头孢西丁、四环素类抗生素和中药柴胡等进行治疗,基本无效,1周后该牛被淘汰。自2月以来,个别牛只开始表现鼻镜干燥,陆续出现体温升高到39.5℃~41℃,采食量下降,呼吸急促,剧烈干咳,特别在采食后和清晨尤为明显,瘤胃蠕动音基本消失,胸部听诊有哨样啰音,有的牛只出现铁锈色鼻液,黏性脓性鼻液,眼部有分泌物,继续使用止咳类和β-内酰胺类、氨基糖苷类抗生素药物治疗,效果不佳。到5月奶牛发病头数逐渐增多,泌乳牛群中个别圈舍奶牛陆续出现上述呼吸道症状,有的甚至出现急性病症,突然疯跑,栽倒死亡,乳房炎牛只数量急剧增加,抗生素治疗效果不佳,治愈率低,且反复发生率高,头胎牛发生流产、死胎;新生犊牛在饲喂乳房炎奶牛的乳汁后,逐渐出现关节和蹄部肿大,行走困难,甚至无法站立,精神状态极差,并伴有腹泻等症状。自2月至6月以来总计因上述病症死亡牛只10头,犊牛发病16头,牛群整体状况不良。针对上述情况,对发生肺炎症状、发烧、关节炎、以及严重乳房炎,习惯性流产的成年奶牛和犊牛均建立“症候圈”单独隔离,治疗观察。
剖检病死奶牛可见皮下呈胶冻样,病理变化主要在胸腔内,肺肿大,大部分肉样变,纵切可见大理石样花纹(图2),肺部和胸膜有粘连,胸腔内有少量积液。剖开心包,可见心内膜腐烂,呈肉芽样(图3),有积液,液体为黄色澄清样。腹腔内有大量橙黄色腹水,肝脏肿大呈灰白色,胆囊肿大,脾脏边缘钝圆。子宫内积有大量灰白色恶臭浓汁,子叶脱落。下颌淋巴结、肺门淋巴结、髂下淋巴结肿大。切开关节腔有黄色半透明脓血样的浑浊液体。

图2 患牛支原体肺炎的奶牛肺部病理变化Fig.2 The gross pathological lesions in lungs of dairy cow infected with Mycoplasma bovis

图3 患牛支原体病奶牛的心脏病变Fig.3 The pathological lesions in heart of dairy cow infected with Mycoplasma bovis
2.2 病原体的分离培养
接种于改良的Hayflick支原体液体培养基病料,在传至第3代后培养基的颜色由浑浊橙黄色逐渐变为澄清、透明的淡黄色;接种普通营养琼脂血液培养基上的病料经37℃、体积分数为5%的二氧化碳环境下恒温培养24h后观察其表面无菌落生长;接种于支原体固体培养基经约72h培养后,表面出现突出于支原体培养基表面,呈油煎蛋样菌落(图4),挑取较小的单个菌落接种于支原体液体培养基,经37℃、体积分数为5%的二氧化碳环境下恒温培养72h,培养基颜色变黄且澄清、透明。挑取“煎蛋样”菌落抹片,姬姆萨染色后观察到支原体形态呈现多形性,有的形似戒指,多数呈“豆芽样”(图5)。

图4 病料在支原体琼脂培养基上的生长菌落Fig.4 The colonies of pathogens on Mycoplasmaagar medium

图5 姬姆萨染色后的支原体形态Fig.5 The form of Mycoplasmaafter Giemsa staining
2.3 血清学检测结果
经酶标仪读数根据说明书公式Val=delta OD sample×100/delta OD positive,所得数值均大于11.40,依照说明书,大于11.40者即为阳性(+),对检测的10份牛血清进行判定,其中“+”3头、“++”6头、“+++”1头。
2.4 16SrRNA基因的PCR扩增结果
16SrRNA基因的PCR扩增产物经1g/L的琼脂糖凝胶电泳,获得1.5kb的目的条带,空白对照未见任何条带出现,与预期的扩增长度相符(图6)。
2.5 支原体16SrRNA基因的序列
对16SrRNA扩增产物进行测序分析,上网利用BLAST软件进行序列同源性比较,结果表明所分离支原体为牛支原体(Mycoplasmabovis),与GenBank中牛支原体16SrRNA序列CP002513.1(MycoplasmabovisHubei-1,complete genome)的同源性为99%,与无乳支原体CU179680.1(MycoplasmaagalactiaePG2chromosome,complete sequence)同源性为99%。
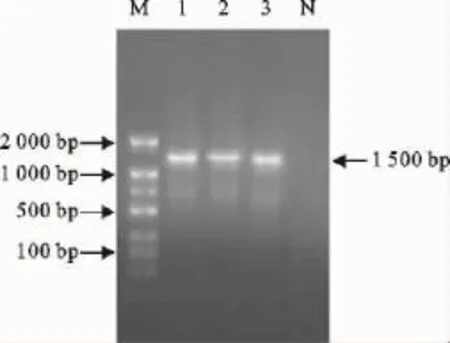
图6 牛支原体PCR扩增结果Fig.6 PCR amplification results of 16SrRNA of Mycoplasma bovis
2.6 药敏试验结果
整体说来,该支原体耐药性较为严重,和多数报道四环素类药物疗效较好不一致。因此不同牛场分离的牛支原体药敏特性有较大差异,本试验中阿米卡星和环丙沙星应为首选药物(表1)。

表1 牛支原体药敏试验Table 1 Drug sensitivity test of Mycoplasma bovis
3 讨论
经过近3个月对该病原体的系统研究,确定该地区本次流行的病原为牛支原体和无乳支原体。该病在宁夏地区奶牛为首次流行。据文献记载,1961年牛支原体被鉴定为致牛乳房炎的病原[2];1976年被描述为导致牛呼吸道疾病的病原[10]。此后,不同国家都有该病的流行[11]。目前,牛支原体已被认为是肉牛、奶牛和犊牛发生呼吸道疾病与多发性关节炎的重要病因。牛支原体既可以导致牛的急性传染性呼吸系统疾病,还可导致持续感染和慢性支气管肺炎以肺干酪样或凝固性病理特征的坏死病变[5]。牛支原体经常和细菌、病毒协同,环境因素如天气、通风不良、过度拥挤、运输等将加剧病情,加之不良的用药习惯使一些耐药性细菌的存在,因此临床上对多种抗生素的治疗效果很差,甚至无效[11]。本次牛支原体病流行的背景支持以上观点。本次流行中,发病奶牛均为犊牛与青年牛,经调查此次牛支原体肺炎是由于隔壁某牛场盲目引进奶牛,未经严格检验检疫,加之长途运输时气候变化明显等多种促发因素,使病情复杂化。据文献记载,患病牛只可通过鼻腔分泌物排出牛支原体,健康牛只可通过近距离接触病牛而获得病原,感染发病。一旦感染,可持续携带病原而成为其他健康牛只的传染源。牛支原体在自然环境中存活能力差,但在无光照情况下可存活数天,例如在4℃的海绵中或牛奶中可存活2个月之久,20℃存活1周到2周,37℃存活1周,粪中可存活37d[5]。传统的消毒剂均可达到消灭该病原的目的。牛支原体虽然可引起肉牛、奶牛与羊的感染,但目前尚无可感染人的报道。犊牛发生支原体关节炎的主要原因是犊牛饮用了乳房炎患病奶牛的乳汁。发生牛支原体感染奶牛的牛乳中同样存在着牛支原体病原,本次试验中从病牛乳汁中分离出病原体;该场将患病奶牛的乳汁饲喂犊牛,造成新生犊牛的整体暴发牛支原体性关节炎,就充分证明这一点。
本试验从病牛肺部组织、乳汁中分离获得的病原,采用支原体通用引物进行PCR 16SrRNA扩增与鉴定,Takahiro Matsuki等学者认为当病原的16S rRNA基因可变区序列同源性大于97%时,便可认为这些病原是属同一种[12-13],细菌分类学家普遍认为,如果两个16SrRNA序列同源性低于97%,可以认为是属内不同类型的种。由此为依据,本试验利用分子生物学方法对诱发奶牛纤维素性肺炎、久治不愈的乳房炎、关节炎的支原体16SrRNA扩增,测序,与GenBank中的标准序列进行比较,挑出经Blast软件比对同源性高达99%的序列,得到了牛支原体和无乳支原体,确定了病原类型。
药敏试验效果不佳,经分析主要与该牛场用药习惯和牛群对抗生素的耐药性有关。结合相关文献,不同牛场分离的牛支原体药敏特性有较大差异,所以药敏试验的结果不一致。针对本次牛支原体的流行建议选用阿米卡星、环丙沙星,在防治中起到了一定的效果。另据报道早期使用泰乐菌素类(泰乐菌素、替米考星、瑞可新)及泰妙菌素类抗菌药(支原净、沃尼妙林)也有一定效果[11]。
[1] Pfutzner H,Sachse K.Mycoplasma bovis as an agent of mastitis,pneumonia,arthritis and genital disorders.Scientific and Technical Review[J].Offices International Des Epizooties,1996,15(4):1477-1494.
[2] Hale H H,Helmboldt C F,Plastridge W N,et al.Bovine mastitis caused by Mycoplasmaspecies[J].Cornell Vet,1962,52:582-591.
[3] Nicholas R A J,Baker S,Ayling R D,et al.Mycoplasma infections in growing cattle[J].Cattle Practice,2000,8:115-118.
[4] 黎济申.牛的霉形体性乳房炎[J].上海畜牧兽医通讯,1983(4):46.
[5] 石 磊,龚 瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的初步诊断[J].华中农业大学学报,2008,27(4):572.
[6] 李新民,何生虎,曹 志,等.牛传染性支原体肺炎病的初步诊断[J].黑龙江畜牧兽医.2011(5):107。
[7] Hayflick L.Tissue cultures and mycoplasmas[J].Tex Rep Bio Med,1965,23:(Suppl.1),285.
[8] Hoelzle L E,Adeh D,Hoelzle K,et al.Development of a diagnostic PCR assay based on novel DNA sequences for the detection of Mycopasma suis (Eperythrozoon suis)in porcine blood[J].Vet Microbiol,2003,93(3):l85-196.
[9] Dutro S M,Hebb J K,Garin C A,et al.Development and performance of a microwell plate based polymerase chain reactionassay for Mycoplasma genitalium[J].Sex Transm Dis,2003,30(10):756-763.
[10] Gourlay R N,Thomas L H,Howard C J.Pneumonia and arthritis in gnotobiotic calves following inoculation with Mycoplasma agalactiae subsp.bovis[J].Vet Rec,1976,98:506-507.
[11] Caswell J L,Archambault M.Mycoplasma bovis pneumonia in cattle[J].Anim Health Res Rev,2007,8(2):161-186.
[12] Braddock J A,Tasker S,Malik R.The use of rea1time PCR in the diagnosis and monitoring of Mycoplasrna haemofelis copy number in anaturally infected eat[J].J Feline Med Surg,2004,6(3):161-165.
[13] Biddle M K,Fox L K,Evans M A,et al.Pulsed-field gel electrophoresis patterns of Mycoplasmaisolates from various body sites in dairy cattle with Mycoplasma mastitis[J].J Am Vet Med Assoc,2005,227:445-459.
