蟾蜍灵对人食管鳞癌EC9706细胞增殖及凋亡的影响
2012-08-09闫永波隋承光孟凡东刘云鹏
田 昕,罗 颖,闫永波,隋承光,孟凡东,刘云鹏
1中国医科大学附属第一医院肿瘤研究所分子肿瘤实验室,沈阳 110001
2中国医科大学附属第一医院肿瘤内科,沈阳 110001
3沈阳药科大学药学院药剂系,沈阳 110016
4本溪市中心医院药学部,辽宁 本溪 117000
食管癌是侵袭能力最强的恶性肿瘤之一,居全世界最常见消化道肿瘤的第3位。食管癌通过手术及现行的放化疗很难达到根治,因此必须寻找包括新型抗癌药物在内的其他治疗手段[1-2]。蟾蜍灵又称蟾毒灵,是中药蟾酥的主要配基之一,为多羟基甾体类化合物,具有抗炎、止痛及强心等多种药理作用。研究表明,蟾蜍灵还可抑制白血病、胃癌、肝癌、结肠癌、宫颈癌及肺癌等多种肿瘤细胞凋亡[3-8],但目前尚无有关食管癌方面的报导。线粒体不仅能诱导细胞凋亡,还是细胞凋亡的执行者,很多核编码蛋白是通过线粒体转位发挥凋亡调节作用的。端粒酶是一种核糖核蛋白复合物,在90%以上的肿瘤细胞中高表达,主要存在于细胞核,其主要功能是延长端粒保护染色体稳定。越来越多的研究显示,人端粒酶的主要催化亚基—人端粒酶逆转录酶 (human telomerase reverse transcriptase,hTERT)还具有核外定位 (主要是线粒体定位)等非端粒依赖的功能,但目前对hTERT核-线粒体转位在肿瘤细胞凋亡中的作用与机制尚不清楚。本研究通过观察蟾蜍灵对人食管鳞癌EC9706细胞增殖和凋亡的影响,探讨其对hTERT核-线粒体定位的影响。
材料和方法
主要试剂和仪器 蟾蜍灵、碘化丙啶 (propidium Iodide,PI)、RNase A及 Hoechst 33342购自美国Sigma公司,Cell Counting Kit(CCK-8)、Annexin VFITC/PI双染细胞凋亡检测试剂盒、线粒体/细胞核提取试剂盒及BCA蛋白定量试剂盒购自南京凯基生物科技发展有限公司,hTERT兔抗人抗体购自美国Rockland公司,增殖细胞核抗原 (proliferating cell nuclear antigen,PCNA)、细胞色素C氧化酶亚单位Ⅳ (cytochrome c oxidase subunitⅣ,COXⅣ)、兔抗人抗体及山羊抗兔二抗购自美国Santa cruz公司,ECL底物发光试剂盒购自美国Pierce公司,Mitotracker Red、Alexa Fluro 488荧光标记二抗购自美国Invitrogen公司。SUNRISE RC酶标仪购自瑞士TECAN公司,FACS Calibur流式细胞仪购自美国BD公司,荧光显微镜购自日本Olympus公司,蛋白电泳转印系统购自美国Bio-Rad公司,凝胶成像分析系统购自以色列DNR公司,FV1000S激光共聚焦显微镜购自日本Olympus公司。
细胞培养 人食管鳞癌EC9706细胞系购自南京凯基生物科技发展有限公司。细胞单层接种于含体积分数为10%胎牛血清的RPMI-1640(Gibco,USA)中,培养于37℃、5%CO2的培养箱中。
CCK-8法测定细胞增殖率 取对数生长期的EC9706细胞用胰酶消化成单细胞悬液,调整细胞密度为2×104/ml接种于96孔板中,细胞培养24 h贴壁后加入不同浓度蟾蜍灵 (1、10、20、50、100 nmol/L),设空白对照,每组6个复孔。分别孵育24、48、72 h后在各孔中加入10 μl CCK-8溶液,37℃孵育1 h后,酶标仪在450 nm波长处检测每孔的吸光度 (OD值),计算细胞生长的抑制率。细胞生长抑制率=(对照组OD均值-给药组OD均值)/对照组OD均值×100%,实验重复3次取其均值,计算半数抑制浓度 (IC50)。
细胞周期检测 收集并调整细胞浓度为1×106/ml,用体积分数为70%乙醇固定 (4℃过夜),染色前加RNase A(10 mg/ml)37℃ 放置 30 min,加入 PI(100μg/ml)避光染色15 min,流式细胞仪测定DNA含量,cell quest软件分析细胞周期。
Hoechst 33342染色荧光显微镜观察细胞核形态
以每孔5×105/ml细胞密度接种于24孔板中,培养24 h后加药干预,药物处理后吸尽培养液,PBS洗2次,用40 g/L多聚甲醛固定30 min,PBS洗两遍,加入Hoechst 33342染色液避光反应5 min,荧光显微镜下观察细胞核形态。
AnnexinV-FITC/PI双染法检测细胞凋亡 消化细胞制成单细胞悬液,调整细胞密度至1×106/ml,300 g 4℃离心10 min,弃上清液。将细胞重悬浮于500 μl结合缓冲液中,加入 5 μl AnnexinV-FITC 和5 μl PI,轻轻混匀,避光室温反应15 min流式细胞仪检测凋亡。
Western blot法检测hTERT蛋白的表达 将细胞刮下,PBS洗涤,800 g 5 min离心收集,每次需要约5×108细胞以上。加入1.5 ml预冷裂解液重悬,转至玻璃匀浆器内冰浴研磨30次。将细胞匀浆移至离心管,4℃ 800 g离心5 min。取沉淀加入0.5 ml Medium Buffer A重悬,将另一预冷离心管中加入1 ml Medium Buffer B,将悬液置于Medium Buffer B之上,4℃ 1000 g离心10min,用100 μl Nuclear Store Buffer重悬细胞核沉淀;在另一个预冷离心管中预先加入0.5 ml Medium Buffer C,取上清沿管壁缓慢覆盖于Medium Buffer C上层,4℃ 15000 g离心10 min。加0.2 ml Wash Buffer重悬沉淀,4℃ 15000 g离心10 min,用 100 μl Mitochondria Store Buffer重悬线粒体沉淀。分别测定细胞核/线粒体蛋白浓度,逐步进行上样、10%SDS-PAGE蛋白电泳、转印、封闭、抗体孵育、底物发光等步骤显示特异蛋白条带,分别以PCNA及COXⅣ作为细胞核与线粒体蛋白内参。
多重免疫荧光标记激光共聚焦显微镜观察hTERT亚细胞定位 将载玻片过酸高压灭菌后置于6孔板中,1×104/ml密度接种细胞孵育24 h后加入蟾毒灵,处理结束后PBS清洗3次,用40 g/L多聚甲醛-20℃固定15 min,1%BSA封闭30 min,PBS清洗3次后加入hTERT一抗过夜,先后加入Alexa Fluor 488荧光标记二抗 1 h、Mitotracker Red 30 min及 Hoechst 3334215 min,甘油封片,激光共聚焦显微镜下分别在发射波长487、599和520 nm观察蓝色、红色及绿色荧光并合成图像。
统计学处理 采用SPSS 13.0统计软件包,计量资料以均数±标准差表示,组间比较采用两独立样本t检验和单因素方差分析,P﹤0.05为差异具有统计学意义。
结 果
蟾蜍灵对人食管鳞癌EC9706细胞增殖的影响CCK-8检测结果显示,以1、10、20、50、100 nmol/L蟾蜍灵分别作用人食管鳞癌EC9706细胞24、48、72 h,蟾蜍灵以时间及剂量依赖方式抑制EC9706细胞增殖(P<0.01),24、48、72 h的 IC50分别为(98.26±6.38)、(40.32±3.62)、(19.45.45±1.41)nmol/L(图 1)。
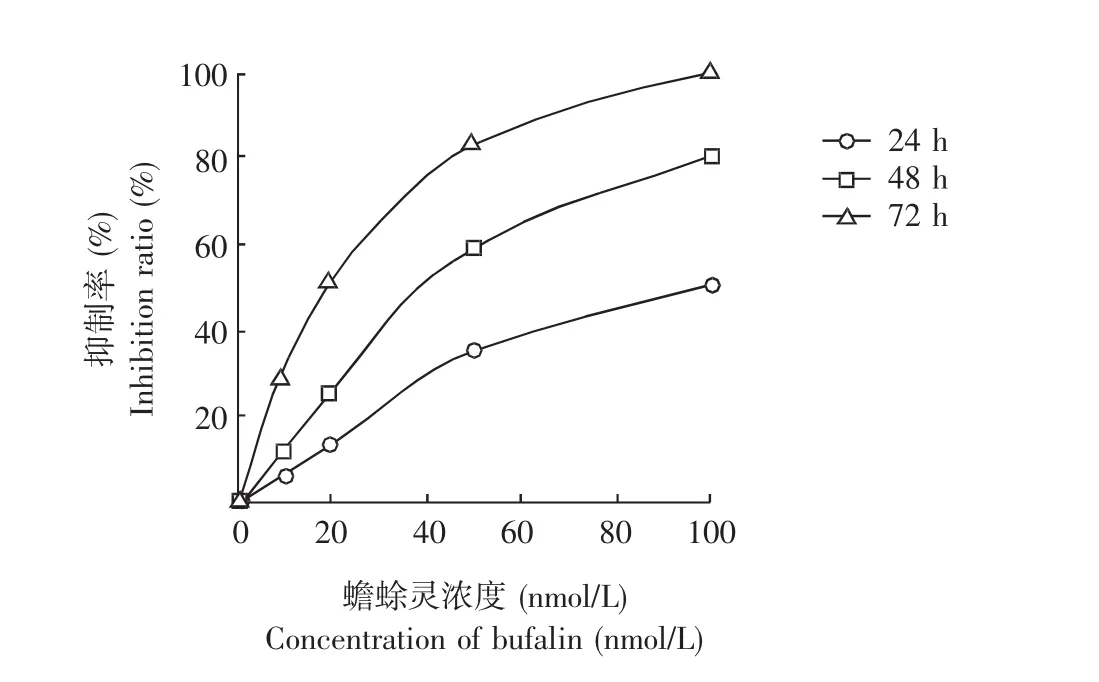
图1 蟾蜍灵以时间及浓度依赖方式抑制人食管鳞癌EC9706细胞增殖Fig 1 Bufalin suppressed the proliferation of human esophageal squamous carcinoma EC9706 cells in a time-and dose-dependent manner
蟾蜍灵抑制人食管鳞癌EC9706细胞增殖过程中对细胞周期的影响 以100 nmol/L蟾蜍灵作用于EC9706细胞6、12、24、48 h,与对照组相比,G1期细胞由 (66.91±5.26)%逐渐降至 (50.54±4.22)%、(30.51±2.86)%、(9.38±1.25)%、(0.03±0.01)%,而S期细胞由 (21.64±2.04)%分别增至(30.62±2.85)%、(45.21±3.82)%、(60.67±5.23)%、(67.05±5.86)%(P均<0.05);G2/M期细胞则由(11.45±1.20)%分别增至(18.84±1.63)%、(24.28±2.52)%、(29.05±3.02)%、(32.92±3.83)%(P均<0.05);亚二倍体期 (sub G1)细胞由0(0 h)增至 (9.23±1.51)%(24 h)及 (25.56±2.86)%(48 h)(图2)。
蟾蜍灵诱导人食管鳞癌EC9706细胞凋亡 Hoechst 33342染色荧光显微镜观察结果显示,100 nmol/L蟾蜍灵处理人食管鳞癌EC9706细胞6、12、24、48 h,细胞出现典型凋亡的三期形态学改变:Ⅰ期细胞核皱缩呈波纹状或呈折缝样,部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期细胞核裂解为碎块,产生凋亡小体;对照组细胞核呈蓝色,边缘光滑完整,均匀淡染 (图3)。Annexin V-FITC/PI双染流式细胞仪检测结果显示,凋亡率分别由对照组的 (1.21±0.58)% 增加至(6.21±1.36)%、 (11.64±2.15)%、 (20.78±3.22)%、(33.92±3.84)%(P<0.01)(图4)。
蟾蜍灵在诱导人食管鳞癌EC9706细胞凋亡过程中对 hTERT的影响 Western blot检测结果显示,hTERT蛋白不仅在EC9706细胞核内表达,还表达于线粒体中。100 nmol/L蟾蜍灵作用12、24、48 h,细胞核内hTERT蛋白表达逐渐下调,分别减少至对照组的 (70.55±6.26)%、(53.78±4.85)%、(42.66±4.03)%(P均<0.05),而线粒体hTERT蛋白的表达逐渐上调,与对照组相比分别增加 (8.03±0.52)%、(15.52±1.27)%、(27.16±2.01)%(P均<0.05)(图5)。多重免疫荧光标记结合激光共聚焦显微镜观察结果显示,除细胞核外,hTERT还定位于线粒体中,100 nmol/L蟾毒灵作用12、24、48 h,部分hTERT由细胞核转位至线粒体 (图6)。

图2 蟾蜍灵处理诱导EC9706细胞周期阻滞及凋亡Fig 2 Treatment with bufalin induced cell cycle arrest and apoptosis in EC9706 cells

图3 蟾蜍灵诱导EC9706细胞凋亡的胞核形态改变 (Hoechst,×400)Fig 3 Morphological changes of nucleus in apoptotic EC9706 cells induced by bufalin(Hoechst, ×400)
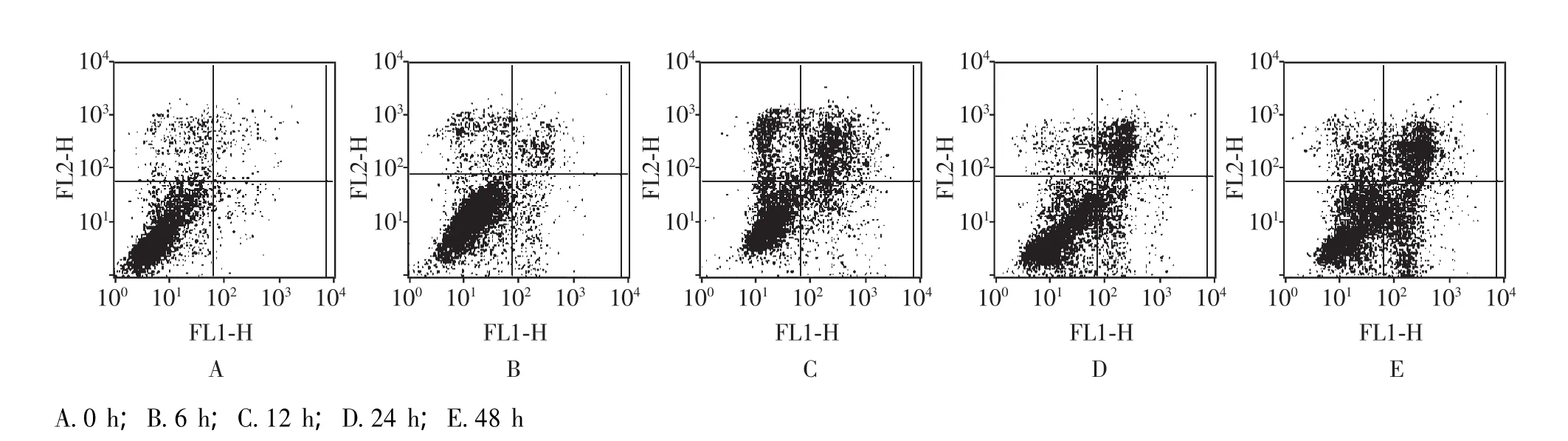
图4 蟾蜍灵诱导EC9706细胞凋亡Fig 4 Bufalin induced apoptosis in EC9706 cells

图5 Western blot检测EC9706细胞hTERT胞核及线粒体蛋白表达Fig 5 Protein expression of hTERT in the nucleus and mitochondria of EC9706 cells(Western blot analysis)

图6 蟾蜍灵诱导EC9706细胞hTERT核-线粒体转位 (×600)Fig 6 Bufalin induced hTERT nuclear-mitochondrial translocation in EC9706 cells(× 600)
讨 论
食管癌在我国主要以鳞状细胞癌 (esophageal squamous cell carcinoma,ESCC)为主,进展快、死亡率高,为第4大肿瘤相关死亡原因。ESCC根治切除不仅创伤大易复发,常用的化疗药物对ESCC术后复发的治疗效果并不理想。因此,寻找新型敏感药物对于ESCC的治疗来说势在必行。本研究结果证实,蟾蜍灵可在体外以时间和剂量依赖方式抑制人食管鳞癌细胞EC9706增殖,随作用时间的延长,蟾蜍灵显著阻碍细胞周期进程,逐渐将细胞阻滞于S及G2/M期而不能顺利通过检查点进入下一细胞周期,从而诱导凋亡。笔者以往研究显示,蟾蜍灵在诱导白血病HL-60细胞凋亡过程中,可降低Bcl/Bax比值,下调Survivin蛋白表达,促进线粒体促凋亡因子Smac/DIIABLO的释放,与其他学者报道的线粒体凋亡途径可能参与蟾蜍灵诱导的肿瘤细胞凋亡的结论一致[4-5,8],但目前对蟾蜍灵诱导的线粒体凋亡通路的调控机制仍需进一步研究。
线粒体不仅是维持细胞能量代谢和生命活动的控制中心,还是细胞凋亡的调控中心。多种抗癌药物通过线粒体内在途径诱导肿瘤细胞凋亡,线粒体已成为筛选新型抗肿瘤药物的重要靶标[9]。线粒体还是除细胞核外唯一具有基因组DNA的细胞器,共编码37个基因,但是在线粒体中发现的基因编码产物却超过1000个,其中98%以上的线粒体蛋白是由细胞核基因组编码并转运至线粒体中的[10]。hTERT是人端粒酶的主要调控亚单位,是决定端粒酶活性的关键因素。hTERT表达水平的高低与端粒酶的活性密切相关,并在正常和癌组织中存在差异性表达。hTERT是一种RNA依赖的DNA聚合酶,可以端粒酶自身的RNA组分 (hTR)为模板逆转录合成染色体末端结构—端粒DNA,稳定端粒长度以维持染色体的完整性。近年研究发现,hTERT蛋白分别具有核定位、核输出及线粒体定位序列,可在细胞核与线粒体之间动态穿梭。由于端粒结构只存在于细胞核染色体末端,端粒酶只有在细胞核中才能发挥其保护端粒的功能,因此,hTERT的线粒体定位提示端粒酶还具有其他非端粒依赖的功能[11-16]。目前,对hTERT线粒体定位的功能及核-线粒体转位的机制还存在争议,有研究认为,线粒体hTERT在细胞中行使与核hTERT不同的功能,是hTR非依赖的逆转录酶;hTERT线粒体转位对线粒体具有不利影响,使细胞更易受到氧化应激的损伤,为线粒体受损及凋亡的决定因素[12-14]。另一些研究却认为,氧化应激和药物可导致hTERT从细胞核转位到线粒体,降低细胞活性氧水平、改善线粒体功能,并降低应激条件下线粒体 DNA(mtDNA)的损伤[15-16]。本研究发现,hTERT在人食管鳞癌EC 9706细胞中不仅存在于细胞核,还定位于线粒体,并在蟾蜍灵诱导的凋亡过程中部分由细胞核向线粒体转位。
[1]Enzinger PC,Mayer RJ.Esophageal cancer[J].N Engl J Med,2003,349(23):2241-2252.
[2]Parkin DM,Bray F,Ferlay J,et a1.Global cancer statistics,2002 [J].CA Cancer J Clin,2005,55(2):74-108.
[3]田昕,王萍萍,刘云鹏,等.蟾蜍灵在诱导HL-60细胞凋亡过程中对Bcl-2和PKC的影响 [J].中国实验血液学杂志,2007,15(1):67-71.
[4]田昕,罗颖,刘云鹏,等.蟾蜍灵诱导HL-60细胞凋亡过程中对 Bcl-2、Survivin、Smac/DIABLO表达的影响[J].中华血液学杂志,2006,27(1):21-24.
[5]Li D,Qu X,Hou K,et al.PI3K/Akt is involved in bufalininduced apoptosis in gastric cancer cells [J].Anticancer Drugs,2009,20(1):59-64.
[6]Qi F,Inagaki Y,Gao B,et al.Bufalin and cinobufagin induce apoptosis of human hepatocellular carcinoma cells via Fas-and mitochondria-mediated pathways [J].Cancer Sci,2011,102(5):951-958.
[7]Xie CM,Chan WY,Yu S,et al.Bufalin induces autophagy-mediated cell death in human colon cancer cells through reactive oxygen species generation and JNK activation [J].Free Radic Biol Med,2011,51(7):1365-1375.
[8]朱志图,郁云龙,王锴,等.蟾蜍灵对人非小细胞肺癌A549细胞增殖与凋亡的影响 [J].中国肺癌杂志,2010,13(9):841-845.
[9]Gogvadze V,Orrenius S,Zhivotovsky B.Mitochondria as targets for chemotherapy [J].Apoptosis,2009,14(4):624-640.
[10]Santos JH,Hunakova L,Chen Y,et al.Cell sorting experiments link persistent mitochondrial DNA damage with loss of mitochondrial membrane potential and apoptotic cell death[J].J Biol Chem,2003,278(3):1728-1734.
[11]Sharma NK,Reyes A,Green P,et al.Human telomerase acts as a hTR- independent reverse transcriptase in mitochondria [J].Nucleic Acids Res,2012,40(2):712-725.
[12]Santos JH,Meyer JN,Skorvaga M,et al.Mitochondrial hTERT exacerbates free radical-mediated mtDNA damage[J].Aging Cell,2004,3(6):399-411.
[13]Santos JH,Meyer JN,van Houten B.Mitochondrial localization of telomerase as a determinant for hydrogen peroxideinduced mitochondrial DNA damage and apoptosis [J].Hum Mol Genet,2006,15(11):1757-1768.
[14]Sharma NK,Reyes A,Green P,et al.Human telomerase acts as a hTR-independent reverse transcriptase in mitochondria [J].Nucleic Acids Res,2012,40(2):712-725.
[15]Ahmed S,Passos JF,Birket MJ,et al.Telomerase does not counteract telomere shortening but protects mitochondrial function under oxidative stress [J].J Cell Sci,2008,121(7):1046-1053.
[16]Haendeler J,Dröse S,Büchner N,et al.Mitochondrial telomerase reverse transcriptase binds to and protects mitochondrial DNA and function from damage [J].Arterioscler Thromb Vasc Biol,2009,29(6):929-935.
