脂质体转染促甲状腺激素受体基因构建Graves病模型
2012-08-09邱李恒林岩松
龙 文,邱李恒,孟 超,林岩松
1中国医学科学院 北京协和医学院 北京协和医院核医学科,北京 100730
2北京大学人民医院核医学科,北京 100044
Graves病是一种主要累及甲状腺的自身免疫性疾病,目前在动物身上尚无自发发生的报道。自上世纪90年代中期起,研究者们便开始给动物注射促甲状腺激素受体 (thyroid-stimulating hormone receptor,TSHR)蛋白诱导Graves病,但均未取得满意结果。20世纪末,有研究者通过注射具有免疫活性的细胞制备小鼠模型,并成功诱导产生了TSHR抗体(thyroid stimulating antibody,TSAb)[1-2]。得益于基因工程的发展,研究人员通过注射含TSHR基因或其片段的裸质粒或腺病毒制备Graves病模型,取得了较好的效果[3-5]。Chen等[6]研究发现,TSHR 蛋白的A亚基 (A subunit of thyroid-stimulating hormone receptor,TSHRA)基因可能较TSHR全长基因能够产生更高水平的TSAb。此后,Kaneda等[7]通过电穿孔直接把TSHRA基因转染入小鼠肌肉细胞,不仅取得了较高的表达率,而且得到了持久的TSAb表达,进而距离成功的Graves病动物模型又近了一步。近年来,又出现了注射牛甲状腺球蛋白诱导Graves病的尝试[8],但需要很漫长的探索过程。由于用腺病毒或电穿孔方法对技术要求较高,耗资较大,而脂质体注射是目前常用的一种简便的转基因手段,尚未用于Graves病动物模型研究,本研究拟以脂质体注射的形式免疫雌性Balb/c小鼠诱导Graves病,并比较了不同质粒载体、目标基因和免疫程序对诱导率的影响。
材料和方法
材料 TSHR cDNA、Lipofectine TM2000(美国Invitrogen公司),EcoRⅠ 和NotⅠ限制性内切酶 (日本 TaKaRa公司),Escherichia coli DH5α、Escherichia coli BL21(DE3)、pUBC质粒、pCDNA3.1(+),pETis质粒[中国医学科学院医学实验动物研究所提供,由pET28a(+)质粒改造而来],DNA凝胶回收试剂盒、质粒DNA小量提取试剂盒、T4 DNA连接试剂盒、PCR用 Taq酶等材料 (美国 Axygen公司),游离三碘甲状腺原氨酸 (FT3)及游离甲状腺素(FT4)放射性免疫分析药盒 (北方生物所)。
质粒构建 以EcoRⅠ和NotⅠ限制性内切酶双酶切载有TSHR基因的质粒和pUBC/pCDNA3.1(+)质粒,连接构建pUBC-TSHR/pCDNA3.1(+)-TSHR载体。分别设计扩增TSHR和TSHRA编码区的引物序列。TSHR-wF:5'-GAATTCATGAGGCCGGGGGACTTGCT-3'(EcoRⅠ);TSHT-wR:5'-GCGGCCGCACTTTGGGGTTAGATGGGAGT-3'(NotⅠ);TSHRAR:5'-GCGGCCGCAAGCACAGCACAGCAGTGGCTTGGG-3'(NotⅠ)。PCR产物酶切后与载体连接,得到真核表达载体pUBC-TSHR/pCDNA3.1(+)-TSHR和pUBC-TSHRA/pCDNA3.1(+)-TSHRA,构建成功的载体经测序验证。
实验动物及分组 SPF级Balb/c雌性小鼠66只(6周龄),由中国医学科学院医学实验动物研究所提供,随机分入以下5组:(1)pUBC-TSHR组(n=10);(2)pUBC-TSHRA组(n=10);(3)pCDNA3.1(+)-TSHR组(n=15);(4)pCDNA3.1(+)-TSHRA组(n=15);(5)对照组 (n=16),其中pUBC组同期6只,pCDNA组同期10只。
动物免疫 取已构建好的pUBC-TSHR、pUBCTSHRA(pUBC组)分别用磷酸盐缓冲液 (PBS)稀释至1 mg/ml后用脂质体包封。在小鼠四肢肌肉或皮下进行多点注射免疫,剂量为50μg/只,分别在初次免疫后第3周、第5周用相同剂量的DNA加强免疫。pCDNA3.1(+)-TSHR、pCDNA3.1(+)-TSHRA处理组 (pCDNA组)与pUBC组类似,但采用不同的免疫程序,分别在初次免疫后1周、2.5周、5周加强免疫。每1~2周记录小鼠体重并经尾静脉采血。pCDNA组中两实验组内各挑选8只动物在初次免疫后10、14周再次加强免疫,并在末次免疫13 d后处死取血。上述动物实验均经中国医学科学院医学实验动物研究所动物伦理委员会批准。
血清TRAb、FT3及FT4测定 建立TSHR的原核表达载体 pETis-TSHR,用 Escherichia coli BL21(DE3)表达TSHR抗原,用镍柱亲和层析方法纯化TSHR抗原。间接ELISA法检测每次免疫后小鼠血清TRAb浓度,血样均从1∶20开始等比稀释。放射免疫法测定小鼠血清FT3、FT4。
统计学处理 采用R统计软件 (版本:2.10.1),动物体重及 FT3、FT4以均数 ±标准差表示;在TSHR组、TSHRA组及对照组间进行比较时,先用Shapiro法进行正态性检验,Bartlett法检验方差齐性,符合正态分布及方差齐性的数据,用ANOVA方差分析法检验3组间的均值差异;不符合者使用Kruskal-Willis法;3组间差异有统计学意义时,再用t检验或Wilcoxon检验进行两两比较。处理间接ELISA所得数据时,用四参数Logistic回归法拟合对照组OD值得到标准曲线,再根据标准曲线计算各样本的TRAb相对浓度,该处理过程使用ELISA软件进行[9]。P<0.05为差异有统计学意义。
结 果
体重变化 pUBC组经过4次免疫,观察期为42 d;pCDNA组经过6次免疫,观察期为109 d。pUBC组及pCDNA组均在第40~42天内完成前4次免疫的观察,其体重总体呈上升趋势,但后者的体重曲线出现了分离,尤其是在初次免疫2.5周后 (第3次免疫后),TSHRA亚组体重增长明显变缓,曲线呈平台趋势 (图1)。pUBC两亚组与对照组的体重变化只在初次免疫后3周内 (前2次免疫期间)差异有统计学意义 (P=0.013),TSHRA亚组的体重增长明显快于TSHR组和对照组 (P=0.008),pCDNA两亚组与对照组的体重变化则在初次免疫后的第1周内及2.5周后 (第1、3、4次免疫后)均有显著性差异 (P=0.015,P=0.001,P=0.005)(表1)。pCDNA组6次免疫后TSHRA、TSHR亚组体重增长明显小于对照组 (P=0.005)(图3)。
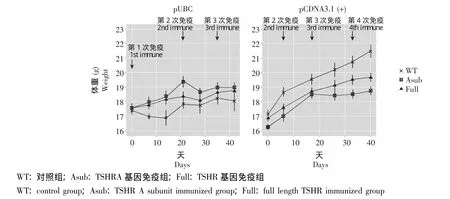
图1 pUBC组与pCDNA组在免疫过程中的体重变化Fig 1 Weight changes in pUBC and pCDNA groups during the immunization
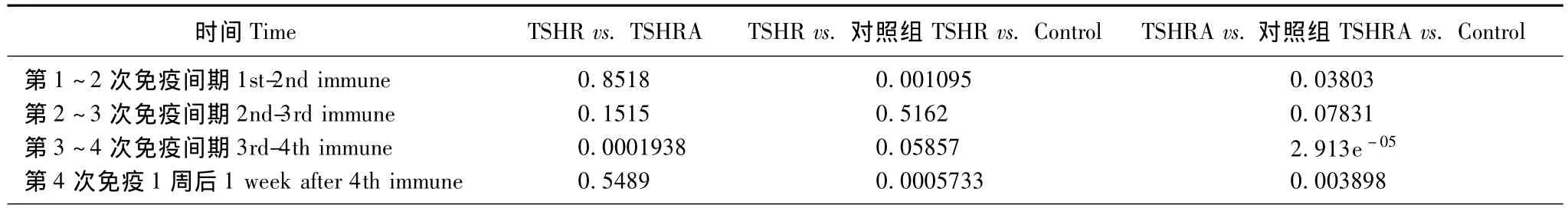
表1 pCDNA组两亚组及对照组体重变化两两比较P值Table 1 P-value of weight change between two subgroups of pCDNA group and control group
血清TRAb相对浓度 pUBC和pCDNA组OD值标准曲线的回归系数r2均大于0.99。pUBC组在免疫过程中血TRAb相对浓度在初期 (前35 d)升高不明显,观察结束后 (初次免疫后42 d)也仅升高到初始值的3~4倍,且TSHR和TSHRA亚组的血清TRAb相对浓度没有明显差异。pCDNA组血TRAb相对浓度则呈明显的上升趋势,在初次免疫后20 d内即已升高到初始值的2倍左右,而初次免疫后40 d则升高到了5~7倍。其中,两亚组血TRAb相对浓度则表现出明显的差异,在初次免疫26 d后 (第3次免疫后9 d),TSHRA亚组的TRAb水平增长幅度明显高于TSHR组 (图2)。pCDNA组在6次免疫后只有TSHRA亚组中的2例 (2/7)仍表现出明显的TRAb升高 (图3)。
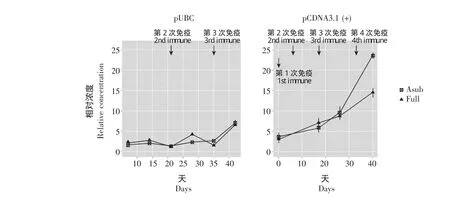
图2 pUBC和pCDNA组在免疫过程中血清TRAb相对浓度的变化Fig 2 Relative concentration of serum TRAb in pUBC and pCDNA groups
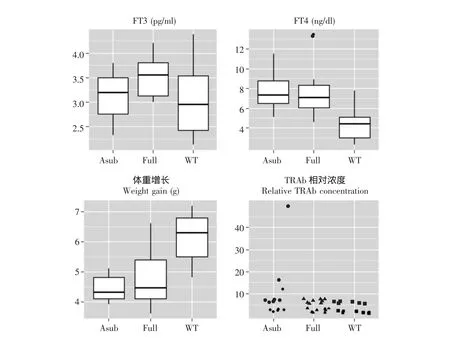
图3 pCDNA组6次免疫后FT3、FT4、体重增长和TRAb相对浓度Fig 3 FT3,FT4,weight gain,and relative TRAb concentration in pCDNA group after 6 immunization procedures,A,F,and WT in the x-axis represents TSHRA,TSHR,and control groups respectively
血清FT3、FT4 pCDNA组在6次免疫结束后,TSHRA及TSHR亚组的FT3水平与对照组差异无统计学意义 (P=0.276),但FT4明显高于对照组 (P=0.023)(图3)。在分析FT3与体重增长的关联时,两者的关联图在实验组与对照组间没有区域性分布的趋势。FT4与体重增长的关联图则在组间表现出了较明显的区域性分布,FT4与体重增长存在负相关关系,但与TRAb间没有表现出明显的关联 (图4)。
讨 论
pUBC和pCDNA3.1(+)都是常用的哺乳动物表达载体,但二者启动子不同,前者为hUbC启动子,后者为CMV启动子,本研究中分别采用这两种载体进行了构建Graves病模型的尝试。模型如果构建成功,动物应该具有较高的血清TRAb相对浓度,或者TRAb浓度呈持续升高趋势。血清甲状腺激素水平应该升高或呈升高趋势[3,10-11]。而作为甲状腺毒症的经典表现之一,在同样饲养环境下,动物的体重增长应比较缓慢或呈现负增长趋势。本研究结果显示,pUBC组两亚组体重变化趋势与对照组无明显差异,而pCDNA组两亚组体重增长明显慢于对照组,尤其是在3次免疫后 (2.5周后),甚至出现体重平台或下降。通过观察两组血TRAb变化规律,pUBC组升高程度有限,42 d后仅为初始值的4~5倍,而pCDNA组在初次免疫后20 d内即观察到血TRAb明显升高,40 d时达初始值的5~7倍,提示就体重和TRAb而言,pCDNA组具有更高的模型诱导率。
Chen等[6]研究发现,TSHRA基因具有更高的TSAb诱导率,本研究亦对TSHR全长和TSHRA基因的诱导效率进行了比较,结果发现,pCDNA的TSHRA亚组体重增长在第3、4次免疫期间明显慢于TSHR亚组,此后的体重变化曲线出现了分离;TRAb的变化亦呈同样趋势。pCDNA组6次免疫后,虽然TSHRA及TSHR亚组的FT4水平均明显高于对照组,但只有TSHRA亚组呈现高水平的TRAb;提示与TSHR全长基因相比,TSHRA基因能够更有效的诱导TRAb及甲状腺毒症的产生。
本研究通过首次免疫和3周后的2次加强免疫来实现pUBC组TRAb的高水平表达,但并没有得到预期结果,推测其原因可能是首次免疫和加强免疫的间隔过长。在pCDNA组采用不同的免疫程序,缩短免疫间隔,得到了预期的结果,提示缩短免疫间隔有助于提高模型诱导率。pCDNA3.1(+)本身的高效也可能是造成这种差别的原因之一。
TSH是反映甲状腺功能最灵敏的指标,但由于小鼠TSH试剂盒难以获得,本研究测定了小鼠的FT3和FT4,结果提示FT4与体重变化具有较明显的关联,而FT3的关联性较差。这一结果与Rao等[5]的研究结果相符。美国甲状腺学会有关甲状腺机能亢进的指南也指出FT4与TSH存在负对数关系,可通过联合检测提高甲亢诊断的准确性,而FT3的检测方法尚存在缺陷,难以作为一个灵敏的甲亢监测指标[12]。因此,笔者认为在Graves病动物模型建立及研究中,采用FT4来监测模型的甲状腺功能更为合适。
综上,本研究结果显示,pCDNA3.1(+)载体、TSHRA基因、缩短免疫间隔有助于提高模型诱导效率,FT4是监测模型甲状腺功能的合适指标。
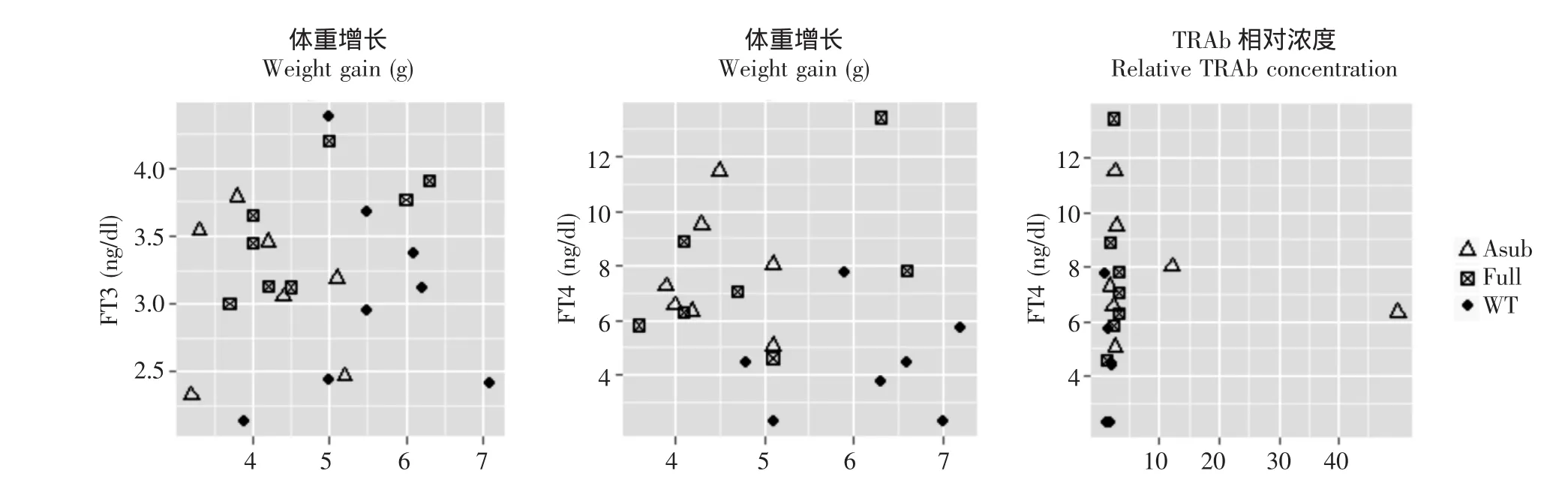
图4 FT3、FT4与体重增长及FT4与TRAb水平的关联Fig 4 Correlation among FT3,FT4 and weight gain,together with that between FT4 and TRAb
[1]Kaithamana S,Fan J,Osuga Y,et al.Induction of experimental autoimmune Graves'disease in BALB/c mice [J].J Immunol,1999,163(9):5157-5164.
[2]Kita M,Ahmad L,Marians RC,et al.Regulation and transfer of a murine model of thyrotropin receptor antibody mediated Graves'disease [J].Endocrinology,1999,140(3):1392-1398.
[3]Costagliola S,Many MC,Denef JF,et al.Genetic immunization of outbred mice with thyrotropin receptor cDNA provides a model of Graves'disease [J].J Clin Investigation,2000,105(6):803-811.
[4]Nagayama Y,Kita-Furuyama M,Ando T,et al.A novel murine model of Graves'hyperthyroidism with intramuscular injection of adenovirus expressing the thyrotropin receptor[J].J Immunol,2002,168(6):2789-2794.
[5]Rao PV.Contrasting activities of thyrotropin receptor antibodies in experimental models of Graves'disease induced by injection of transfected fibroblasts or deoxyribonucleic acid vaccination [J].Endocrinology,2003,144(1):260-266.
[6]Chen CR,Pichurin P,Chazenbalk GD,et al.Low-dose immunization with adenovirus expressing the thyroid-stimulating hormone receptor A-subunit deviates the antibody response toward that of autoantibodies in human Graves'disease [J].Endocrinology,2004,145(1):228-233.
[7]Kaneda T,Honda A,Hakozaki A,et al.An improved Graves'disease model established by using in vivo electroporation exhibited long-term immunity to hyperthyroidism in BALB/c mice [J].Endocrinology,2007,148(5):2335-2344.
[8]Endo T,Kobayashi T.Immunization with thyroglobulin induces Graves'-like disease in mice [J].J Endocrinol,2009,202(2):217-222.
[9]Plikaytis BD,Carlone GM.Program ELISA for Windows User's Manual[M].2nd,ed.Atlanta,GA,USA:Centers for Disease Control and Prevention,2005.
[10]Gilbert JA,Gianoukakis AG,Salehi S,et al.Monoclonal pathogenic antibodies to the thyroid-stimulating hormone receptor in Graves'disease with potent thyroid-stimulating activity but differential blocking activity activate multiple signaling pathways [J].J Immunol,2006,176(8):5084-5092.
[11]Ludgate M.Animal models of Graves'disease [J].Eur J Endocrinol,2000,142(1):1-8.
[12]Bahn RS,Burch HB,Cooper DS,et al.Hyperthyroidism and other causes of thyrotoxicosis:Management guidelines of the american thyroid association and american association of clinical endocrinologists[J].Thyroid,2011,21(6):593-646.
