术中超声在颈椎后路椎板成形术中的应用
2012-08-09韦祎,何达,田伟,刘波
韦 祎,何 达,田 伟,刘 波
北京积水潭医院脊柱科,北京 100035
脊髓型颈椎病是脊柱骨科的常见疾病,保守治疗效果不佳,通常需要外科手术治疗。在多种术式中,颈椎后路椎板成形术是治疗多节段脊髓型颈椎病、先天颈椎管狭窄和颈椎后纵韧带骨化症 (ossification of posterior longitudinal ligament,OPLL)等疾病的一种非常有效的手术方法[1]。对颈椎椎板成形术预后的评估常规包括术前神经症状的轻重、日本骨科协会 (Japanese Orthopaedic Association,JOA)评分、脊髓受压程度以及颈椎C2-7矢状位曲度等[2],但这些参数都不能直接显示脊髓减压情况,对预后评估存在局限性。近年来,随着技术的发展,术中超声检查开始应用于临床,作为无创、直观的术中成像手段,其操作简便,且能够动态显示椎板减压后脊髓漂浮情况,观察硬膜形态的改变,从而更好地评估手术预后[3],本研究探讨了术中超声在颈椎后路椎板成形术中的应用价值。
对象和方法
对象 2010年4月至2012年4月在北京积水潭医院脊柱骨科因脊髓型颈椎病行椎板成形术且行术中超声检查的患者30例,其中,男17例,女13例,平均年龄 (56±10)岁 (34~82岁);多节段颈髓型颈椎病25例,OPLL 5例。所有患者术后均无高热、红肿、渗出、感染发生,切口均为甲级愈合,均未发生珊瑚人工骨块排异反应,无术后症状恶化或突然加重,术后平均随访 (11±7)个月 (4~24个月)。
方法 所有患者术前均行颈椎正侧位X线及颈椎MRI检查,怀疑OPLL的患者术前进行颈椎CT检查,所有患者术中均行超声检查。
超声数据采集:采用美国通用电器公司的便携式超声检查仪 (LOGIQ E),选择“肌肉骨骼”参数选项,频率10.0 MHz,探测深度3.0 cm。在手术切口中注入生理盐水,将超声探头放入盐水中,观测并记录硬膜矢状位和冠状位搏动的图像。
MRI脊髓压缩率 (扁平率):术前行颈椎MRI检查,在T2相矢状位图像中评估脊髓受压节段,脊髓内高信号节段;在横断位图像中计算颈部脊髓的压缩率,计算方法是在脊髓压迫最重的横断面上,测量脊髓前后径和左右径的比值 (前后径/左右径×100%)[4]。
JOA评分和恢复率:术前及随访时记录颈椎JOA评分,采用JOA恢复率评估术后神经功能的恢复情况,具体为:恢复率 =(术后JOA-术前JOA)/(17-术前 JOA) ×100%[5]。
统计学处理 采用SPSS 16.0统计软件,组间比较采用t检验,相关性分析采用Pearson检验,P<0.05为差异有统计学意义。
结 果
术中超声检查结果 根据术中超声动态观察减压后硬膜搏动时与其腹侧结构的相互关系,可将30例患者分为3型:(1)Ⅰ型 (未接触):2例,来自硬膜腹侧的压迫完全解除,硬膜在搏动过程中与腹侧的间盘或骨性结构没有接触,腹侧的蛛网膜下腔间隙持续存在;(2)Ⅱ型 (接触可分离),16例,来自硬膜腹侧的压迫部分解除,硬膜搏动到最高点时与腹侧间盘或骨性结构分开,搏动到最低点时与之接触 (图1);(3)Ⅲ型 (接触),12例,来自硬膜腹侧的压迫没有解除,硬膜搏动到最高点时仍旧与腹侧的间盘或骨性结构接触,蛛网膜下腔腹侧间隙消失。
JOA恢复率 将Ⅰ型和Ⅱ型患者归入减压满意组(n=18),Ⅲ型患者归入减压不满意组,减压满意组患者术后JOA恢复率为 (73.3±21.0)%(31.3% ~100.0%),明显高于减压不满意组患者的 (43.2±33.1)%(0~83.3%)(t=3.05,P=0.005)。
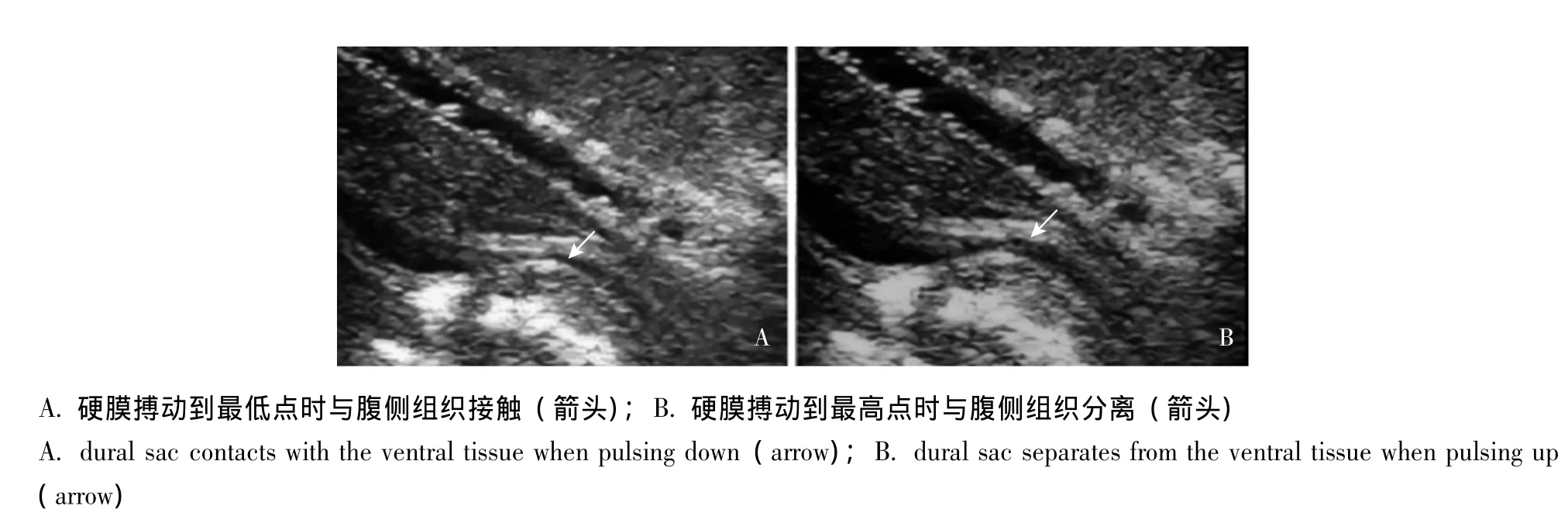
图1 同一患者硬膜搏动时与腹侧组织接触、分离的超声图像 (Ⅱ型)Fig 1 The spinal cord shows contact with and separation from the ventral tissue during cord pulsation(typeⅡ)
影响术后JOA恢复率的因素 所有患者的平均年龄为 (56±10)岁 (34~82岁),术前JOA评分平均值为12.1±3.0(4.5~16.0),术前MRI压缩率为 (21.1±6.0)%(10.3% ~33.9%),术后JOA评分平均值为15.1±1.8(10.5~17.0),术后JOA恢复率的平均值为 (61.3±30.0)%(0~100%)。Pearson相关性分析结果显示,患者的年龄 (r=-0.294,P=0.122)、术前JOA评分 (r=0.059,P=0.759)、术前MRI压缩率 (r=0.269,P=0.151)与术后JOA恢复率间均无明显相关性。
讨 论
颈椎后路椎板成形术具有操作简单、并发症少等特点,在治疗多节段脊髓型颈椎病、OPLL和先天性椎管狭窄症具有不可替代的优势。其原理是从后路扩大颈椎椎管,使颈髓向背侧漂起,从而间接解除脊髓前方的压迫,恢复蛛网膜下腔腹侧间隙,在缓解压迫的同时增加脊髓腹侧脑脊液的循环和脊髓前动脉的血供[6]。但是在术中只能看到脊髓背侧的结构,无法直接判断脊髓腹侧的压迫是否完全解除,而且也没有一种合适的检查手段来辅助评估这种减压是否充分。有研究者认为可以通过观察椎管扩大后硬膜背侧的搏动情况来间接推断脊髓漂浮和减压的程度[7],但这种间接观察的效果还存在争议。采用术中超声可以有效辅助医生判断颈髓减压的情况,其优势在于:(1)操作简单方便,术中实时观察;(2)可以直观显示硬膜囊形态变化,特别是腹侧硬膜囊受压的范围和程度;(3)动态观察硬膜囊搏动来判断减压效果,帮助医生决定是否需要扩大减压的范围[6,8]。
本研究依据术中超声检查脊髓搏动的形态将患者分成减压满意组和减压不满意组,考虑到术中患者处于屈颈的体位,会在一定程度上高估压迫程度,因此尽管理论上Ⅱ型患者属于脊髓压迫部分解除,但在实际操作中仍归入减压满意组。结果显示,减压满意组患者术后JOA恢复率明显高于减压不满意组;在术后随访中,有3例患者神经症状无改善(恢复率为0),均为减压不满意组;提示充分减压是影响术后神经功能恢复的重要因素,减压后脊髓搏动应该达到Ⅰ型或Ⅱ型的标准。当术中超声提示减压后硬膜搏动为Ⅲ型时,应考虑扩大减压范围或者延长减压节段。
颈椎后路椎板成形术的解剖学基础是颈椎的生理性前凸,从而导致椎板减压后脊髓向后方漂浮,因此在生理性前凸的中间节段 (C5)脊髓漂浮效果最好,而在生理性前凸的两端 (C3和C6)脊髓漂浮效果较差。所以当术中超声提示减压效果不满意时,可以采取以下方案:(1)如果压迫最明显的节段位于C2/3节段,可以用磨钻将C2的椎板腹侧磨薄甚至去除C2下缘部分椎板,增加脊髓漂浮的空间;(2)如果常规减压后C6/7处仍有压迫,可以延长减压节段,行C7椎板扩大成形术;(3)如果来源于C5椎体后缘的巨大骨性压迫,减压后脊髓漂浮不满意,可以考虑行前后路联合减压来获得满意的疗效。
有学者提出术后MRI也能够反映手术减压的效果,但与术中超声相比,首先MRI成本较高,检查时间长,增加平均住院时间。其次,国内大多数医院没有术中MRI,无法做到术中及时评估。而且有研究表明,术后MRI在评估脊髓漂浮时会出现假阳性的结果,原因可能是:(1)行MRI检查时患者为仰卧位,颈部轻度后伸,增加颈椎前凸,造成脊髓暂时后移;(2)仰卧位时,脊髓本身的重量会使其下沉,造成脊髓向后漂移的假象。此外,MRI检查不能记录脊髓搏动的动态效果,不利于减压程度的观察和评估[3]。
术前JOA评分被认为是评估预后的重要指标。有研究显示,术前临床症状较轻,特别是术前JOA评分≥10分,可提示术后预后较好[9]。也有研究认为,术前JOA评分和术后神经功能恢复没有明确相关性[1]。同样,患者的年龄和术前MRI脊髓压缩率对术后神经功能恢复的影响目前也没有统一的观点。本研究结果显示,患者的年龄、术前JOA评分和术前MRI脊髓压缩率与术后神经功能恢复均无明显相关性。
本研究的局限性在于,针对术中超声Ⅲ型的患者,没有在后路手术的同时行前路减压手术;部分术后JOA恢复率为0的患者仍在随访观察时期,还没有进行二期手术。在下一步研究中,笔者计划针对脊髓前方压迫严重,术中超声提示压迫未解除的患者,考虑同时前路手术,比较术后和远期的手术疗效。
综上,术中超声检查操作简单快捷,在颈椎后路椎板成形术中,能够有效观察脊髓搏动的情况,评估神经减压的充分与否,对指导手术减压范围和评估手术预后有重要意义。
[1]Kimura A,Seichi A,Inoue H,et al.Long-term results of double-door laminoplasty using hydroxyapatite spacers in patients with compressivecervical myelopathy[J].Eur Spine J,2011,20(9):1560-1566.
[2]Naruse T,Yanase M,Takahashi H,et al.Prediction of clinical results of laminoplasty for cervical myelopathy focusing on spinal cord motion in intraoperative ultrasonography and postoperative magnetic resonance imaging[J].Spine,2009,34(24):2634-2641.
[3]Seichi A,Chikuda H,Kimura A,et al.Intraoperative ultrasonographic evaluation of posterior decompression via laminoplasty in patients with cervical ossification of the posterior longitudinal ligament:correlation with 2-year follow-up results[J].J Neurosurg Spine,2010,13(1):47-51.
[4]Cho YE,Shin JJ,Kim KS,et al.The relevance of intramedullary high signal intensity and gadolinium(Gd-DTPA)enhancement to the clinical outcome in cervical compressive myelopathy[J].Eur Spine J,2011,20(12):2267-2274.
[5]Chiewvit P,Tritrakarn SO,Phawjinda A,et al.Predictive value of magnetic resonance imaging in cervical spondylotic myelopathy in prognostic surgical outcome[J].J Med Assoc Thai,2011,94(3):346-354.
[6]Mihara H,Kondo S,Takeguchi H,et al.Spinal cord morphology and dynamics during cervical laminoplasty:evaluation with intraoperative sonography [J].Spine,2007,32(21):2306-2309.
[7]Smith ZA,Buchanan CC,Raphael D,et al.Ossification of the posterior longitudinal ligament:pathogenesis,management,and current surgical approaches.A review [J].Neurosurg Focus,2011,30(3):E10.
[8]Seichi A,Chikuda H,Kimura A,et al.Intraoperative ultrasonographic evaluation of posterior decompression via laminoplasty in patients with cervical ossification of the posterior longitudinal ligament:correlation with 2-year follow-up results[J].J Neurosurg Spine,2010,13(1):47-51.
[9]Ahn JS,Lee JK,Kim BK.Prognostic factors that affect the surgical outcome of the laminoplasty in cervical spondylotic myelopathy[J].Clin Orthopeadic surg,2010,2(2):98-104.
