熊胆丸的质量标准研究
2012-08-06邓茂芝赵常军彭雪芬杨建春江西宜春市食品药品检验所江西宜春336000江西宜春市第六人民医院江西宜春336000
邓茂芝,赵常军,彭雪芬,杨建春(.江西宜春市食品药品检验所,江西宜春336000;.江西宜春市第六人民医院,江西宜春 336000)
熊胆丸是由龙胆、黄连、大黄、栀子、冰片、薄荷脑、熊胆等16味中药组成的复方制剂,具有清热散风、止痛退翳之功效。用于治疗风热或肝经湿热引起的目赤肿痛、羞明多泪等证。收载于《中华人民共和国卫生部药品标准中药成方制剂》第2册[1]。在日常药品监督检验中,常常会发现该药内容物凝结成柱状或团块状,按标准检验仅有性状、检查2项常规项目,而无其他检验项目,因而不能有效监控该制剂内在质量。
为进一步加强该品种的质控,并根据国家药品标准提高行动计划中中成药品种增修订项目任务表的要求,笔者在原标准的基础上,增加了熊胆、龙胆、栀子、黄连的薄层色谱(TLC)鉴别以及冰片、薄荷脑的含量测定方法。
1 仪器与试药
7890A气相色谱仪(美国安捷伦公司);BP211D电子天平(赛多利斯科学仪器(北京)有限公司);KG-250DB超声仪(昆山禾创超声仪器有限公司)。
熊去氧胆酸(批号:732-8702)、鹅去氧胆酸(批号:806-9101)、龙胆苦苷(批号:110770-200308)、栀子苷(批号:110749-200511)、盐酸小檗碱(批号:110713-200208)、冰片(批号:110743-200905)、薄荷脑(批号:110728-200506)对照品均购自中国食品药品检定研究院;熊胆丸共15批次,均从本辖区内医药批发、零售药店抽验而来,批号为20081101、071201039、20090501、090917、20080501、20070901、071030、20080601、20081003、20070503、080303030、090211、090603、090901122、090501200;制剂中各药材均为市售品,由江西省宜春市食品药品检验所鄢爱勇副主任中药师鉴定为真品;硅胶G、GF254(青岛海洋化工有限公司);甲醇、三氯甲烷、石油醚(30~60℃)、乙酸乙酯、冰醋酸、乙醚、氢氧化钠、盐酸、硫酸、水杨酸甲酯、无水乙醇均为分析纯。
2 定性鉴别
2.1 熊胆的TLC鉴别[2~9]
取本品20粒内容物,加甲醇25 mL,超声(功率:250 W,频率:50 kHz)提取20 min,过滤,水浴蒸干,残渣加20%氢氧化钠溶液15 mL,置120~140℃的液体石蜡浴中加热回流7 h,放冷,加盐酸调pH值为2~3,加水10 mL,摇匀,用三氯甲烷提取3次,每次30 mL,合并三氯甲烷提取液,蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液;取处方中不含熊胆的其他药材按制备方法制成阴性样品,同法制成阴性对照溶液;取熊去氧胆酸对照品、鹅去氧胆酸对照品适量,加甲醇分别制成每1 mL含1 mg的溶液,作为对照品溶液;另取供试品溶液及对照品溶液按1∶1混合,摇匀,制得阳性对照溶液。照TLC法[2]试验,吸取上述5种溶液各4~7µL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以三氯甲烷-石油醚(30~60℃)-乙酸乙酯-冰醋酸(10∶4∶2.5∶2.5)为展开剂,展开,展距约13 cm,取出,晾干;再以上述展开剂展开1次,展距13 cm,取出,晾干,喷以10%硫酸乙醇溶液,于105℃加热至斑点清晰,分别在日光、紫外光灯(365 nm)下检视。结果,供试品色谱中,在与2种对照品及阳性对照色谱相应的位置上,显相同颜色的斑点;阴性对照无干扰。熊胆的TLC见图1。

图1 熊胆的TLCA.日光检视;B.紫外光灯(365 nm)检视;1~3.供试品;4.熊去氧胆酸对照品;5.鹅去氧胆酸对照品;6.阳性对照;7.缺熊胆阴性对照Fig 1 TLC of bear gallA.under sunlight;B.under uvligh(t365 nm);1~3.test samples;4.ursodeoxycholic acid control;5.chenodeoxycholic acid control;6.positive control;7.negative control without bear gall
2.2 黄连的TLC鉴别[10]
取本品4粒内容物,加乙醚20 mL,超声处理30 min,弃去乙醚液,残渣加甲醇30 mL,回流提取30 min,滤过,蒸干,残渣加甲醇1 mL,作为供试品溶液;另取处方中缺黄连的其他药材按制备工艺制成阴性样品,同法制成阴性对照溶液;取盐酸小檗碱对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照TLC法[2]试验,吸取上述3种溶液各2~5µL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲醇-氨水(30∶2∶5∶7)的下层溶液为展开剂,展开,取出,晾干,在紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;阴性对照无干扰。黄连的TLC见图2。
2.3 龙胆、栀子的TLC鉴别[11~15]
取本品10粒内容物,加石油醚20 mL,加热回流1 h,滤过,弃去滤液,药渣加甲醇20 mL,回流2 h,滤过,滤液浓缩至约3 mL,加中性氧化铝(100~200目)9 g搅匀,蒸干,置层析柱(内径1.5 cm)上,用甲醇洗脱至洗脱液无色,洗脱液浓缩至约1 mL,作为供试品溶液;另取处方中分别缺龙胆、栀子的其他药材按制备工艺分别制成阴性样品,同法制成阴性对照溶液;取龙胆苦苷、栀子苷对照品适量,分别加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照TLC法[2]试验,吸取上述5种溶液各2~5µL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶GF254薄层板上,以乙酸乙酯-甲醇-水(20∶1∶0.5)为展开剂,展距13 cm,取出,晾干,再以上述展开剂展开3次,展距13 cm,取出,晾干,置紫外光灯(254 nm)下检视;再喷以10%硫酸乙醇溶液,于105℃加热至斑点显色清晰,日光下检视。结果,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;阴性对照无干扰。龙胆、栀子的TLC见图3。
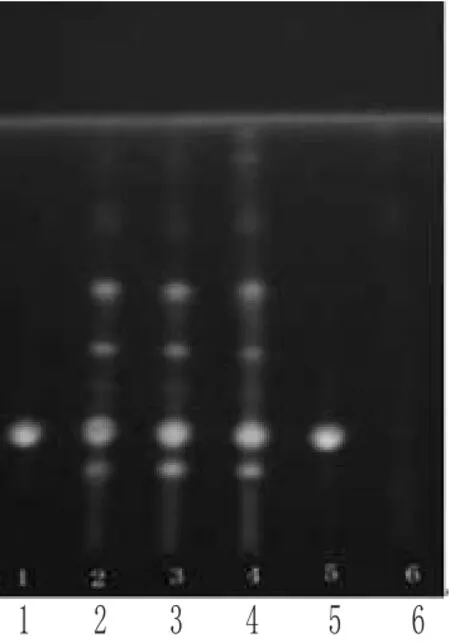
图2 黄连的TLC1、5.盐酸小檗碱对照品;2~4.供试品;6.缺黄连阴性对照溶液Fig 2 TLC of Coptidis Rhizoma1,5.berberine hydrochloride control;2~4.test samples;6.negative control without Coptidis Rhizoma
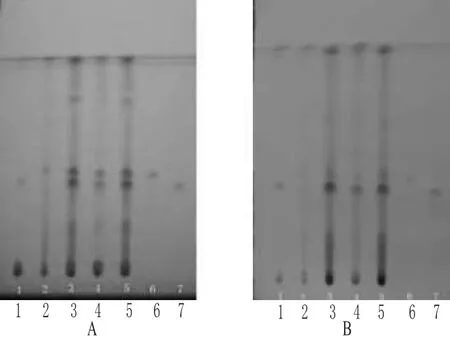
图3 龙胆、栀子的TLCA.紫外光灯(254 nm)检视;B.日光检视;1.缺龙胆阴性对照;2.缺栀子阴性对照;3~5.供试品;6.龙胆苦苷对照品;7.栀子苷对照品Fig 3 TLC of Gentianae Radix Et Rhizoma and Gardenia jasminoidesA.under uvlight(254 nm);B.under sunlight;1.negative control without Gentianae Radix Et Rhizoma;2.negative control without G.jasminoides;3~5.test samples;6.gentiopicrin control;7.jasminoidin control
3 含量测定
3.1 色谱条件与系统适用性试验[16~18]
色谱柱:DB-WAX毛细管色谱柱(30 m×0.45 mm×0.85µm);检测器温度:300℃;进样口温度:240℃;柱温:130℃;载气:高纯氮气;载气流速:3.0 mL·min-1;分流比:25∶1;进样量:1.0µL。在此色谱条件下薄荷脑、冰片(以异龙脑、龙脑计)、水杨酸甲酯色谱峰均能有效分离,在薄荷脑、冰片色谱峰相同位置处无色谱峰出现。色谱见图4。
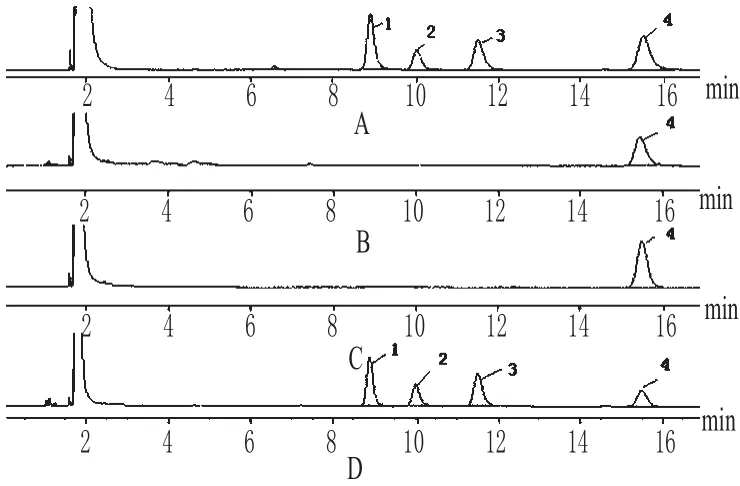
图4 气相色谱图A.供试品;B.内标;C.阴性对照;D.混合对照品;1.薄荷脑;2.异龙脑;3.龙脑;4.水杨酸甲酯Fig 4 GC chromatogramsA.test sample;B.internal standard;C.negative control;D.mixture control;1.menthol;2.isoborneol;3.borneol;4.methyl salicylate
3.2 内标溶液的制备
取水杨酸甲酯适量,加无水乙醇制成每1 mL含0.5 mg的溶液,摇匀,作为内标溶液。
3.3 混合对照品贮备液的制备
精密称取冰片对照品28.57 mg,薄荷脑对照品28.47 mg,置25 mL量瓶中,加内标溶液溶解并稀释至刻度,摇匀,即得混合对照品贮备液。
3.4 供试品溶液的制备
取本品0.5 g,精密称定,置25 mL具塞锥形瓶中,精密加入内标溶液25 mL,称定重量,超声处理(功率:250 W,频率:50 kHz)30 min,取出,放冷,补足失重,过滤,取续滤液,即得。
3.5 线性关系考察
精密吸取混合对照品贮备液0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置10 mL量瓶中,加内标溶液稀释成一系列浓度的对照品溶液,分别精密吸取1.0µL注入气相色谱仪,记录峰面积。以对照品峰面积与内标峰面积的比值(X)为横坐标,检测浓度(Y)为纵坐标,分别制备冰片、薄荷脑的回归方程。结果,冰片、薄荷脑的回归方程分别为Y=0.355 9X+0.010 7(r=0.998 7,n=7)、Y=0.360 0X+0.008 4(r=0.998 4,n=7),表明冰片、薄荷脑的检测浓度分别在56.9~683.3、56.0~672.0 μg·mL-1范围内与对照品峰面积和内标峰面积的比值呈良好线性关系。
3.6 精密度试验
精密吸取同一混合对照品溶液1.0µL,按上述色谱条件连续进样6次,测定薄荷脑、冰片峰面积,计算其与内标峰面积的比值。结果,RSD分别为2.1%、1.5%(n=6),表明仪器精密度良好。
3.7 稳定性试验
取同一供试品溶液适量,按上述色谱条件分别于0、2、4、6、8、12 h测定薄荷脑、冰片峰面积,计算其与内标峰面积的比值。结果,RSD分别为0.9%、0.9%(n=6),表明供试品溶液在12 h内稳定。
3.8 重复性试验
取同一批号样品适量,共6份,分别按“3.4”项下方法制备供试品溶液,照上述色谱条件测定薄荷脑、冰片峰面积,按内标法计算。结果,薄荷脑、冰片含量分别为6.70、7.25 mg/粒,RSD分别为1.10%,1.26%(n=6),表明方法重复性良好。
3.9 加样回收率试验
精密称取已知含量(冰片:5.10 mg/粒,薄荷脑:5.32 mg/粒)的样品9份,分为3组(样品中冰片的量为1.3、2.5、3.8 mg,薄荷脑的量为1.3、2.6、3.9 mg),每组分别精密加入含冰片(1.220 3 mg·mL-1)、薄荷脑(1.301 2 mg·mL-1)的混合对照品溶液1.0、2.0、3.0 mL,按上述色谱条件测定,计算加样回收率。结果,冰片的平均回收率为98.68%,RSD=1.1%(n=9);薄荷脑的平均回收率为99.07%,RSD=1.0%(n=9)。
3.10 样品含量测定
按所建立的方法,对15个批次(依次为序号1到15)的样品进行含量测定,结果见表1。
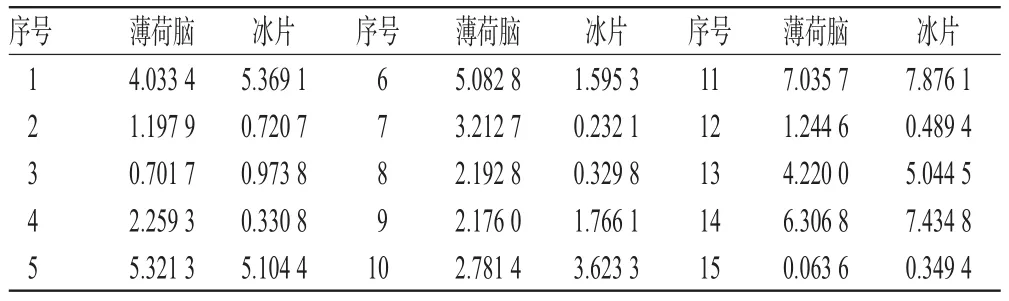
表1 样品含量测定结果(mg/粒,n=5)Tab 1 Results of content determination of samples(mg/piece,n=5)
4 讨论
为有效提取制剂中的冰片、薄荷脑,笔者对回流和超声这2种常用的方法进行了比较,溶剂采用易溶解冰片的无水乙醇。结果显示,采用回流方法进行提取时,含量略高于超声提取,但无显著差异。为保证方法的耐用性,从节约能源、操作简便的角度考虑,采用超声30 min作为提取方法。
由于栀子苷、龙胆苦苷均为环烯醚萜类,性质相似,故试验中单独做龙胆、栀子TLC鉴别时,发现阴性对照疑似有干扰成分,不能达到良好分离效果。而采用3次展开,同时检测2种成分的方法分离效果良好。
因已知冰片、薄荷脑具挥发性,在常温下不稳定,在生产过程中易损失,因此含量测定选用冰片、薄荷脑为指标。冰片对照品中含龙脑、异龙脑2种成分,含量测定是以2种成分之和为指标。
样品含量测定结果表明,不同厂家熊胆丸中薄荷脑、冰片的含量差值较大,薄荷脑含量最高与最低相差70倍,冰片的含量则相差26倍,这可能与工艺、原料质量有关。笔者还发现,有的批次甚至未检出相关成分,其胶囊内容物亦无薄荷或冰片样气味。有效成分偏低,必将影响治疗效果,应当引起重视。根据处方及测定结果,建议薄荷脑、龙脑含量均不低于4.0 mg/粒。
[1]卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂(第2册)[S].1990:291.
[2]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:附录34.
[3]王 兰.熊胆与其伪造品的鉴别[J].吉林中医药,2003,23(12):49.
[4]陈 洁,王亮明,徐成银.贝芪口服液中牛磺熊去氧胆酸的含量[J].中国医院药学,2000,20(5):269.
[5]赵 勇,昝丽霞,孙文基.HPLC-ELSD法测定熊胆粉中牛磺熊去氧胆酸和牛磺鹅去氧胆酸的含量[J].药物分析杂志,2006,26(1):127.
[6]陆 妙.RP-HPLC法测定熊去氧胆酸胶囊中熊去氧胆酸的含量[J].中国药房,2008,19(30):2 384.
[7]石 宏,崔明淑,全仙花.薄层扫描法测定复方熊胆乙肝胶囊中熊去氧胆酸、鹅去氧胆酸的含量[J].吉林中医药,2002,22(2):59.
[8]王守箐.HPLC-ELSD测定双胆痔疮栓中熊去氧胆酸含量[J].药物分析杂志,2005,25(6):722.
[9]池述广.熊胆主要化学成分合成方法及药理研究进展[J].海峡药学,2008,20(2):5.
[10]吕武清,龙新华.中成药中的药材薄层色谱鉴别[M].北京:人民卫生出版社,1997:476.
[11]赵瑞芝,梁伟杰,丘小惠.龙胆药材中龙胆苦苷的提取工艺研究[J].中国药房,2005,16(12):956.
[12]郭海风,朴患顺.龙胆苦苷的提取工艺及药理作用研究进展[J].延边大学医学学报,2010,33(1):70.
[13]赵 勇,张 儒,孙文基.大孔吸附树脂富集秦艽叶中龙胆苦苷的工艺研究[J].中药材,2007,30(12):1 583.
[14]许有威,齐 艳,韩 旭,等.高效逆流色谱结合大孔树脂从龙胆中快速分离高纯度龙胆苦苷[J].中国中药杂志,2007,32(24):2 595.
[15]刘 静,王美英.清肝合剂的薄层色谱鉴别[J].中国药师,2008,11(1):116.
[16]国家食品药品监督管理局.药品检验补充检验方法和检验项目批准件汇编(2003-2008)[Z].2009:187-189.
[17]简柳清,曾赟昀,刘声波,等.毛细管气相色谱法测定止咳枇杷颗粒中薄荷脑的含量[J].广东药学院学报,2009,25(2):167.
[18]唐 杰,陈玉谊.气相色谱法测定市售复方丹参片中冰片的含量[J].海峡药学,2008,20(8):62.
