HBV对肝癌细胞系 HepG2和 HepG2.2.15中MMP-2及MMP-9的表达影响
2012-08-03金晓明
冯 华,吴 丹,金晓明
(1.牡丹江医学院病理生理学教研室,黑龙江 牡丹江157011;2.黑龙江中医药大学附属第一医院病理科,哈尔滨150040;3.哈尔滨医科大学病理教研室,哈尔滨150081)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤,其发病率高,起病隐匿,临床缺乏有效的预防、检测及治疗手段,治愈率低下,在世界范围内,乙型肝炎病毒(hepatitis B virus,HBV)感染是HCC最重要的病因,HBV复制在肝炎、肝硬化、肝癌的发生和发展过程中,甚至肝癌的转移和复发阶段都可能起重要作用。最近许多研究表明,HBV基因型、病毒变异、HBV-DNA水平与HCC存在一定的关系,却还没有统一观点,甚至出现相反的结论。HBV致HCC的确切机制目前还不清楚。该项实验通过对人肝癌细胞系(HepG2,HepG2.2.15)中基质金属蛋白酶(matrix metalloproteinase,MMP)-2和MMP-9的表达情况的研究及对肿瘤细胞侵袭转移的影响来探讨HBV导致HCC的发生机制。
1 材料与方法
1.1 材料 人肝癌HepG2细胞购于中科院上海细胞库。人肝癌 HepG2.2.15细胞由复旦大学上海医学院医学分子病毒学重点实验室惠赠。细胞培养液DMEM(Dulbecco's modified eagle medium)由 Hyclone公司提供。胎牛血清由杭州四季青生物工程材料有限公司(HepG2细胞)及Gibco公司(HepG 2.2.15细胞)提供。明胶酶谱法所需试剂由Sigma公司提供。
1.2 方法
1.2.1 细胞培养 HepG2细胞和 HepG2.2.15细胞用含10%胎牛血清,100 mg/L青霉素和100 mg/L链霉素的DMEM培养液,其中HepG2.2.15培养液中加入250 mg/L的 G418;及 2 mmol/L谷氨酰胺,25 mmol/L4-羟乙基哌嗪乙磺酸溶液和1 mmol/L丙酮酸钠,细胞均于37℃,5%CO2孵箱中培养,培养液2~3 d更换一次,待细胞生长至80%左右时进行传代。HepG2.2.15细胞的培养要求符合二级生物安全标准,所有培养废液按照传染源处理。
1.2.2 细胞生长曲线测定 将两种细胞经胰酶消化后,细胞计数板计数,按照1×104细胞/孔接种于24孔板,次日起每天消化计数3个复孔,测定细胞数,取平均值,连续计数7 d。
1.2.3 明胶酶谱 细胞传代,调整两种细胞的细胞数。使之在1×106/瓶,培养1 d后吸去培养液,磷酸盐缓冲液(PBS)洗3次,分别加入无血清的DMEM 2 mL/瓶,48 h后吸取培养液离心(3000 r/min)10 min。取上清-80℃冻存备用。根据Kleiner等的方法加以改进酶谱法(SDS-PAGE enzymography):取无血清培养液4 μL与4×上样缓冲液混匀,放置于37℃孵箱中孵育30 min。取混合后样品20 μL上样于含1 g/L明胶的10%SDS聚丙烯酰胺凝胶中,80 V恒压下电泳,当溴酚蓝跑至分离胶与浓缩胶分离处时改为120 V恒压直到溴酚蓝跑至凝胶底部,取出凝胶放于摇床中,用含25 mL/L TritonX-100的洗脱液(50 mmol/L Tris-HCl,200 mmol/L NaCl,10 mmol/L CaCl2,20 mmol/L ZnCl2)振荡洗脱3 次,每次30 min,然后加入适量孵育液(50 mmol/L Tris-HCl,200 mmol/L NaCl,10 mmol/L CaCl2,20 mmol/L ZnCl2)置于37 ℃恒温箱中孵育24 h,用染色液(0.1%考马斯亮蓝R-250,30%甲醇,10%冰乙酸)染色2 h,再用脱色液A、B、C(甲醇浓度分别为30%、20%、10%,冰乙酸浓度分别为 10%、10%、5%)分别脱色 30 min、1 h、2 h,此刻即可呈现出MMPs位于蓝色背景下的白色透明条带。将电泳凝胶在灰阶模式下扫描,应用Band leader 3.0软件分析,设定参考值,读取条带面积和酶解条带灰度,酶表达量=条带面积×(平均灰度值-背景灰度值)。
1.3 统计学方法 用SPSS 15.0软件所得的HepG2细胞和HepG2.2.15细胞的 MMP-2和 MMP-9的酶表达量进行统计处理,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长曲线 在第1天HepG2细胞和生长速度慢于HepG2.2.15细胞,在第2天以后,其生长速度则明显快于 HepG2.2.15 细胞(F=11.290,P <0.05)(表1,图 1)。
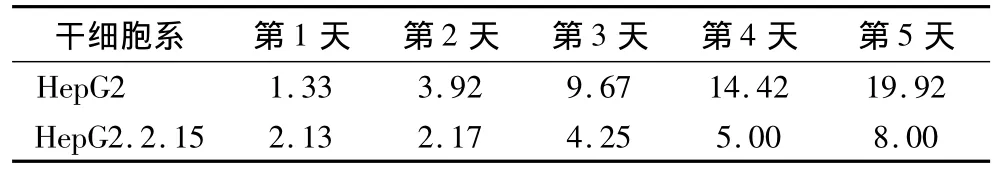
表1 HepG2和HepG2.2.15细胞生长速度(细胞数×5000)

图1 细胞计数
2.2 明胶酶谱检测两种细胞中MMP-9和MMP-2的表达情况 MMP-9在HepG2细胞中的表达高于HepG2.2.15细胞(P <0.05),MMP-2 在 HepG2 细胞和HepG2.2.15细胞中的比较,表达差异无统计学意义(P >0.05)(表2)。

表2 明胶酶谱检测2种细胞中MMP-2和MMP-9的表达情况
3 讨论
HCC是我国最常见的恶性肿瘤之一,浸润和转移是HCC重要的恶性生物学行为,是制约临床治疗效果的重要因素。转移的过程虽然复杂,但其中细胞外基质的降解和细胞表面黏附分子的改变是最重要的原因[1]。MMPs家族即是在此过程中发挥重要作用的一类蛋白水解酶。其中,MMP-2、MMP-9是降解Ⅳ型胶原最主要的酶,其在肿瘤细胞的浸润和转移灶的形成以及肿瘤血管化的过程中均起重要作用[2-3]。
HBx是HBV病毒中一种多功能调节蛋白,能影响细胞基因的转录,激活细胞内信号转导,促进病毒复制,加速蛋白降解,调控细胞周期,调节细胞增殖、凋亡和肝细胞发生癌变等。HBx基因如何导致细胞向恶性变发展成为近年来研究的热点,但明确的报道十分罕见。一些研究指出,HBVx蛋白可调控p21WAF1/CIP1蛋白的表达,从而影响细胞正常的代谢活动。p21WAF1/CIP1蛋白具有抗宿主细胞变异和复制、增殖的功能,由此发挥其抑癌作用。p21WAF1/CIP1蛋白在细胞凋亡中有双重表现。一方面,p21WAF1/CIP1蛋白可抑制凋亡:p21的N端通过与caspase-3前体结合,使其不能活化,丧失对蛋白激酶的活化作用,受损细胞免于Fas介导的细胞凋亡。另一方面,p21WAF1/CIP1蛋白通过对细胞周期的阻滞间接参与了细胞凋亡。
HBx是肝细胞发生癌变的重要基因,它通过与细胞因子或蛋白结合而发挥肝癌变作用,在慢性HBV感染的肝脏细胞中,HBx可通过调控p21WAF1/CIP1基因的表达,发挥它在HBV相关性HCC中的癌变作用。HBx在不同的细胞状态既可上调该基因的表达量,延长细胞从G1期进展到S期,也可下调p21WAF1/CIP1基因的表达,使受损的异常细胞无控制地增殖,导致HCC的发生。
该项实验研究所用的细胞系HepG2.2.15细胞来源于HepG2细胞,其中转染了HBV并能稳定复制。白文林等[4]的研究结果表明,HepG2.2.15 细胞所表达的p53的量较HepG2细胞所表达量为高。HBV在HepG2.2.15细胞中的复制对p53的表达及功能并没有产生抑制作用,反而具有一定的促进作用。HBV作为一种病毒,它在细胞内的复制有可能作为激发p53活性的因素,使p53的表达及功能增强,进而可能导致细胞某些生物学活性(如细胞凋亡、细胞周期等)的改变,可能是细胞感染HBV后的保护性反应。这与本研究结果也具有相似性,即HBV促进了肝癌细胞的凋亡,使HepG2.2.15细胞的生长速度慢于HepG2细胞。
Saito等[5]发现大多数 MMPs是肿瘤细胞分泌的,但更多情况下是由宿主细胞,如巨噬细胞、成纤维细胞、内皮细胞等分泌,因此MMPs表达被认为是一种诱导的宿主反应。这提示肿瘤细胞可以通过可溶性介质或膜结合分子与间质细胞进行信息交换,有利于肿瘤发生侵袭和转移。
本研究中明胶酶谱结果显示,HepG2细胞中的MMP-9的表达水平高于 HepG2.2.15细胞。提示HBV中的HBx可能通过调控p21WAF1/CIP1基因的表达,上调该基因的活性,继而使p53的表达增强,从而促进细胞凋亡的发生,使 HepG2.2.15细胞分泌MMPs的量减少,从而影响了其侵袭和转移的能力。对于同一细胞中MMP-2和MMP-9表达水平的差异,其可能的机制为:①两者的调节机制不同,MMP-9的转录是由细胞因子(白细胞介素1、肿瘤坏死因子α等和表皮生长因子、血小板源性生长因子等)调控的,而MMP-2则由转化生长因子β调控。②两者在基膜和细胞外基质破坏的方式及程度,以及促进肿瘤浸润与转移中所起的作用不同。其详尽机制目前仍未明了,推测可能与细胞的特异性有关。
综上所述,HBV可通过多种途径抑制HCC的生长,通过明胶酶分泌量的减少而影响其侵袭和转移的能力。随着对HBV相关机制的深入研究,对HCC与HBV相互关系的研究具有一定的指导意义。MMP-2和MMP-9的高表达可促进HCC的侵袭和转移。该项研究对于特异性明胶酶抑制剂的研究及临床应用也具有一定的指导意义。
[1]刘亮明,罗文,刘晶美,等.HBX在原发性肝癌发病中的作用及其生物治疗策略[J].世界华人消化杂志,2005,13(4):432-439.
[2]Chamber AF,Matrisian LM.Changing views of matrix metalloproteinase in metastasis[J].Natl Cancer Inst,1997,89(6):1260-1265.
[3]Parsons SL,Watson SA,Collins HM,et al.Gelatinase(MMP-2 and MMP-9)expression in gastrointestinal malignancy[J].Br J Cancer,1998,78(11):1495-1502.
[4]白文林,曲建,慧楼敏,等.HepG2与 HepG2.2.15细胞中p53表达及活性的比较[J].实用肝脏病杂志,2008,11(5):295-311.
[5]Saito K,Takeha S,Shiba K,et al.Clinicopathologic significance of urokinase receptor and MMPS-9 positive stromal cells in human colorectal cancer:functional multiplicity of matrix degradation on hematogenous matastasis[J].Int J Cancer,2000,86(1):24-29.
