突变型α突触核蛋白对大鼠皮质神经元原代培养存活率的影响
2012-08-02安恩训
王 鹏 许 洁 安恩训 于 顺 何 欣
(北华大学医学院基础医学院人体解剖学教研室,吉林 吉林 132013)
黑质多巴胺能神经元发生变性坏死,以及路易小体(Lewy body)和路易轴索(Lewy neurite)的形成〔1,2〕是帕金森病(PD)的主要病理特征。α-突触核蛋白(Syn)的变性聚集是参与形成淀粉样变性的主要成分,主要分布于突触前膜和核膜〔3,4〕。Syn与微管蛋白之间存在分子伴侣关系。体外实验证明,α-Syn能够促进微管蛋白的聚合,加速微管的形成〔5〕。在PD患者脑中,α-Syn被证明与 α-tubulin、tau蛋白以及 MAP1B共存于 Lewy body中〔6,7〕,但其生理功能仍未完全清楚。一些家族性 PD患者的 α-Syn基因中第88位碱基发生G-C突变,导致氨基酸序列第30位丙氨酸(Ala)变成脯氨酸(Pro)(A30P);另有第209位核苷酸发生了G-A突变,使氨基酸序列中第53位丙氨酸(Ala)变成苏氨酸(Thr)(A53T)。突变的α-Syn A53T和A30P出现生理功能异常,在PD发病过程中起着重要的作用。本研究旨在观察A53T和A30P对原代培养神经元存活率的影响,进一步明确突变体α-Syn的生理功能,为揭示二者导致家族性PD发病的机制提供线索。
1 材料与方法
1.1 主要试剂 DMEM(F-12)细胞培养基,购自 GIBCO公司;BCA蛋白质定量试剂盒BCA Protein Assay Kit,购自宝生物;α-Syn单克隆抗体3D5,由宣武医院老年病研究所神经生物研究室制备;FITC标记的羊抗鼠抗体,购自中衫公司;蛋白分子量Marker,购自Pharmacia;胎牛血清(FBS)和马血清(HS),购自HyClone。其他均为化学分析纯试剂。
1.2 实验动物 新生24 h的Wistar大鼠40只,雌雄不限,购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)。
1.3 实验方法
1.3.1 重组蛋白的克隆与纯化 将α-Syn和家族性突变体A53T、A30P的cDNA分别插入pET(3a),然后转至BL21(DE3)中,在含氨苄西林的YTA培养基中培养,诱导表达。所表达的基因重组型蛋白采用离子交换层析和反向层析法纯化。纯化后的蛋白用SDS-PAGE法鉴定,BCA法定量。
1.3.2 原代神经元培养 将新生24 h的大鼠断头取脑,置于D-Hank缓冲液中,剥净血管脑膜。剥离皮质与髓质,剪成若干小块。胰酶消化45 min后吹散,200目筛网过滤。800 r/min离心2 min。弃上清,细胞沉淀用DMEM培养基混匀,细胞计数。以每皿0.75×105个的密度接种在用多聚赖氨酸包被的培养皿中培养。加入相应蛋白分组,进行观察。
1.3.3 神经元培养观察 培养至第1、2、4小时,向培养皿中添加终浓度为1%的戊二醛,固定1 h。随机挑选30个视野,每视野有5个以上神经元。10×40光镜下观察,照片分辨率1 300×1 030,TIF格式。
1.3.4 Western印迹法和免疫荧光法鉴定α-Syn的作用 培养至观察时间,吸弃培养皿中的培养基,PBS冲洗,刮下细胞。功率200 W,2次30 s超声破碎。破碎后的溶液加入SDS-PAGE上样缓冲液,沸水中煮5 min。4℃,12 000 r/min,离心20 min。弃沉淀,取30 μl上清作为样品,进行SDS-PAGE电泳。电泳结束后转膜,封闭。冲洗后,以1∶1 000比例稀释的3D5抗体反应过夜。洗膜,加入1∶5 000稀释的生物素标记的羊抗鼠抗体溶液反应。冲洗后,ECL法显示条带并鉴定结果。
培养细胞固定,冲洗培养皿。以含10%羊血清的PBST封闭1 h。弃封闭液,加入1∶5 000稀释的3D5抗体1.5 ml,4℃过夜。PBST冲洗,加入1∶500稀释的 FITC标记羊抗鼠抗体,37℃,2 h;吸弃反应液,PBST冲洗。荧光显微镜下观察并鉴定结果。
1.3.5 培养分组方案 向原代神经元培养基中添加终浓度为20 μmol/L 的 α-Syn、突变型 A53T、A30P 和 BSA,培养至第1、2、4小时观察。分别添加终浓度为20、40、60 μmol/L的相应蛋白,培养至4 h,观察突起长度变化。
1.4 统计学方法 采用SPSS12.0软件,所有数据均进行正态性检验。数据以±s表示,多组样本均数比较采用方差分析,两组比较采用t检验。两变量的相关分析采用Bivariate过程的Pearson直线相关法。
2 结果
2.1 重组蛋白纯化鉴定结果 SDS-PAGE鉴定,经纯化得到纯度较高的 α-Syn 和 A53T、A30P,见图1。

图1 蛋白纯化后SDS-PAGE电泳图
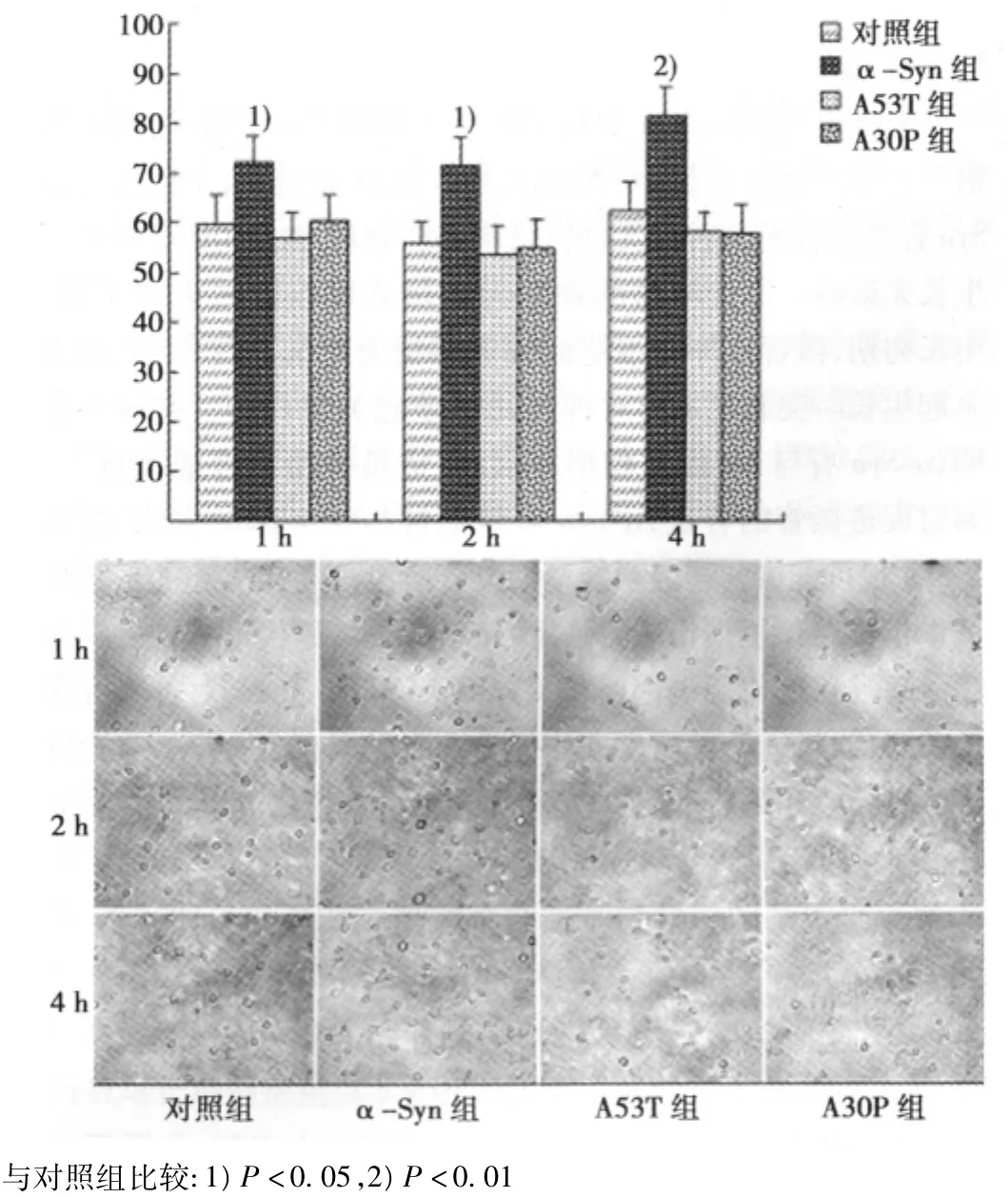
图2 α-Syn和其突变体A53T、A30P对神经元存活率的影响
2.2 α-Syn、A53T和A30P对原代培养神经元存活率的影响见图2。培养至1、2 h,添加α-Syn组的神经元数目大于对照组(P<0.05),A53T组和A30P组与对照组无差异(P>0.05)。培养至4 h,α-Syn组存活神经元数目明显大于对照组(P<0.01),A53T组和A30P组与对照组之间无差异(P>0.05)。添加不同浓度的蛋白,α-Syn组神经元存活率随浓度增加而增加,而A53T组和A30P组无变化。α-Syn从培养基进入神经元细胞内,A53T和A30P不能进入神经元。Western印迹结果显示α-Syn组神经细胞裂解液呈清晰条带,为阳性;A30P、A53T和对照组均为阴性(图3A)。免疫荧光实验结果显示α-Syn神经元显色为阳性,对照组、A53T和A30P组不显色,为阴性(见图3B)。

图3 外源α-Syn、A53T和A30P在神经元内的表达
3 讨论
Sung等发现α-Syn抑制H19-7大鼠海马神经祖细胞的增殖〔8〕。本实验结果显示,在原代神经元培养初期(4 h内),α-Syn提高原代培养神经元的存活率,而A53T和A30P对神经元生长无影响。原代培养的神经元在培养皿以贴壁方式生长。生长初期,微管在神经细胞的轴突和树突中起支撑作用,帮助突起生长。突起复发出对神经元贴壁起关键作用。有研究证明,α-Syn有与tau蛋白相似,可以促进微管蛋白合成微管〔9〕。通过促进微管的合成,α-Syn可帮助神经元突起的生长,提示α-Syn很可能参与神经系统早期发育阶段神经元突起的形成以及中枢神经系统损伤后的修复。α-Syn提高原代培养神经元的存活率与这一作用也密切相关。而A53T和A30P对神经元生长无影响,可能与其发生家族性突变有关。正常α-Syn蛋白分子含有穿梭序列,该序列能够介导 α-Syn穿过细胞膜〔10,11〕。而30和53位氨基酸的突变导致α-Syn的构象改变不能进入神经元,失去提高神经元存活率的能力。家族PD患者由于发生α-Syn的突变,可能影响微管的合成和有序排列,致使神经元轴浆转运紊乱或修复和重建障碍,导致细胞间或细胞内无定形物形成聚集,发生多巴胺能神经元死亡。此研究结果为揭示α-Syn突变型A53T和A30P的生理功能及其与微管蛋白的关系提供了新证据,对揭示α-Syn突变导致神经元退行性死亡的机制具有重要意义。
1 Forno LS.Neuropathology of Parkinson′s disease〔J〕.Neuropathol Exp Neurol,1996;55(3):259-72.
2 Spillantini MG,Crowther RA,Jakes R,et al.alpha-Synuclein in filamentous inclusions of Lewy bodies from Parkinson′s disease and dementia with lewy bodies〔J〕.Proc Natl Acad Sci U S A,1998;95(11):6469-73.
3 Polymeropoulos MH,Higgins JJ,Golbe LI,et al.Mapping of a gene for Parkinson′s disease to chromosome 4q21-q23〔J〕.Science,1996;274(5290):1197-9.
4 Kruger R,Muller T,Riess O.Involvement of alpha-synuclein in Parkinson′s disease and other neurodegenerative disorders〔J〕.Neural Transm,2000;107(1):31-40.
5 Alim MA,Ma QL,Takeda K,et al.Demonstration of a role for alpha-synuclein as a functional microtubule-associated protein〔J〕.J Alzheimers Dis,2004;6(3):435-42.
6 Jensen PH,Islam K,Kenney J,et al.Microtubule-associated protein 1B is a component of cortical Lewy bodies and binds alpha-synuclein filaments〔J〕.J Biol Chem,2000;275:21500-7.
7 Mamah CE,Lesnick TG,Lincoln SJ,et al.Interaction of alpha-synuclein and tau genotypes in Parkinson′s disease〔J〕.Ann Neurol,2005;57(3):439-43.
8 Sung JY,Kim J,Paik SR.Induction of neuronal cell death by Rab5A-dependent endocytosis of alpha-synuclein〔J〕.Biol Chem,2001;276(29):27441-8.
9 Alim MA,Hossain MS,Arima K,et al.Tubulin seeds alpha-synuclein fibril formation〔J〕.J Biol Chem,2002;277:2112-7.
10 Chen L,Jin J,Davis J,et al.Oligomeric alpha-synuclein inhibits tubulin polymerization〔J〕.Biochem Biophys Res Commun,2007;356(4):548-53.
11 Keun JA,Seung RP,Kwang CC,et al.Amino acid sequence motifs and mechanistic features of the membrane translocation of α-synuclein〔J〕.J Neurochem,2006;97(2):265-79.
