布比卡因影响小鼠肺泡上皮液体清除的作用机制研究
2012-07-31聂宏光
于 同,崔 湧,付 瑜,杜 杰,聂宏光
(1中国医科大学代谢病分子机制与药物研究所,沈阳 110001;2中国医科大学附属第一医院)
肺泡液体清除率(alveolar fluid clearance,AFC)对肺脏生理和病理状态(肺水肿、急性肺损伤和成人呼吸窘迫症等)下的液体平衡均起重要的调控作用。AFC增加能加速肺水肿的恢复,改善肺泡上皮的气体交换[1];AFC 降低则可诱发肺水肿[2,3]。有报道,布比卡因颈丛麻醉及布比卡因过敏均可致急性肺水肿[4~6],但具体机制尚不清楚。肺泡上皮细胞顶侧膜的上皮钠通道(epithelial sodium channel,ENaC)是影响AFC的主要决定因素[3],布比卡因可能是通过抑制ENaC而降低AFC。2011年8月~2011年12月,我们观察了布比卡因对在体小鼠肺泡液体清除率(AFC)的影响,探讨其作用机制。
1 材料与方法
1.1 材料 健康雄性昆明小鼠48只,鼠龄8~10周,体质量20~30 g。由中国医科大学实验动物中心提供,动物合格证号:SCXK(辽)2008-0005。布比卡因、小牛血清白蛋白及相关试剂均购于美国Sigma公司。小动物呼吸机(HX-300,成都泰盟科技有限公司),Anthos 2010全自动定量酶标仪(郑州安图生物工程有限公司)。
1.2 实验方法
1.2.1 动物分组及干预 将48只小鼠分为六组。各组均予10%水合氯醛4 mL/kg腹腔麻醉,钝性分离并切开气管后行气管插管,翻转小鼠置于左侧卧位;稳定10 min后经气管导管随机注入0.3 mL含不同药物的等渗5%小牛血清白蛋白(BSA)液(0.9%生理盐水配制),对照组(n=9)不含药物;阿米组(n=9)含1 mmol/L阿米洛利;布比组(n=6)含1 mmol/L布比卡因;布比+阿米组(n=8)含1 mmol/L布比卡因和1 mmol/L阿米洛利;特布组(n=10)含0.1 mmol/L特布他林;布比+特布组(n=6)含1 mmol/L布比卡因和0.1 mmol/L特布他林。
1.2.2 AFC测定 注射后采用小动物呼吸机行100%O2通气30 min,用1 mL注射器经气管插管缓慢负压吸取肺泡内液体,采用定量酶标仪测定小牛血清白蛋白浓度,参照文献[7]计算 AFC。AFC=[(Vi-Vf)/Vi]×100,Vf=Vi× Pi/Pf,式中 Vi和 Vf分别为起始注入肺泡内(i)和灌注30 min后吸出的肺泡液(f)液体体积,P为白蛋白浓度。
1.3 统计学方法 采用Origin 8.0软件行统计学处理。数据采用±s表示,单因素ANOVA检验。P≤0.05为差异有统计学意义。
2 结果
各组AFC比较见表1及图1、图2。
表1 各组AFC比较(±s)
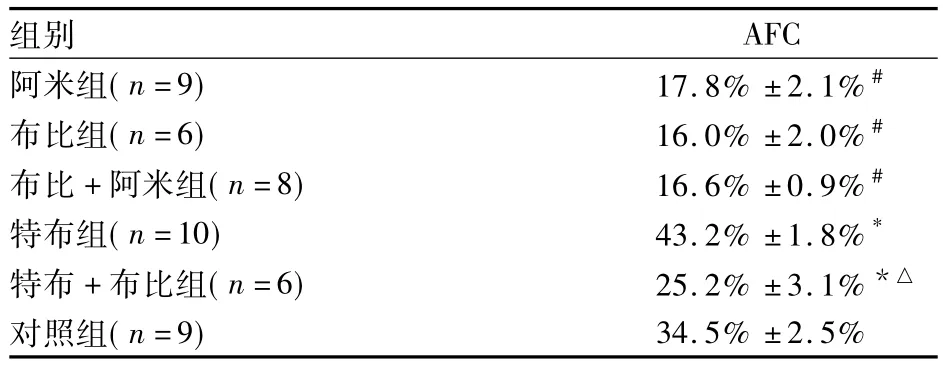
表1 各组AFC比较(±s)
注:与对照组比较,*P <0.05,#P <0.01;与特布组比较,△P<0.01
组别AFC阿米组(n=9) 17.8% ±2.1%#布比组(n=6) 16.0% ±2.0%#布比 +阿米组(n=8) 16.6% ±0.9%#特布组(n=10) 43.2% ±1.8%*特布+布比组(n=6) 25.2% ±3.1%*△对照组(n=9)34.5% ±2.5%
如表1所示,阿米组、布比组及布比+阿米组AFC均明显低于对照组。布比组、阿米组及布比+阿米组AFC比较无统计学差异;即布比卡因和阿米洛利均能降低AFC。特布组AFC明显高于对照组,特布+布比组AFC明显低于特布组,提示特布他林能完全拮抗布比卡因对AFC的抑制作用。

图1 阿米组、布比组、布比+阿米组肺水清除率比较
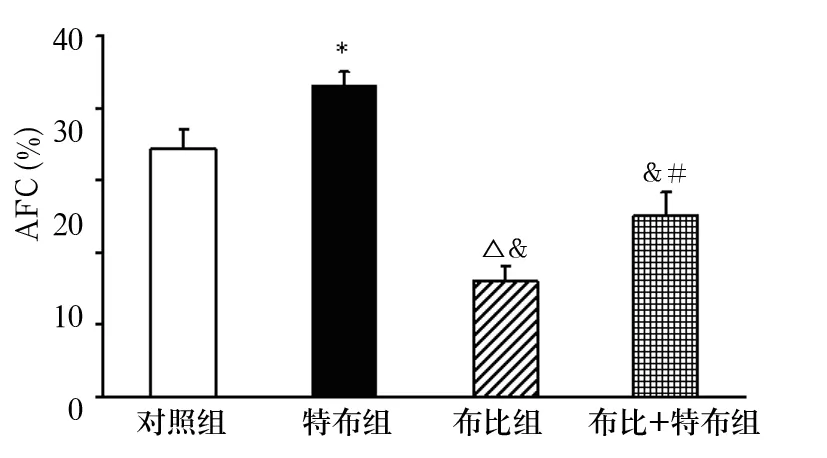
图2 特布组、布比组、布比+特布组肺水清除率比较
3 讨论
为保证良好的气体交换,肺泡腔内必须保持干燥。研究证实,AFC在维持肺泡腔干燥方面起重要作用[3,8],增加AFC能够加速肺泡腔内水肿液的吸收,有利于气体通过肺泡上皮进行交换[1];AFC降低通常与急性肺损伤和急性呼吸窘迫综合症病情的恶化、导致肺水肿的发生有关[2,3]。布比卡因是长效酰胺类局麻药,适用于外周神经阻滞、硬脊膜外阻滞和蛛网膜下腔阻滞(其他给药方法或途径均慎用,静注区域阻滞禁忌使用)。肺水肿的发生是多种因素共同作用的结果,由肺静水压和毛细血管压力增加(如心源性肺水肿)或微血管和肺泡对电解质通透性增加(如在急性肺损伤时通透性增强型肺水肿)引起。因布比卡因颈丛麻醉及布比卡因过敏均可导致急性肺水肿的发生[4~6],故探讨布比卡因与AFC的关系具有重要意义。
在过去的30多年里,学者们对肺泡内盐和液体的重吸收进行了广泛的研究。有证据表明在体情况下通过肺泡上皮的Na+主动转运途径在新生儿肺泡液体重吸收以及维持成年肺脏的肺泡腔干燥状态方面发挥重要作用,特别是在肺泡对血浆蛋白通透性增加或肺静水压增加时尤为重要。目前普遍认为AFC部分是通过ENaC和非阿米洛利敏感性钠通道转运途径参与肺泡的液体平衡[9,10]。Na+通过肺泡上皮细胞顶侧膜的ENaC进入,再通过基底膜排出(主要由Na+-K+-ATP酶参与),在细胞内外形成渗透压梯度,依靠肺泡上皮紧密的屏障结构,清除肺泡内多余积液。在此过程中,Na+通过顶膜侧通道的进入是限速步骤。本研究中布比组与阿米组AFC均未见进一步降低,表明布比卡因可能通过抑制阿米洛利敏感性ENaC进而影响AFC,加重肺泡液体积聚或抑制肺泡液体清除。特布他林为β-受体激动剂,能改善肺泡Na+和液体的重吸收,增加AFC。特布他林有效的减轻肺水肿,其作用机制是上调ENaC活性,加速水肿液的清除[11]。本研究特布组AFC明显高于其他各组,与以往报道的结果相似[12];特布组AFC亦明显高于特布+布比组,提示特布他林能拮抗布比卡因对AFC的抑制作用,可能对布比卡因所致肺水肿有一定治疗作用。此可为临床治疗布比卡因所致的肺水肿提供理论指导。
本研究结果证实,阿米洛利敏感性钠通道参与了布比卡因降低AFC,从而导致肺水肿的发生。布比卡因通过抑制心肌细胞钠通道导致心肌抑制而参与肺水肿发生的机制还需进一步研究。
[1]Perkins GD,McAuley DF,Thickett DR,et al.The beta-agonist lung injury trial(BALTI):a randomized placebo-controlled clinical trial[J].Am J Respir Crit Care Med,2006,173(3):281-287.
[2]Matthay MA,Robriquet L,Fang X.Alveolar epithelium:role in lung fluid balance and acute lung injury[J].Proc Am Thorac Soc,2005,2(3):206-213.
[3]Ware LB,Matthay MA.Clinical practice.Acute pulmonary edema[J].N Engl J Med,2005,353(26):2788-2796.
[4]Cotileas P,Myrianthefs P,Haralambakis A,et al.Bupivacaine-induced myocardial depression and pulmonary edema:a case report[J].J Electrocardiol,2000,33(3):291-296.
[5]韦明福.布比卡因复合利多卡因颈丛麻醉中毒致急性肺水肿一例[J].右江医学,2011,39(1):118-119.
[6]班荣球.布比卡因过敏致严重支气管痉挛和急性肺水肿二例[J].临床麻醉学杂志,2006,22(7):533.
[7]Sakuma T,Gu X,Sugita M,et al.Catecholamine clearance from alveolar spaces of rat and human lungs[J].Respiration,2005,72(2):189-196.
[8]Drake RE,Doursout MF.Pulmonary edema and elevated left atrial pressure:four hours and beyond[J].News Physiol Sci,2002,17(6):223-226.
[9]Matalon S,Benos DJ,Jackson RM.Biophysical and molecular properties of amiloride-inhibitable Na+channels in alveolar epithelial cells[J].Am J Physiol,1996,271(1):L1-22.
[10]Laffon M,Jayr C,Barbry P,et al.Lidocaine induces a reversible decrease in alveolar epithelial fluid clearance in rats[J].Anesthesiology,2002,96(2):392-399.
[11]Matthay MA,Folkesson HG,Clerici C.Lung epithelial fluid transport and the resolution of pulmonary edema[J].Physiol Rev,2002,82(3):569-600.
[12]Minakata Y,Suzuki S,Grygorczyk C,et al.Impact of beta-adrenergic agonist on Na+channel and Na+-K+-ATPase expression in alveolar type II cells[J].Am J Physiol,1998,275(2):L414-1422.
