肥胖大鼠海马内TNF-α、胰岛素降解酶、PPARγ和Aβ的表达及其作用
2012-07-31杨思思张木勋
杨思思,姜 腾,张木勋
(华中科技大学附属同济医院内分泌科,湖北 武汉 430030)
随着生活水平提高和生活方式改变,肥胖已成为世界范围的多发病,它是非传染性疾病的重要危险因素之一[1]。阿尔茨海默病(Alzheimer disease,AD)是一种严重的中枢神经系统退行性疾病,严重损害患者的认知功能,造成患者自理能力障碍及精神行为异常。流行病学研究显示,肥胖是AD的独立危险因子[2]。AD最典型的病理改变是:淀粉样β肽(amyloid β -peptide,Aβ)沉积导致的老年斑及微管相关蛋白tau过度磷酸化导致的神经纤维缠结,多数学者认为Aβ沉积是AD始发病理生理学改变,可导致tau蛋白过度磷酸化[3-5]。研究显示肥胖人群海马内Aβ沉积较正常人群出现得早且重[6],具体机制仍不清楚,有学者认为与肥胖时机体处于慢性炎症状态有关。肥胖时机体呈现由炎症因子诱导产生的全身性慢性低度炎症状态,研究表明TNF-α表达增加可引起Aβ沉积[7-9]。胰岛素降解酶 (insulindegrading enzyme,IDE)是体内降解Aβ的重要酶之一,胰岛素及Aβ均是其作用底物,两者可竞争性与其结合。IDE表达减少可使Aβ降解减少从而沉积[5]。另外,IDE表达可能受过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)调控[10]。本实验旨在研究肥胖时 TNF -α、PPARγ及IDE表达,从而探讨肥胖时海马内 Aβ沉积增多的机制。
材料和方法
1 动物模型
雄性SD大鼠(华中科技大学同济医学院动物中心提供),体重180~220 g,10~12周龄。随机将大鼠分为对照组(control,CTL组)与肥胖组(obesity,OB组)。CTL组予正常饮食、OB组予高脂高糖高蛋白饮食(热卡百分比为碳水化合物26.0%,蛋白质15.2%,脂肪58.8%)饲养12周。大鼠肥胖判断标准:经高糖高脂高蛋白饲料喂养,大鼠体重超过普通饲料喂养的20%作为OB组。成模后断颈处死所有老鼠,快速断头冰上操作取双侧海马,一侧分为两半,分别放入2个灭菌离心管中(分别用于实时荧光定量PCR和Western blotting);另一侧置于4%多聚甲醛中固定(用于免疫组织化学染色)。
2 观察指标及方法
2.1 一般指标测定 (1)血糖(plasma glucose)测定:处死前由尾静脉采血,用血糖仪(强生稳豪)检测血糖水平。(2)血浆胰岛素(plasma insulin)测定:处死前心脏取血1 mL,离心后取血浆,-20℃保存,放射免疫法一次性检测。药盒购自北京原子能研究所。(3)胰岛素抵抗指标计算:稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=空腹胰岛素(fasting plasma insulin,mIU/L)×空腹血糖(fasting plasma glucose,FPG,mmol/L)/22.5[11]。
2.2 实时荧光定量PCR检测海马内TNF-α、淀粉样 β 蛋白前体(amyloid β -protein precursor,APP)、PPARγ及IDE mRNA水平 用Trizol法提取各组织总RNA,测定样品中260 nm和280 nm吸收峰的A值,鉴定RNA纯度和含量。逆转录-聚合酶链反应:按照逆转录试剂盒操作步骤制备cDNA;20 μL体系,实时荧光定量PCR仪上样;反应条件95℃ 3 min,95 ℃ 15 s,58 ℃ 20 s,72 ℃ 30 s,重复40 个循环。由熔解曲线判定PCR反应的特异性,根据标准曲线以及荧光曲线的Ct值计算定量结果。通过2-ΔΔCt计算各指标的表达,ΔCt=Ct目的基因- Ct内参照,ΔΔCt=ΔCt实验组-ΔCt模型对照组,cDNA 表达差别倍数以 2-ΔΔCt表示。引物序列见表1。

表1 引物序列Table 1.Sequences of the primers
2.3 Western blotting检测大鼠海马 TNF - α、Aβ42、PPARγ及IDE蛋白水平 取海马放入匀浆器内,加入蛋白质提取液,冰上匀浆(总蛋白质提取液购自武汉凌飞科技公司)。于4℃、12000×g离心10 min,取上清即为蛋白质。取10 μL用Bradford法检测蛋白质浓度,余储存于-80℃备用。用前加2×样本缓冲液并混匀,于100℃变性5 min。在具10道双垂直电泳槽孔内加入约12 μg蛋白质,10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),结束转至PVDF膜。摇床上5%的脱脂奶粉中封闭,37℃ 1 h;杂交Ⅰ抗[Aβ42(Epitomics)、IDE(Epitomics)、PPAR γ (Santa Cruz)和TNF-α(Abcam)]4℃过夜。TBST洗膜3次,每次10 min;杂交Ⅱ抗(辣根酶标记的羊抗兔、羊抗鼠IgG,购自Santa Cruz),室温摇床上1 h,TBST洗膜3次,每次10 min。ECL试剂盒显色(ECL试剂盒购于武汉凌飞科技公司)。运用Quantity One凝胶吸光度分析软件对免疫反应条带进行定量分析。
2.4 免疫组织化学法检测大鼠海马中TNF-α、Aβ42、PPARγ及IDE组织表达 海马经4%多聚甲醛中固定48 h后,经梯度乙醇脱水,二甲苯透明,石蜡包埋,制作冠状石蜡切片,按照免疫组织化学染色步骤:烘片、脱蜡至水、抗原修复、血清封闭、加Ⅰ抗、加Ⅱ抗、DAB显色、苏木素复染、分化、封片、照相。用计算机图像分析系统(Olympus)随机选择5个视野内的阳性表达区域进行图像扫描分析,得到平均吸光度值,平均吸光度越大,表示相关的抗原表达越强。
3 统计学处理
用SPSS 11.5数据处理软件进行统计处理。计量资料以均数±标准差()表示。各组均数间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 两组大鼠体重、血糖、胰岛素及胰岛素抵抗程度的比较
表2显示OB组及MET组血糖较CTL组无明显差异;OB组体重上升高于20%,血浆胰岛素水平及胰岛素抵抗程度均高于CTL组(P<0.01,P<0.05),说明高糖高脂高蛋白饮食造肥胖大鼠模型成功。
表2 动物分组及一般资料Table 2.Design of experimental rats and laboratory data(.n=10)

表2 动物分组及一般资料Table 2.Design of experimental rats and laboratory data(.n=10)
CTL:control;OB:obesity.*P <0.05,**P <0.01 vs CTL.
Group Diet Weight(g)Plasma glucose(mmol/L) Plasma insulin(U/L)HOMA-IR CTL Normal 300.2 ±16.8 6.72 ±0.32 7.48 ±0.46 2.85 ±0.76 OB High glucose,high fat and high protein 416.3 ±14.8* 9.54 ±2.10 19.10 ±4.86** 6.38 ±2.01*
2 实时荧光定量PCR检测大鼠海马内TNF-α、APP、PPARγ及IDE的mRNA表达水平
图1显示,OB组大鼠海马内APP和TNF-α mRNA水平较CTL组升高,PPARγ和IDE mRNA表达下降。

Figure 1.Expression of TNF - α,APP,PPARγ and IDE mRNA in rat hippocampi analyzed by real-time fluorescence quantitative PCR.CTL:control group;OB:obesity group..n=10.*P<0.05,**P<0.01 vs CTL.图1 实时荧光定量PCR检测大鼠海马内的APP、TNF-α、PPARγ及IDE mRNA表达水平
3 运用免疫印迹检测两组大鼠海马内TNF-α、Aβ42、PPARγ和 IDE 水平
图2显示,与CTL组比较,OB组海马内TNF-α及Aβ42表达明显上调(P<0.05),PPARγ及 IDE表达下调(P<0.05)。
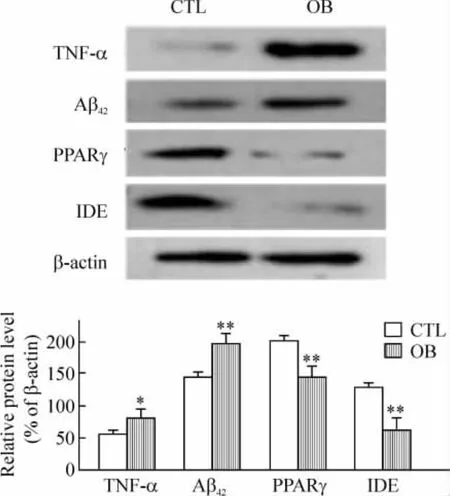
Figure 2.Western blotting analysis of TNF - α,Aβ42,PPARγ and IDE in rat hippocampi.CTL:control group;OB:obesity group..n=10.*P<0.05,**P<0.01 vs CTL.图2 免疫印迹检测大鼠海马内 TNF-α、Aβ42、PPARγ及IDE水平
4 运用免疫组化技术检测2组大鼠海马内各指标
图3显示OB组较CTL组海马神经细胞内TNF-α和Aβ42表达增加,PPARγ和IDE表达减少。阳性表达镜下观察呈褐色改变。
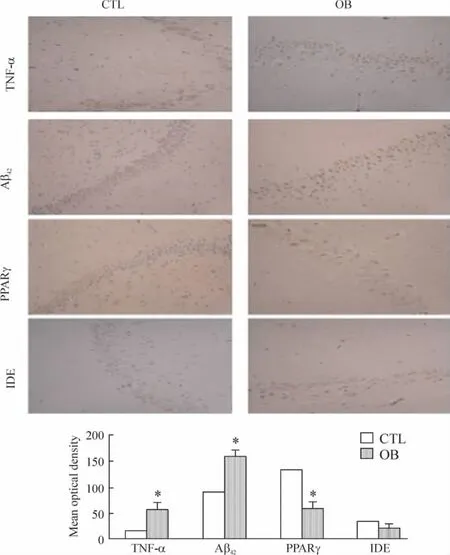
Figure 3.Immunohistochemical staining of TNF-α,Aβ42,PPARγ and IDE in rat hippocampi(×400).CTL:control group;OB:obesity group..n=10.*P<0.05 vs CTL.图3 免疫组化技术检测两组大鼠海马内TNF-α、Aβ42、PPARγ及IDE的表达
讨 论
肥胖常伴有胰岛素抵抗及慢性炎症反应,研究证明后者是导致肥胖胰岛素抵抗的关键原因[12]。肥胖时外周炎症因子水平升高,其中TNF-α是主要的致炎因子,可影响胰岛素受体和胰岛素受体底物1(insulin receptor substrate 1,IRS1)的酪氨酸磷酸化并导致IRS1的泛素化及降解,降低蛋白激酶B(protein kinase B,PKB)的活症导致胰岛素抵抗。研究显示肥胖时海马内Aβ沉积与胰岛素抵抗相关,深入研究证实炎症因子在两者的关系中起到重要作用[2,13-14]。Aβ 沉积是 AD 患者最典型的病理生理改变,正常情况下Aβ的产生和降解是平衡的,当此平衡被打破就会引起Aβ异常沉积,目前认为Aβ清除减少是打破此平衡的关键点[14]。沉积的Aβ可使Tau蛋白磷酸化,两者导致斑块形成、神经原纤维缠积,最终引起 AD 的发生[3-5]。Aβ 由其前体蛋白APP经酶水解生成有病理意义的Aβ40和Aβ42,其中Aβ42易聚集,具有更强的细胞毒性[2,14]。IDE 是一种含锌的金属肽酶,在Aβ42降解中起到重要作用。有研究证实IDE功能缺陷可导致脑中Aβ降解障碍,而IDE过度表达可降低Aβ水平、延迟或完全预防脑中淀粉样斑块的形成[5]。IDE 表达受 PPARγ 调控[10],下调PPARγ可使IDE转录减少,从而水平下降。研究发现外周炎症反应,炎症介质TNF-α刺激可以引起PPARγ下降;另外,已证实PPARγ配体具有抗炎效应[5],激活 PPARγ可减轻炎症反应,炎症因子表达减少。那么,肥胖时Aβ增加,除了因胰岛素水平增加竞争性抑制Aβ与IDE结合降低其降解Aβ的作用外,是否与炎症因子下调PPARγ表达,从而降低IDE基因转录有关呢?
本研究我们检测了肥胖大鼠海马内炎症因子TNF-α mRNA的表达,结果显示肥胖组海马TNF-α mRNA表达较正常组显著上升,这与前人研究结果一致。在此基础上,我们进一步检测大鼠海马内Aβ42及IDE表达,结果显示肥胖组 Aβ42水平上调、IDE下降。IDE作为Aβ42的降解酶,两者呈负相关。在本次实验中,我们还观察到肥胖时大鼠海马内随着TNF-α表达上调,PPARγ表达是下降的,这提示炎症因子TNF-α可能下调PPARγ表达;另外,PCR结果显示肥胖组IDE mRNA水平下降,表明肥胖时IDE转录减少,且此时PPARγ表达亦下降。由上述结果我们可推测,肥胖时脑内Aβ沉积增加的机制可能为:肥胖时机体处于慢性炎症状态,大脑也不例外,其中炎症因子TNF-α表达上调;这使得神经细胞内PPARγ表达减少,IDE表达下调,Aβ42沉积增加。IDE作为降解Aβ42的关键酶,其表达下调可直接致使Aβ42沉积增加。
[1]Hatch EE,Nelson JW,Stahlhut RW,et al.Association of endocrine disruptors and obesity:perspectives from epidemiological studies[J].Int J Androl,2010,33(2):324 -332.
[2]Lee YH,Martin RL,Maple WG,et al.Plasma amyloid -β peptide levels correlate with adipocyte amyloid precursor protein gene expression in obese individuals[J].Neuroendocrinology,2009,90(4):383 -390.
[3]Chouliaras L,Rutten BP,Kenis G,et al.Epigenetic regulation in the pathophysiology of Alzheimer’s disease[J].Prog Neurobiol,2010,90(4):498 -510.
[4]Lesné S,Koh MT,Kotilinek L,et al.A specific amyloid -β protein assembly in the brain impairs memory[J].Nature,2006,440(7802):352 -357.
[5]Crews L,Masliah E.Molecular mechanisms of neurodegeneration in Alzheimer’s disease[J].Hum Mol Genet,2010,19(R1):R12 - R20.
[6]Findeis MA.The role of amyloid β peptide 42 in Alzheimer’s disease[J].Pharmacol Ther,2007,116(2):266 -286.
[7]Craft S.Insulin resistance syndrome and Alzheimer’s disease.Age- and obesity-related effects on memory amyloid and inflammation[J].Neurobiol Aging,2005,26(1):65-69.
[8]Malm T,Koistinaho M,Muona A,et al.The role and therapeutic potential of monocytic cells in Alzheimer’s disease[J].Glia,2010,58(8):889 -900.
[9]Azzu V,Jastroch M,Divakaruni AS,et al.The regulation and turnover of mitochondrial uncoupling proteins[J].Biochim Biophys Acta,2010,1797(6 -7):785 -791.
[10]Espuny -Camacho I,Dominguez D,Merchiers P,et al.Peroxisome proliferator-activated receptor gamma enhances the activity of an insulin degrading enzyme-like metalloprotease for amyloid - β clearance[J].J Alzheimers Dis,2010,20(4):1119-1132.
[11]Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412 -419.
[12]Jiao P,Ma J,Feng B,et al.FFA -induced adipocyte inflammation and insulin resistance:involvement of ER stress and IKKβ pathways[J].Obesity,2011,19(3):483-491.
[13]Monteiro R,Azevedo I.Chronic inflammation in obesity and the metabolic syndrome[J].Mediators Inflamm,2010,2010:289645.
[14]Vassar R.β - Secretase,APP and Aβ in Alzheimer’s disease[J].Subcell Biochem,2005,38:79 -103.
