淫羊藿苷对ConA诱导的小鼠肝脏损伤保护机理的研究①
2012-07-30王恒孝温培娥姜国胜山东省医学科学院基础医学研究所济南250062
王恒孝 任 霞 温培娥 姜国胜 (山东省医学科学院基础医学研究所,济南250062)
肝脏是机体的代谢和解毒器官,近年来研究发现肝脏中含有大量的免疫细胞,其中T淋巴细胞在病毒性和自身免疫性肝炎的发病中发挥着重要作用[1]。刀豆蛋白A(ConA)可引起小鼠肝脏NKT细胞的活化,造成肝脏免疫性损伤[2]。淫羊藿可强肾壮阳扶正固本,具有雄性激素样作用,淫羊藿苷(Icariin)为淫羊藿的提取物,具有免疫调节作用,其次级产物淫羊藿次苷对小鼠脾脏淋巴细胞的增殖具有促进和抑制的双相调节作用[3],另外淫羊藿苷可抑制炎症和肿瘤的增殖发生[4]。本实验利用C57BL/6雄性小鼠建立ConA诱导型肝炎模型,研究观察淫羊藿苷对该损伤模型保护的免疫学机制。
1 材料与方法
1.1 试剂 刀豆蛋白A(ConA)购自Sigma公司,FITC标记抗小鼠NK1.1、Cy标记的CD3抗体购自BDPharmingen公司,转氨酶测定试剂盒购自上海华盛试剂公司,IFN-γ、TNF-α ELISA 检测试剂盒购自R&D公司 。
淫羊藿苷为课题组从淫羊藿中提取获得,纯度99.6%。淫羊藿苷干粉溶于无水乙醇,待乙醇完全挥发后用1640不完全培养液溶解,配成10 mg/ml淫羊藿苷注射液。
1.2 动物 C57BL/6雄性小鼠,20~22周龄,体重28~32克,购自北京维通利华实验动物公司。将实验小鼠随机分为淫羊藿苷+ConA组(淫羊藿苷实验组)、生理盐水+ConA组(ConA对照组)、淫羊藿苷+生理盐水组(淫羊藿苷对照组),每组24只。淫羊藿苷实验组和淫羊藿苷对照组腹腔注射淫羊藿苷注射液,每次200 mg/kg,每日2次,连续5天,ConA对照组同期注射等剂量的生理盐水。淫羊藿苷最后一次注射后12小时,淫羊藿苷实验组和ConA对照组小鼠行尾静脉注射ConA,剂量15μg/g,淫羊藿苷对照组注射同剂量生理盐水。分别于注射ConA 后4、8、16、24、32 小时对小鼠摘眼球放血后脱臼处死,取血清、肝组织,血清-20℃保存,肝组织部分用10%福尔马林固定保存,部分进行淋巴细胞提取。
1.3 实验方法
1.3.1 血清转氨酶水平的测定 取96孔板,每个样品做ALT/AST各三个平行孔和两个空白孔,并做五个标准曲线孔(两组或三组平行),然后按下列步骤操作:每个样品孔加5μl血清样品和25μl谷丙转氨酶基质液/谷草转氨酶基质液,空白孔只加5μl样品,充分混匀,37℃水浴30分钟。每孔加25μl 2,4-二硝基苯肼,充分混匀后空白孔加入25μl ALT基质液,混匀后37℃水浴20分钟。每孔加入0.4 mol/L NaOH 250μl终止反应。酶标仪上490 nm波长测吸光值(A)。
1.3.2 肝脏组织病理学 小鼠肝组织经10%福尔马林液固定后,经脱水、透明和浸蜡包埋,制备石蜡组织切片。切片浸入PBS液中水化后,浸入苏木精液中染色,经0.1%盐酸酒精分色,切片浸入1%的伊红液中复染,后经酒精脱色、二甲苯透明后,中性树脂封固,镜下观察肝组织的变化。
1.3.3 ELISA法测定外周血 TNF-α 和 IFN-γ 选用对抗体强吸附的ELISA微孔反应板,先用包被缓冲液洗涤一次,拍干反应板。按试剂盒说明书将抗体用包被缓冲液稀释到特定浓度,每孔加100μl后加封闭液250μl进行封闭。每孔加稀释的血清样品100μl;标准按说明书要求稀释,每孔加100μl;空白孔仅加样品稀释液。每孔加一抗100μl,室温1小时后,洗涤4次。加酶标二抗100μl,室温1小时后,洗涤5次。每孔加底物100μl,室温放置10~20分钟,至标准孔的颜色达到适当的深度时加终止液100μl终止反应,450 nm测吸光度。
1.3.4 肝脏淋巴细胞的分离及FACS分析
1.3.4.1 肝脏淋巴细胞的分离 参照我们以前分离肝脏淋巴细胞的方法[5],主要为:小鼠摘眼球放血后脱臼处死,摘取肝脏。剪碎肝脏组织,用筛网研磨过滤,用Percoll淋巴细胞分离液提取分离肝脏淋巴细胞。
1.3.4.2 分离得到的小鼠肝脏淋巴细胞,用新鲜大鼠血清进行封闭,后加入FITC标记的NK1.1抗体和Cy标记的CD3抗体,避光染色后用流式细胞仪检测。
1.4 数据统计分析 对照组与各实验组均采用t检验分析,P<0.05为有显著意义。
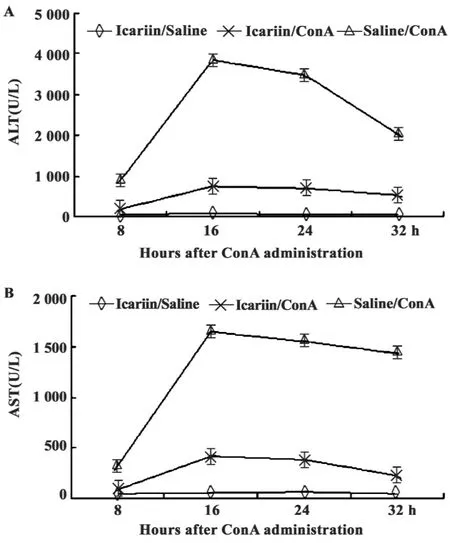
图1 淫羊藿苷对ConA所致肝脏损伤小鼠血清中ALT和AST的影响变化Fig.1 Effects of Icariin on the serum levels of ALT and AST in mice injected with ConA
2 结果
2.1 淫羊藿苷对小鼠外周血ALT和AST水平的影响 ALT和AST是肝细胞中两种重要的酶,ConA可引起小鼠肝脏损伤,及外周血中ALT和AST水平升高。图1为淫羊藿苷实验组、ConA对照组和淫羊藿苷对照组小鼠注射ConA后8、16、24、32小时外周血中ALT和AST动态变化。结果显示,淫羊藿苷可明显降低由ConA引起的小鼠血清中ALT和AST水平。
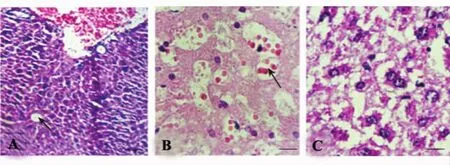
图2 肝组织H&E染色观察淫羊藿苷对ConA引起的小鼠肝脏损伤的保护作用(×400)Fig.2 Effect of Icariin protected ConA-induced liver damage in mice by hematoxylin/eosin method(×400)
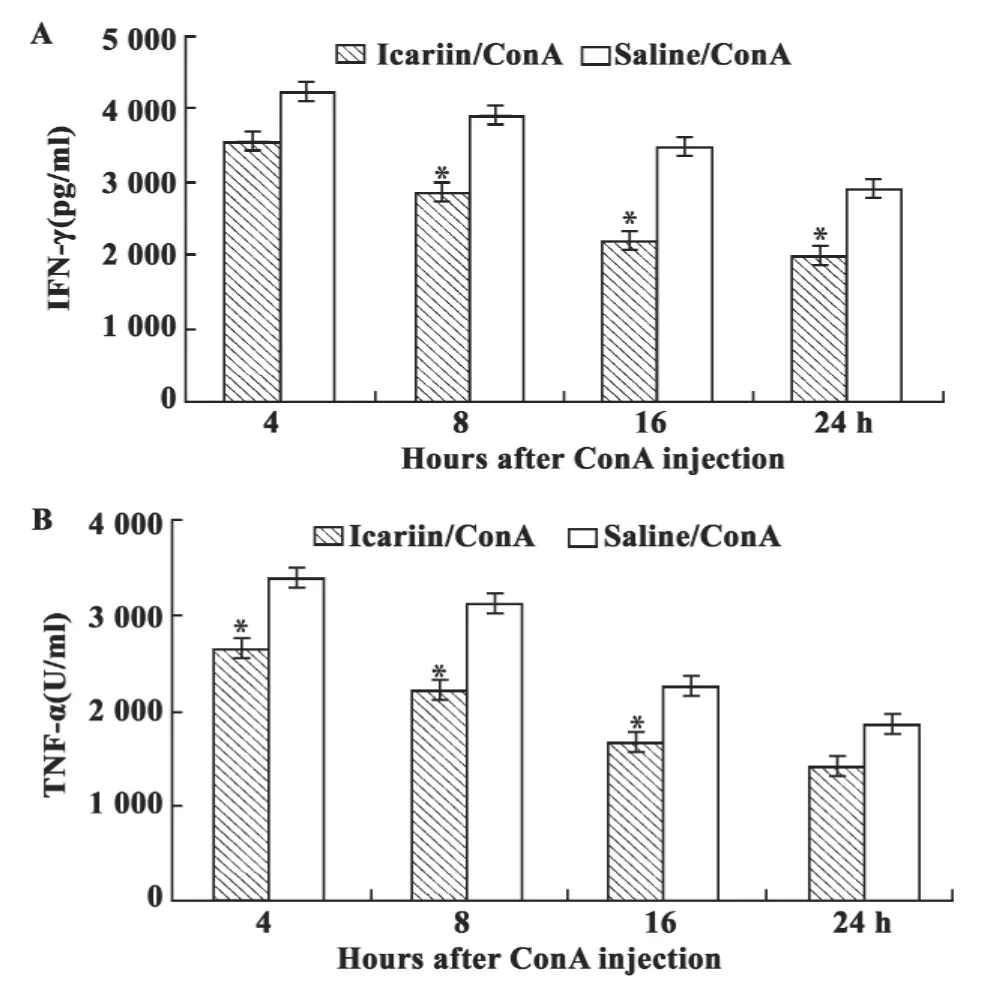
图3 ELISA法检测小鼠注射ConA后外周血中IFN-γ和TNF-α的表达变化Fig.3 The changes of IFN-γ and TNF-α level in the serum of mice treated with Icariin prior ConA or ConA alone detected by ELISA
2.2 淫羊藿苷对ConA所致小鼠肝脏病理损伤保护作用 淫羊藿苷对照组可见肝小叶、肝细胞索和肝窦排列规则清晰,细胞核仁大而圆,分布均匀(图2A)。ConA对照组肝脏血管内皮有淋巴细胞和红细胞浸润,肝细胞和内皮细胞充满气泡,肝细胞核固缩,部分核膜破裂,肝组织有灶性和碎片样坏死,其中12~16小时期间肝脏损伤最严重,呈现肝组织大片坏死(图2B);淫羊藿苷实验组小鼠肝组织有少量淋巴细胞和红细胞浸润,肝细胞核完整,未见有肝组织坏死区域(图2C),提示淫羊藿苷提前干预可明显减轻由ConA引起的肝脏损伤。
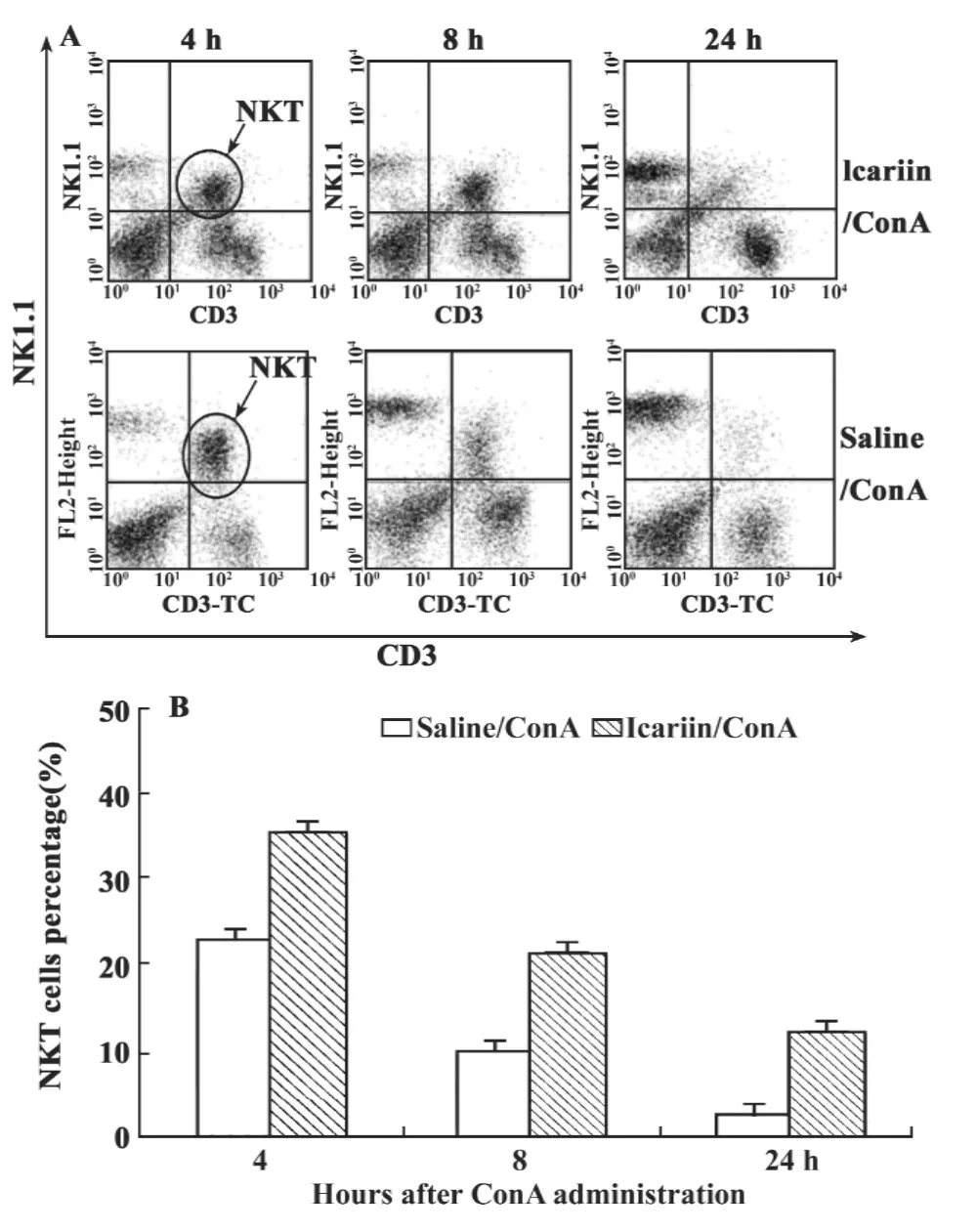
图4 小鼠注射ConA后肝脏淋巴细胞的变化趋势Fig.4 Changes of liver NKT cells in different time after the mice administration with ConA
2.3 淫羊藿苷对肝脏损伤小鼠TNF-α和IFN-γ的影响 ConA可引起小鼠肝脏NKT细胞活化,分泌IFN-γ、TNF-α/β、IL-1、IL-2、IL-4 等细胞因子,诱导肝细胞坏死。图3为ELISA酶联试剂盒检测的淫羊藿苷对ConA诱导的肝损伤小鼠外周血中IFN-γ和TNF-α含量影响变化。结果显示:淫羊藿苷实验组小鼠外周血中IFN-γ和TNF-α含量低于ConA对照组=3 ~5,P <0.05。
2.4 淫羊藿苷对肝脏淋巴细胞活化影响的研究 NKT细胞为ConA诱导肝脏损伤的靶细胞,ConA小鼠尾静脉注射给药后,引起肝脏淋巴细胞活化及T细胞亚群汇聚并浸润肝脏造成损伤。本实验利用FACS技术观察淫羊藿苷对小鼠注射ConA后肝脏NKT、NK、CD3+T细胞的变化。图4显示,淫羊藿苷实验组小鼠和ConA对照组小鼠在不同时间点肝脏淋巴细胞的变化趋势。
3 讨论
肝脏是机体的代谢和解毒器官,同时肝脏还具有内分泌和免疫调节功能。肝脏是胸腺以外T细胞分化的重要场所,可参与机体的局部或整体水平的免疫调节。研究表明肝脏中含有大量的NK、NKT和γδT天然免疫细胞,其中NK细胞的含量占肝脏总淋巴细胞50%以上,NKT和γδT细胞超过外周血的含量,因此有专家提出肝脏可能是机体最大的专职天然免疫功能的器官[2]。病毒最易侵袭肝脏,肝脏T淋巴细胞是病毒侵袭肝脏的靶细胞,T淋巴细胞在病毒性和自身免疫性肝炎的发病中发挥着重要作用[6]。肝脏的损伤涉及肝细胞的死亡和再生,而肝细胞的生死又直接受到肝组织中其它非肝细胞尤其是免疫细胞的影响。自1992年Tiegs等[2]用ConA建立小鼠免疫性肝损伤模型以来,人们还发现其它免疫介质(LPS、Poly I:C)等也可引起小鼠肝脏免疫性损伤[7],这些肝损伤与人体病毒性肝炎免疫致病机理相类似,众多学者借助该类模型来研究肝病的发病机理和开发治疗肝炎的有效药物。ConA可引起小鼠肝脏 NKT细胞活化,分泌 IFN-γ、TNF-α/β、IL-1、IL-2、IL-4 等细胞因子,并招募其它脏器 T细胞亚群浸润肝脏,导致肝脏炎症损伤,同时由于肝脏的生理结构及免疫介质的作用也易导致肝脏产生ConA 的免疫耐受[8]。
Takamoto等[9]在比较研究ConA对雄性和雌性小鼠的损伤时发现雄性激素可使感染小鼠血浆中ALT和AST水平明显低于雌性激素组。淫羊藿可强肾壮阳、扶正固本,具有雄性激素样作用,淫羊藿苷为淫羊藿的提取物,可下调cGMP系统和上调cAMP系统,使cAMP/cGMP的比值升高,已证明淫羊藿苷的次级产物淫羊藿次苷可促进小鼠脾脏淋巴细胞的增殖,而其一定剂量又可抑制淋巴细胞的增殖,具有双相免疫调节作用[3]。本研究用淫羊藿苷对小鼠进行干预,随后注射ConA,观察淫羊藿苷对小鼠肝脏损伤的保护作用,结果发现淫羊藿苷干预后小鼠血浆中ALT和AST水平明显低于未进行干预的小鼠的水平。肝脏组织HE染色结果显示ConA对照组小鼠肝脏血管内皮有淋巴细胞浸润,肝细胞和内皮细胞充满气泡,肝组织有灶性和碎片样坏死,而淫羊藿苷干预实验组小鼠肝组织仅有少量淋巴细胞浸润,但肝细胞核完整,未见肝组织坏死。经进一步检测淫羊藿苷实验组及ConA对照组小鼠外周血中IFN-γ和TNF-α含量,发现淫羊藿苷干预组小鼠外周血IFN-γ和TNF-α含量明显低于ConA对照组。对小鼠注射ConA后肝脏中NKT、NK、T细胞亚群在不同时间点进行动态分析发现,淫羊藿苷干预实验组小鼠肝脏中NKT细胞的比率在多个时间点均低于ConA对照组小鼠的比率。
综上所述,淫羊藿苷对ConA引起的小鼠肝损伤具有明显的保护作用,其作用机理可能与延缓由ConA引起的肝脏NKT细胞活化及降低外周血中IFN-γ和TNF-α水平有关。
1 Norris S,Collins C,Doherty D G et al.Resident human hepatitis lymphocytes are phenotypically different from circulating lymphocytes[J].J Hepatol,1998;28(1):84-96.
2 Tiegs G,Hentschel J,Wendel A.A T cell-dependent experimental liver injury in mice inducible by concanavalin A [J].J Clin Invest,1992;90(1):196-203.
3 程 坚,张新民,陈伟华et al.淫羊藿次苷Ⅱ对小鼠脾淋巴细胞体外增殖的影响及其机制研究[J].中国免疫学杂志,2012;28(4):323-327.
4 Zhou J,Wu J,Chen X et al.Icariin and its derivative,ICT,exert anti-inflammatory,anti-tumor effects,and modulate myeloid derived suppressive cells(MDSCs)functions [J].Int Immunopharmacol,2011;11(7):890-898.
5 Feng C,Wang H,Yao C et al.Diammonium glycyrrhizinate,a component of traditional Chinese medicine Gan-Cao,prevents murine T-cell-mediated fulminant hepatitis in IL-10-and IL-6-dependent manners[J].Int Immunopharmacol,2007;7(10):1292-1298.
6 Emoto M,Kaufmann SH.Liver NKT cells:an account of heterogeneity[J].Trends Immunol,2003;24(7):364-369.
7 Dong Z,Wei H,Sun R et al.Involvement of natural killer cells in PolyI:C-induced liver injury [J].J Hepatol,2004;41(6):966-973.
8 Erhardt A,Tiegs G.Tolerance induction in response to liver inflammation [J].Dig Dis,2010;28(1):86-92.
9 Takamoto S,Nakamura K,Yoneda M et al.Gender-related differences in concanavalin A-induced liver injury and cytokine production in mice[J].Hepatol Res,2003;27(3):221-229.
