供体应用钙调磷酸酶抑制剂预处理减少大鼠肾移植缺血再灌注损伤及机制
2012-07-30王祥慧周佩军
唐 建 徐 达 王祥慧 周佩军
上海交通大学医学院附属瑞金医院移植中心,上海 200025
缺血再灌注损伤在肾移植领域是无法避免的事件。这一事件使得移植物抗原暴露,增加了移植物免疫原性。对移植肾的影响一方面增加早期移植肾功能延迟恢复及排斥反应的发生率,另一方面也与移植肾长期预后相关[1]。因此,积极寻找某种策略来减少移植过程中缺血再灌注损伤的发生就显得尤为重要。较缺血性预处理相比,药物性预处理具有无创、对机体损伤小的优势,其应用潜力巨大。因此,笔者设计本实验,初步探讨供体应用钙调磷酸酶抑制剂(CNIs)类药物预处理对肾移植缺血再灌注损伤的影响及其机制。
1 材料与方法
1.1 试剂与仪器
大鼠 TNF-a ELISA 试剂盒(R&D systems,美国);大鼠HSP-70 ELISA 试剂盒(R&D systems,美国);酶标仪(Labsystems Multiskan MS,芬兰);自动生化分析仪(Hitachi 7000,日本);组织匀浆器(Pro Scientific,美国);环孢素 A(Novartis Pharma GmbH,德国);他克莫司(Astellas,日本)。
1.2 实验动物及分组
雄性Lewis近交系大鼠,体重220~280 g,不限饮食。按供受体随机分为3组:环孢素A组(CsA,10 mg/kg)、他克莫司组(Tac,1 mg/kg)、生理盐水对照组,每组8对大鼠。另设单肾切除组(n=8)作为空白对照。肾移植24 h前各组中供体作如下预处理(表1)。
1.3 供体手术
进腹后,首先游离左输尿管及膀胱,结扎并切断生殖静脉和左肾上腺静脉,完全游离左肾。左输尿管保留少许膀胱壁(直径约4 mm)切断。结扎肠系膜上动静脉并切断,向上游离主动脉及腔静脉至1.5 cm处。在肾血管以下0.3 cm处以3-0丝线穿过主动脉及腔静脉留置备用。头皮针从上方穿刺入主动脉,结扎备用线,切断上方腔静脉作为流出道,以4℃肾保存液及肝素钠灌注左肾。待左肾颜色变苍白一致时,取出左肾修整备用。

表1 肾移植24 h前各组中供的体预处理
1.4 受体肾移植
分别游离肾血管平面以下的腹主动脉与腔静脉,长度约2.0 cm,阻断血流后,用9-0缝线将供肾所带的主动脉与受体腹主动脉作端侧吻合,此时通过尾静脉补液8 mL。然后用8-0缝线将供肾所带的腔静脉与受体的腔静脉作端侧吻合。开放血管移植肾在10 s内颜色迅速变红。用8-0缝线将输尿管吻合于受体膀胱上。切除受体双肾。手术结束后,送入温室内饲养。
1.5 观察指标
肾移植后第3天处死大鼠,取血液标本和移植肾标本进行检测分析。
1.5.1 血清肌酐的检测 将大鼠血浆标本10 000 g离心20 min后取上层血清,使用自动生化分析仪测定肌酐值。
1.5.2 移植肾组织中肿瘤坏死因子α(TNF-α)及热休克蛋白70(HSP-70)水平的检测 将移植肾标本称重,加入适量液氮,置于陶瓷研钵研磨成蛋白粉末后,移入匀浆器。按质量体积比1∶5加入磷酸缓冲液及裂解液,4℃下3000r/min匀浆20次,转移至离心管内,离心30 min后,小心吸取上清液作为待测样品。采用双抗体夹心ELISA法测定上清液中TNF-α及HSP-70浓度。具体操作分别按照试剂盒提供的说明书进行,每个样本和标准品均设2个复孔,酶标仪450 nm处测定OD值。根据OD值和工作曲线计算样本TNF-α及HSP-70的浓度。
1.5.3 移植肾组织病理学观测 移植肾标本制成厚4 μm切片,经HE染色后,置于200倍光镜下观察,每张切片观察20个不同的视野,肾组织病理学改变严重程度的判定标准为0~3分的评分。评分规则采用Jablonski损伤评分标准[2]。
1.6 统计学方法
采用SPSS 16.0统计软件处理数据,计量资料以均数±标准差()表示,多组间的比较采用方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 钙调磷酸酶抑制剂对供体预处理后大鼠血清肌酐的影响
与对照组相比,环孢素组[(115.12±25)μmol/L]及他克莫司组[(110.62±24)μmol/L]血清肌酐水平均明显小于对照组[(186.25±21)μmol/L],但高于单肾切除组[(48.25±6)μmol/L],差异有统计学意义(P=0.001),但环孢素组与他克莫司组差异无统计学意义(P=0.719)。
2.2 移植肾组织中TNF-α的变化
肾移植术后第 3 天,环孢素组[(574.25±75)ng/L]及他克莫司组[(567.75±66)ng/L]移植肾组织中 TNF-α水平显著低于对照组[(880.75±112)ng/L],差异有统计学意义(P=0.001 5);但环孢素组与他克莫司组相比差异无统计学意义(P=0.856)。
2.3 移植肾组织中HSP-70的变化
移植第 3 天,环孢素组[(217.62±23)ng/L]及他克莫司组[(219.75±37)ng/L]大鼠移植肾组织中 HSP-70 水平高于对照组[(181.88±26)ng/L],差异具有统计学意义(P=0.011);但环孢素组与他克莫司组相比差异无统计学意义(P=0.892)。
2.4 移植肾组织病理检查
可见对照组肾小管细胞凋亡坏死,萎缩,肾小球肾小管结构紊乱,见图1。实验组(环孢素A组、他克莫司组)上述病理改变相对较轻。移植肾组织学评分结果:单肾切除组(0.23±0.14)分,对照组(2.35±0.23)分,环孢素 A 组(1.48±0.24)分,他克莫司组(1.59±0.22)分。
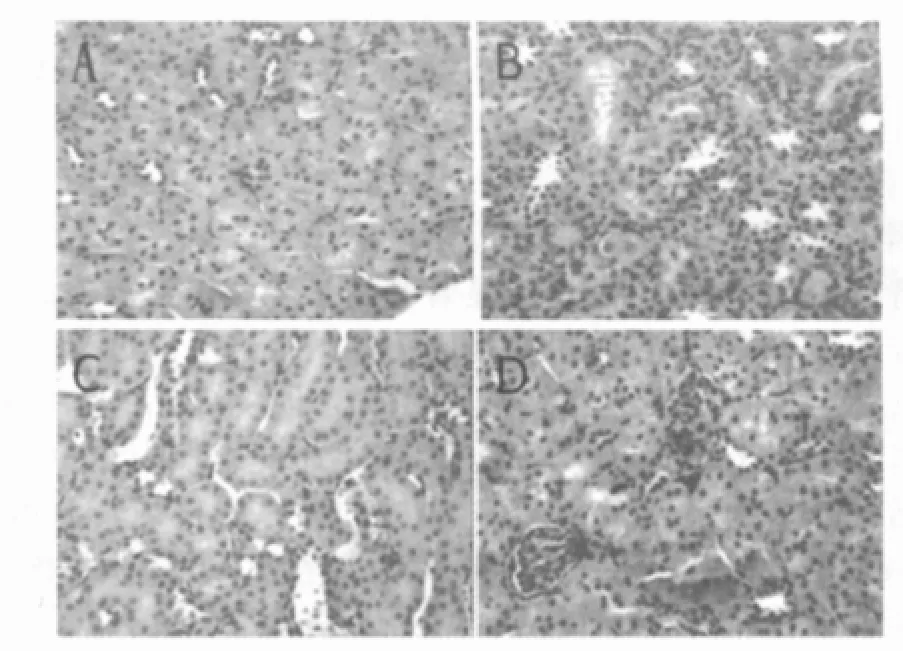
图1 各组移植肾病理切片(HE染色,200倍)
3 讨论
3.1 供体预处理减轻缺血再灌注损伤及意义
缺血性预处理[3]作为一种提高器官对缺血再灌注损伤的耐受性的有效手段,目前已在很多研究中得到证实,但在肾移植领域却还未有应用于临床的报道,因为缺血性预处理是一种有创性的方法,实施过程中不可避免遇到伦理学方面的障碍以及安全性问题,此外,缺血性与处理相关研究尚未能给出最佳的预处理时间。笔者的实验采用了一种不同于缺血性预处理的方法,即药物性预处理。相对于缺血性预处理,药物性预处理具有无创,对机体损伤小的特点,方法简单有效,特别是对活体供者具有广泛的应用前景。笔者的研究证实了在取肾术前24 h供体应用CNIs预处理能够有效提高对缺血的耐受性,这与Shihab等[4]的研究结果相一致。需要指出的是,Shihab等的研究在使用F334大鼠肾移植模型中观察到供体术前24 h或7 d分别使用环孢素或他克莫司预处后,受体在术后第3天血清肌酐水平、菊粉清除率及移植肾组织学评分均有明显改善。这说明该类药物预处理至少有长达7 d的肾脏保护作用。由于笔者受到动物实验条件的限制,所以只研究了24 h前的预处理。研究显示了供体应用CNIs类药物具有缺血状态下的肾脏保护作用,这对临床上活体肾移植具有很好的借鉴作用。在目前临床上活体肾移植比例日益增多的背景下,具有十分重要的意义。
关于缺血再灌注损伤保护作用的研究,目前都是建立在非移植模型条件下,无法排除在肾移植过程中复杂的免疫环境及血流动力学不稳定状态所带来的干扰和偏倚。所以笔者选择了在肾移植模型下术前对供体使用药物进行预处理,这更接近临床肾移植过程。而使用Lewis近交系大鼠,最大限度降低了排斥反应对实验结果的干扰。我们之所以选择供体作为预处理对象而不选择受体是因为供体预处理之后能够在缺血保存期内提供对肾脏的保护作用,而把受体作为预处理对象时显然不能在供肾缺血保存期发挥作用。本研究在国内首次利用大鼠肾移植模型研究了供体药物性预处理对于接下来的肾移植过程中缺血再灌注的影响。对于如何减少肾移植过程中缺血再灌注损伤,提出了一种从供体角度入手的新思路。
3.2 供体应用CNIs药物预处理机制探讨
目前对于CNIs供体预处理机制尚不十分清楚。现有的研究表明,炎症反应在缺血再灌注损伤中起非常重要的作用,再灌注过程中,许多炎症因子如TNF-α、白细胞介素、趋化因子等释放引起细胞损伤及凋亡。笔者的研究证实,在大鼠肾移植过程中,TNF-α的显著升高是造成移植肾缺血再灌注损伤的重要原因。这可能是因为在缺血再灌注过程中钙调磷酸酶(calcineurin,CN)因钙超载而大量激活,活化后的CN可以使核因子-AT(NF-AT)去磷酸化而向胞核内转位,从而激活包括核因子-κB(NF-κB)在内的一系列核内转录因子,NF-κB是参与免疫与炎症反应的重要转录因子,在胞核内参与调节多种基因转录,包括TNF-α、白介素2(IL-2)等参与炎症反应。新近的研究[5]还发现,CN激活后的NF-AT进入胞核后,也可直接上调TNF-α的表达,所有上述依赖CN的过程都可以被CNIs抑制。笔者预先对供体使用CNIs后,观察到环孢素A组以及他克莫司组移植肾组织内TNF-α水平比生理盐水对照组降低,说明在一定程度上CNIs预处理抑制了TNF-α的升高。这也与上述文献结果相一致。此外,研究还发现该类药物能够抑制CN影响的NF-AT及p38 MAPK信号通路[6],从而减少TNF-a的表达。因此,笔者认为,在肾移植供体预处理时,使用CNIs能够减少移植肾缺血再灌注时TNF-α等炎症因子的表达,从而减少缺血再灌注损伤的程度。
热休克蛋白家族(HSP)在细胞缺氧及应激状态下的高表达,被认为是细胞抗凋亡作用的重要机制。特别是HSP-70对氧化应激、电离射线、TNF-α等引起的细胞凋亡具有保护作用,其作用机制与HSP抑制应激激活蛋白激酶,抑制细胞凋亡基因p53和Bax的表达,抑制凋亡信号转导中的蛋白水解酶和抑制氧自由基生成,以及对细胞线粒体功能的保护作用有关[7]。笔者的研究结果表明,CNIs预处理之后可以在移植肾组织内观察到HSP-70的表达水平增加。这可能使缺血再灌注发生时细胞保护作用得到加强。至于CNIs预处理引起HSP-70表达升高的机制目前还不十分清楚,尚待进一步研究。
虽然实验结果显示TNF-α和HSP-70的表达变化是CNIs供体预处理减少肾移植缺血再灌注损伤的重要原因,但从目前的研究看来,参与缺血再灌注损伤的机制远非上述两种,因为缺血再灌注过程中各种损伤与抗损伤机制互相影响,其调控网络非常复杂,诸多关键因子仍未完全确定。目前,HSP-70作为一种抗凋亡蛋白,其减少缺血再灌注损伤的作用受到较多关注,但远非唯一的保护机制。其他诸如HIFs积聚效应[8]、血红素加氧酶系统[9]、Fas及其配体、Caspases-1和Caspases-3等信号分子均有可能参与其中[10]。因此,钙调磷酸酶抑制剂供体预处理显示的肾脏保护作用,其详细机制仍需进一步研究。
[1]Troppman C,Gillingham KJ,Benedetti E,et al.Delayed graft function,acute rejection,and outcome after cadaver renal transplantation:A multivariate analysis[J].Transplantation,1995,59: 962.
[2]Gardner MP,Houghton DC,Andoh TF,et al.Clinically relevant doses and blood levels produce experimental cyclosporine nephrotoxicity when combined with nitric oxide inhibition [J].Transplantation,1996,61:1506.
[3]Joan Torras Ambros,Immaculada HF,OG Borau,et al.Ischemic preconditioning in solid organ transplantation:from experimental to clinics[J].Transplant International,2007,219:229.
[4]Fuad S Shihab,William M Bennett,Takeshi F Andoh.Donor preconditioning with a calcineurin inhibitor improves outcome in rat syngeneic kidney transplantation[J].Transplantation,2009,87(3):326-329.
[5]Lawrence MC,Naziruddin B,Levy MF,et al.Calcineurin/NFAT and MAP kinase signaling induce TNF-alpha gene expression in pancreatic islet endocrine cells[J].J Biol Chem,2011,286(2):1025-1036.
[6]Lim HW,New L,Han J,et al.Calcineurin Enhances MAPK Phosphatase-1 Expression and p38 MAPK Inactivation in Cardiac Myocytes[J].JBiol Chem,2001,276(19):15913-15919.
[7]Polla BS,Kantengwa S,Francois D,et al.Mitochondria are selective targets for the protective effects of heat shock against oxidative injury[J].Proc Natl Acad Sci USA 1996;93:6458.
[8]Tormos KV,Chandel NS.Inter-connection between mitochondria and HIFs[J].J Cell Mol Med,2010,14(4):795-804.
[9]Woude FJ,Schnuelle P,Yard BA.Preconditioning strategies to limit graft immunogenicity and cold ischemic organ injury[J].J Investig Med,2004,52(5):323-329.
[10]Yang CW,Ahn HJ,Han HJ,et al.Pharmacological preconditioning with low-dose cyclosporine or FK506 reduces subsequent ischemia/reperfusion injury in rat kidney[J].Transplantation,2001,72:1753.
