离子液体双水相中铜离子与牛血红蛋白相互作用的研究
2012-07-27王玉锋邓凡政
王玉锋,邓凡政
(淮北师范大学化学与材料科学学院,安徽 淮北 235000)
众所周知,蛋白质是生命的物质基础。血红蛋白是动物及人体内执行输氧任务的蛋白质,是生命机体进行各种生理活动的主要承担者。铜是人体和动物组织中必需的微量元素,主要功能是参与氧化还原反应,生物分子中的铜与分子氧直接反应产生自由基[1]。蛋白质某些功能的丧失、激活和维持往往与金属离子有着密切的关系。离子液体双水相体系能够为生物活性分子提供相对温和的环境而不易使其失活[2]。
作者在此以Cu(Ⅱ)和牛血红蛋白(BHb)为研究对象,探讨了两者在亲水性离子液体1-丁基-3-甲基溴代咪唑([Bmim]Br)和NaH2PO4·2H2O形成的双水相体系中的相互作用,为生物化学、药物化学等领域的研究提供理论和应用信息。
1 实验
1.1 试剂与仪器
1×10-5mol·L-1BHb溶液,4 ℃保存;1×10-2mol·L-1Cu(Ⅱ)溶液;离子液体[Bmim]Br参照文献[3]制备;pH值为7.40的Britton-Robinson(B-R)缓冲溶液,常规方法配制;固体NaH2PO4·2H2O。所用试剂均为分析纯;实验用水为超纯水。
FP-6500型荧光分光光度计,日本分光株式会社;UV-3600型紫外可见近红外分光光度计,日本岛津公司;PHS-3D型酸度计,上海虹益仪器仪表有限公司;XW-80A型漩涡混合器,江苏海门麒麟医用仪器厂;超纯水系统,上海和泰仪器有限公司;HH-4型数显恒温水浴锅,国华电器有限公司。
1.2 方法
在10 mL刻度比色管中加入1.00 mL缓冲溶液、1.00 mLBHb溶液、不同量的Cu(Ⅱ)溶液和1.50 mL离子液体[Bmim]Br,加水定容至5 mL,再加入2.50 g固体NaH2PO4·2H2O,混匀,在一定温度下作用15 min后,取上相于另一比色管中稀释到所需刻度。
以水作参比,用1 cm比色皿测定紫外可见吸收光谱;在激发波长为282 nm、发射与激发狭缝宽度均为10 nm、扫描速率为1000 nm·min-1的条件下测定荧光光谱。
2 结果与讨论
2.1 Cu(Ⅱ)与 BHb作用的荧光猝灭光谱(图1)

cBHb=1.25×10-6mol·L-1 1~9,cCu(Ⅱ)(×10-4mol·L-1 ):0,1.25,2.50,3.75,6.25,7.50,8.75,10.00,11.25
由图1可看出,BHb在290~530 nm范围内有2个发射峰,339 nm为色氨酸和酪氨酸残基的荧光峰,432 nm可能是类似原卟啉和BSA的荧光峰,反映了卟啉和结合蛋白分子的某种独特的相互作用[4]。随着Cu(Ⅱ)的加入,2个荧光发射峰的波长变化不大,但蛋白质的内源荧光强度有规律地降低,说明两者之间存在着相互作用,发生了荧光猝灭及能量转移。
荧光猝灭过程通常分为动态猝灭和静态猝灭。动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用引起的,可以用Stern-Volmer方程来描述[5]:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中:F、F0为有、无猝灭剂时BHb的荧光强度;[Q]为猝灭剂Cu(Ⅱ)的浓度;Kq为双分子猝灭速率常数;τ0为无猝灭剂时荧光分子的平均寿命,生物大分子的荧光平均寿命约为10-8s;KSV为Stern-Volmer猝灭常数。
不同温度下,Cu(Ⅱ)与BHb的Stern-Volmer曲线如图2所示。
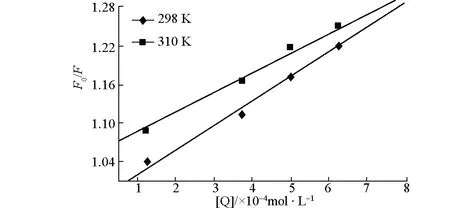
图2 Cu(Ⅱ)与BHb的Stern-Volmer曲线
由图2直线的斜率及截距求出不同温度下作用的KSV等数据见表1。
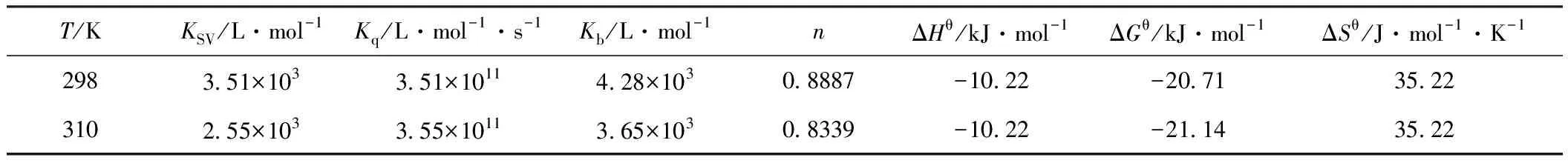
表1 Cu(Ⅱ)与BHb作用的结合常数和热力学参数
由表1可知,Kq值大于动态猝灭的Kq值2.0×1010L·mol-1·s-1[6],且KSV随着温度的升高有所降低,由此判断Cu(Ⅱ)与BHb的荧光猝灭作用不是由扩散和碰撞引起的动态猝灭,而是Cu(Ⅱ)与BHb形成了基态复合物、对BHb内源荧光的猝灭过程,应为静态猝灭。
2.2 Cu(Ⅱ)与 BHb作用的结合常数、结合位点数及结合力类型
对于静态猝灭,蛋白质等荧光体与猝灭剂分子之间的相互作用可用Lineweaver-Burk 双倒数方程进行描述[7]:
lg[(F0-F)/F]=lgKb+nlg[Q]
(2)
绘制lg[(F0-F)/F]~lg[Q]曲线图,并由图计算结合常数Kb、结合位点数n,结果见表1。
由表1可知,温度升高,结合常数和结合位点数均减小,298 K和310 K下的结合常数分别为4.28×103L·mol-1和3.65×103L·mol-1、结合位点数分别为0.8887和0.8339,说明生成的复合物的稳定性随温度的升高而降低,进一步证明Cu(Ⅱ)与BHb的作用是形成复合物的静态猝灭过程。
当温度变化不大时,结合反应的焓变ΔHθ可看成一个常数,根据下列热力学公式求得结合反应的标准吉布斯自由能变ΔGθ、焓变ΔHθ和熵变ΔSθ,见表1。
(3)
ΔGθ=-RTlnK
(4)
ΔGθ=ΔHθ-TΔSθ
(5)
Ross等[8]研究发现通过小分子与生物大分子作用的热力学参数可以简单判断其相互作用力类型:即氢键或范德华力使体系的ΔHθ<0、Sθ<0,疏水作用力使体系的ΔHθ>0、Sθ>0,静电作用力使体系的ΔHθ≈0、ΔSθ>0。由表1中相关数据得出在离子液体双水相中,Cu(Ⅱ)与BHb分子间作用力主要是静电作用力,且是一个放热、熵增的自发过程。
2.3 Cu(Ⅱ)对BHb构象的影响
同步荧光光谱已用于蛋白质构象变化的分析。Δλ=15 nm时仅表现为酪氨酸残基的荧光,Δλ=60 nm时则显示色氨酸残基的荧光[9]。Cu(Ⅱ)对BHb同步荧光的影响如图3所示。

cBHb=1.25×10-6mol·L-1 1~6,cCu(Ⅱ)(×10-4mol·L-1 ):0,1.25,3.75,5.00,6.25,8.75
由图3可知,在实验条件下,酪氨酸和色氨酸残基荧光同时被猝灭,相比之下,色氨酸残基的荧光降低比酪氨酸残基更显著,说明Cu(Ⅱ)与BHb的结合位点更接近色氨酸残基。二者的最大发射波长均未改变,说明Cu(Ⅱ)虽然与BHb发生了作用,但并没有改变蛋白质疏水腔的疏水环境,对蛋白质的构象影响不大[10]。
2.4 Cu(Ⅱ)与 BHb作用的紫外可见吸收光谱(图4)
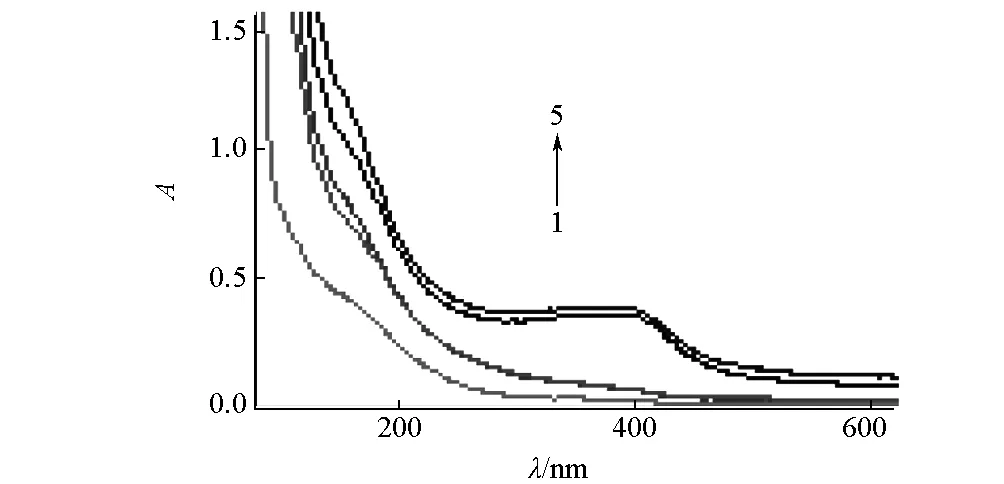
1~5:离子液体下相中BHb,上相中Cu(Ⅱ)、离子液体、BHb、Cu(Ⅱ)与BHb
由图4可知,在406 nm附近出现的吸收峰为Soret带,这是氧合血红蛋白中血红素辅基与氨基酸残基间的π-π*跃迁带[11];在测定波长范围,可以看出BHb几乎完全被萃取到离子液体上相中;在406 nm附近单纯Cu(Ⅱ)和离子液体上相的紫外吸光度均较小,而Cu(Ⅱ)的加入可使BHb的吸光度增大,表现为增色效应,说明在双水相中Cu(Ⅱ)与BHb之间发生了相互作用。
3 结论
运用荧光光谱、紫外可见吸收光谱获得了Cu(Ⅱ)与BHb的作用信息,采用Stern-Volmer方程和双倒数方程对所得数据进行处理。结果表明,Cu(Ⅱ)与BHb产生了荧光猝灭作用,且属于静态猝灭过程;热力学参数表明Cu(Ⅱ)与BHb之间的相互作用力类型为静电作用力;Cu(Ⅱ)与BHb在298 K和310 K下的结合常数分别为4.28×103L·mol-1和3.65×103L·mol-1、结合位点数分别为0.8887和0.8339。同步荧光光谱表明Cu(Ⅱ)虽然与BHb发生了作用,但没有改变蛋白质疏水腔的疏水环境,对蛋白质的构象影响不大。
[1] 刘璐,严玉仙.铜和致癌作用[J].国外医学(医学地理分册),2004,25(1):29-33.
[2] 李志勇,裴渊超,王键吉.离子液体与蛋白质相互作用的荧光光谱研究[J].河南师范大学学报(自然科学版),2010,38(1):100-104.
[3] Cull S G,Holbrey J D,Vargas-Mora V,et al.Room-temperature ionic liquids as replacements for organic solvents in multiphase bioprocess operations[J].Biotechnol Bioeng,2000,69(2):227-233.
[4] 左智颖,薄云红,杨晓达,等.稀土对血红蛋白载氧功能的抑制及与血红蛋白的作用[J].中国稀土学报,1996,14(4):336-340.
[5] 马贵斌,高飞,任斌知,等.荧光法研究药物分子与人血清白蛋白的结合作用[J].化学学报,1995,53(12):1193-1197.
[6] 陈国珍,黄贤智,郑朱梓,等.荧光分析法(第二版)[M].北京:科学出版社,1990:231.
[7] 杨曼曼,杨频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35.
[8] Ross P D,Subramanian S.Thermodynamic of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[9] Wang Y Q,Zhang H M,Zhang G C,et al.Binding of brucine to human serum albumin[J].Journal of Molecular Structure,2006,830(1-3):40-45.
[10] 常希俊,黄艳,贺群.铱(Ⅳ)离子与人血丙种球蛋白的作用研究[J].化学学报,2005,63(3):223-228.
[11] Zhu Y C,Cheng G J,Dong S J.Structural electrochemical study of hemoglobin by in situ circular dichroism thin layer spectroelectrochemistry[J].Biophys Chem,2002,97(2-3):129-138.
