黄芪总黄酮对大鼠原代成骨细胞的影响及其机制研究
2012-07-27孔祥鹤牛银波武祥龙翟远坤潘亚磊李晨睿梅其炳
孔祥鹤,牛银波,武祥龙,翟远坤,潘亚磊,李晨睿,梅其炳,2
(1.西北工业大学生命学院,陕西 西安 710072;2.第四军医大学药理教研室,陕西 西安 710032)
随着人口老龄化加剧,骨质疏松症(OP)作为老年人的骨代谢障碍性疾病,发病率高,易引发骨折,引起国内外学者的普遍关注。人们积极寻找疗效确切、副作用小、作用机理明确的抗OP药物。根据成骨细胞在骨形成中的作用,通过判断药物是否能够促进成骨细胞的成骨活性,是开发OP治疗药物的重要手段之一[1]。
中医认为黄芪具有补中益气、升阳固表、托毒敛疮等功效,中医临床常用含有黄芪的方剂、黄芪水煎液等防治骨质疏松[2,3]。对黄芪的化学成分和药理作用研究表明,黄芪黄酮、黄芪多糖为黄芪的主要活性成分,其中黄芪多糖能促进成骨细胞的成骨活性[4]。刘心萍等[5]、陈华庭等[6]研究发现黄芪总黄酮能提高维甲酸致骨质疏松大鼠的骨密度,增强抗外力冲击的能力,提示黄芪总黄酮可能是中药黄芪抗骨丢失的有效部位之一。
作者通过观察黄芪总黄酮(Astragalustotal flavonoids,ATF)对大鼠原代成骨细胞增殖、分化及矿化能力的影响,进一步寻找黄芪抗OP的有效部位;同时观察其是否影响成骨细胞成骨活性相关的骨形成蛋白(BMP-2)、核心结合因子(Runx-2)的表达,以探讨黄芪抗OP的作用机制,为深入研究中药黄芪防治OP提供理论依据。
1 实验
1.1 材料、试剂及仪器
新生SPF级SD大鼠[合格证号:SCXK(军) 2007-007],1~3 d龄,购自第四军医大学实验动物中心。
黄芪总黄酮(80%),西安恒堡生物科技有限公司;DMEM高糖培养基,美国Hyclone公司;胎牛血清,四季青生物制剂公司;雌二醇(E2)、胰蛋白酶、Ⅰ型胶原酶、EDTA、二甲基亚砜、MTT、茜素红、西吡氯铵,美国Sigma公司;ALP试剂盒,南京建成生物工程研究所;骨Ⅰ型胶原、骨钙素ELISA试剂盒,上海蓝基生物科技有限公司;BMP-2 ELISA试剂盒,美国R&D公司;Runx-2、Histone抗体,美国Bio world公司。
电子分析天平,美国Mettler Toledo公司;倒置显微镜,日本Olympus公司;Model 680型酶标仪、PAC300型电泳仪,美国Bio-Rad公司;CO2培养箱,德国Heraeus公司;DU800型分光光度计,美国Beckman公司;培养板,丹麦Nunclon公司;高速冷冻离心机,日本Hitachi公司。
1.2 方法
1.2.1 实验分组
实验分为对照组(Control,10%血清培养液)、阳性对照雌激素组(E2,1×10-9mol·L-1雌激素)及各浓度的ATF组(用10%血清培养液配制)。
1.2.2 大鼠原代成骨细胞的分离培养
采用多次酶消化法从新生SD大鼠颅骨获得原代成骨细胞培养体系。
取4只出生1~2 d的SD大鼠,用75%乙醇溶液浸泡消毒5 min,取颅骨放入PBS缓冲溶液中,去除骨膜及周围结缔组织,见骨质发白、透亮,将骨片浸没于1∶4的胰蛋白酶/Ⅰ型胶原酶液中,剪成3 mm×3 mm大小,在5% CO2培养箱中于37 ℃恒温消化30 min。然后加入1 mg·mL-1的Ⅰ型胶原酶,将骨片剪成约1 mm×1 mm大小,于37 ℃恒温消化40 min。离心,去消化液。用含15%胎牛血清的DMEM培养液重悬细胞后接种于细胞培养瓶中,置于培养箱中30 min后成纤维细胞先贴壁,轻轻吸取含成骨细胞的上清液于另一培养瓶中继续培养。细胞传至第2代时换用含10%胎牛血清的DMEM培养液继续培养。传至第3代后,可使细胞得到纯化,经碱性磷酸酶(ALP)和茜素红染色鉴定获得较纯的成骨细胞。
1.2.3 MTT法检测成骨细胞增殖
取处于对数生长期的第3代成骨细胞,以每孔3×103个细胞的浓度接种于96 孔板,置于37 ℃、5% CO2培养箱中贴壁培养12 h,分组加药(0.001 μg·mL-1、0.01 μg·mL-1、0.1 μg·mL-1、1 μg·mL-1、10 μg·mL-1、100 μg·mL-1),空白对照孔只加培养液,不加细胞,用于调零。将96孔板置于培养箱中继续培养24 h、48 h及72 h,每孔加入MTT(5 g·L-1)20 μL,继续孵育4 h后终止培养,吸弃孔内上清液,每孔加入150 μL DMSO,室温振荡10 min,使结晶物充分溶解,用酶标仪检测570 nm处各孔吸光度(OD)。
1.2.4 碱性磷酸酶(ALP)活性检测成骨细胞分化
首先观察不同浓度ATF对成骨细胞ALP活性的影响:取处于对数生长期的第3代成骨细胞,以每孔2×105个细胞的浓度接种于24孔板中贴壁培养12 h,分组加药(0.001 μg·mL-1、0.01 μg·mL-1、0.1 μg·mL-1、1 μg·mL-1、10 μg·mL-1、100 μg·mL-1),加药6 d后,按照ALP试剂盒说明书进行操作,采用分光光度计测定各组520 nm处吸光度,计算ALP活性(U·mg-1)。
然后观察不同时间点ATF对成骨细胞ALP活性的影响:实验步骤同上,选择上述实验中促进成骨细胞ALP活性的最适给药浓度,分别观察加药2 d、4 d、6 d、8 d后,ATF对成骨细胞ALP活性的影响。
1.2.5 茜素红染色检测成骨细胞矿化
以每孔8×105个细胞的浓度接种于6孔板,贴壁培养12 h后更换含1 μg·mL-1ATF的培养液,并设对照组,在细胞培养箱中每3 d换液1次,连续培养14 d后弃去培养液,PBS清洗3次,用95%乙醇固定1 h,蒸馏水清洗3次,加入40 mmol·L-1茜素红(pH值4.2)染液,于37 ℃孵育15 min,再用蒸馏水清洗3次,在显微镜下观察矿化结节并照相。然后加入100 mmol·L-1西吡氯铵溶液,室温放置1 h,使与钙结合的茜素红充分溶解,用酶标仪于570 nm处测定溶液吸光度,对矿化结节进行量化[7]。
1.2.6 酶联免疫吸附法(ELISA)测定成骨细胞分泌Ⅰ型胶原、骨钙素及BMP-2蛋白的含量
1.2.7 Western blot法检测成骨细胞Runx-2蛋白的表达
首先观察不同时间点ATF对成骨细胞Runx-2表达的影响:取处于对数生长期的第3代成骨细胞,以每孔5×106个细胞的浓度接种于直径为6 cm的无菌培养皿中贴壁培养12 h,ATF给药浓度1 μg·mL-1,分别于0 h、12 h、24 h、48 h后用细胞刮刮下并收集细胞加入RI-PA细胞裂解液(含PMSF蛋白酶抑制剂)提取总蛋白,用酶标仪进行蛋白定量。蛋白变性后进行聚丙烯酰胺凝胶电泳,转膜,将膜浸泡在5%脱脂牛奶中4 ℃封闭过夜,依次加Runx-2、Histone抗体,一抗4 ℃孵育8 h,PBST洗膜后加二抗,室温孵育1 h,用PBST及PBS洗膜后,进行化学发光,对条带进行灰度分析以观察各蛋白表达水平的变化。
然后观察不同浓度ATF对成骨细胞Runx-2表达的影响:分别加入浓度为0.1 μg·mL-1、1 μg·mL-1的ATF,并设对照组,48 h后收集细胞,实验步骤同上。
1.2.8 统计学处理
实验数据采用SPSS 11.0统计软件中的方差分析(ANOVA)进行统计,Western blot条带用Quantity One 4.6.2软件进行灰度值定量分析。
2 结果与讨论
2.1 ATF对原代成骨细胞增殖的影响(图1)

*表示P<0.05 vs Control,**表示P<0.01 vs Control,##表示P<0.01 vs ATF(10 μg·mL-1)
由图1可看出,浓度为1 μg·mL-1、10 μg·mL-1的ATF作用于大鼠原代成骨细胞24 h能显著促进细胞增殖(P<0.01);0.1~10 μg·mL-1的ATF作用48 h后,细胞增殖率显著增强(P<0.01);0.01~10 μg·mL-1的ATF作用72 h后,能显著促进细胞增殖(P<0.05或P<0.01)。ATF浓度为10 μg·mL-1时促增殖作用最强,而ATF浓度为100 μg·mL-1时开始抑制细胞增殖,其48 h的促增殖作用强于24 h;E2组的作用强于对照组(P<0.01),与ATF最适浓度(10 μg·mL-1)组相比,24 h及48 h无显著性差异(P>0.05),在72 h则比ATF组强(P<0.01)。
由于前置胎盘胎盘覆盖于子宫前壁切口位置,传统手术瘢痕可能会影响胎盘移动,最终造成胎盘前置,加之子宫瘢痕内膜过薄,使其绒毛组织侵入到子宫肌层中,使其胎盘植入几率明显提升。在进行本次研究发现,全部患者均符合手术病理标准,患者经过在腹彩超多普勒超声的检查发现,其诊断率为95.5%(85/89),漏诊率4.9%(4/89)。对此,前置胎盘并发胎盘植入临床诊断中,腹彩色超声多普勒具有较高准确率,且呈现无创安全的特点,具备临床推广与使用价值。
2.2 ATF对原代成骨细胞ALP活性的影响(图2)

**表示P<0.01 vs Control,#表示P<0.05 vs ATF(1 μg·mL-1)
由图2a可看出,加药6 d后,ATF组浓度在0.01~1 μg·mL-1时能剂量依赖性地促进成骨细胞的ALP活性(P<0.01),1 μg·mL-1时促进作用最强;ATF浓度在10~100 μg·mL-1时,促进作用下降。因此,选择ATF最适浓度为1 μg·mL-1。观察其在第2 d、4 d、6 d、8 d对成骨细胞的ALP活性的影响(图2b),结果发现,从第4 d开始,ATF组及E2组开始促进ALP活性(P<0.01),第6 d达到最高,第8 d又开始下降;第6 d时E2组比ATF组强(P<0.05)。
2.3 ATF对原代成骨细胞矿化的影响(图3)
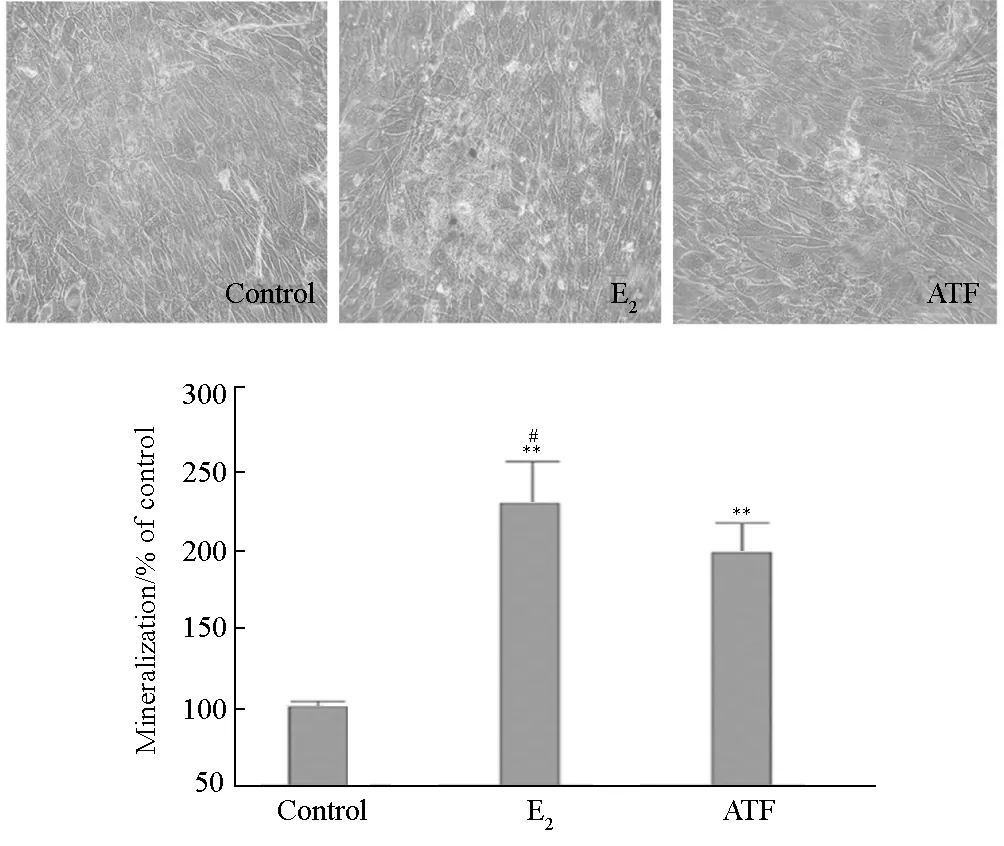
**表示P<0.01 vs Control,#表示P<0.05 vs ATF(1 μg·mL-1)
由图3可看出,细胞连续培养14 d,各组在不同的时间内出现了肉眼可见的白色结节,茜素红染色后呈现大小、形态不一的红色阳性结节;E2组及1 μg·mL-1ATF组与对照组相比均显著增加了成骨细胞矿化结节的数量(P<0.01),E2组的作用较ATF组强(P<0.05)。
2.4 ATF对原代成骨细胞分泌Ⅰ型胶原、骨钙素的影响
在原代成骨细胞中加入1 μg·mL-1的ATF,用ELISA法检测细胞上清中分泌Ⅰ型胶原及骨钙素的表达,结果见图4。
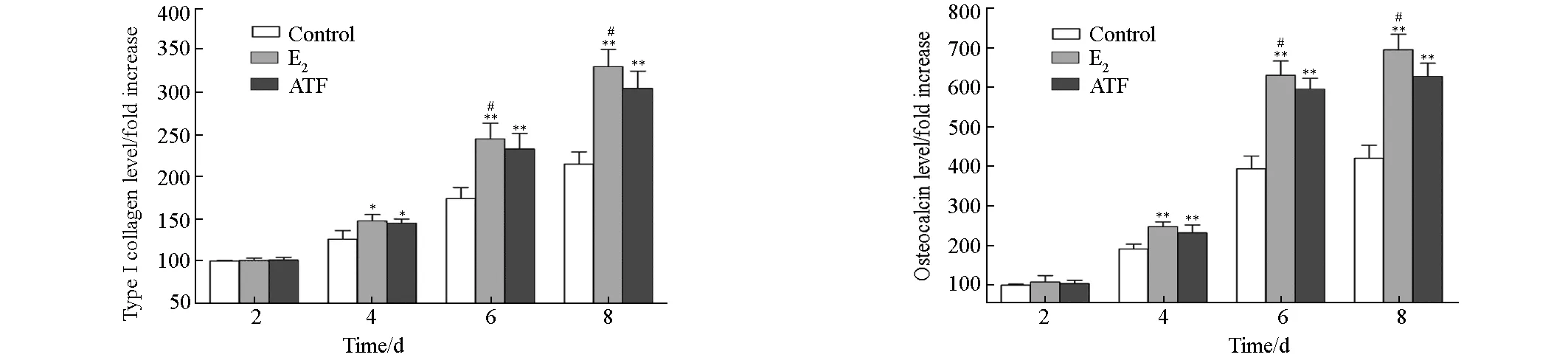
*表示P<0.05 vs Control,**表示P<0.01 vs Control,#表示P<0.05 vs ATF(1 μg·mL-1)
由图4可看出,培养2 d后ATF对Ⅰ型胶原、骨钙素蛋白表达无明显影响;第4~8 d ATF则显著促进Ⅰ型胶原、骨钙素蛋白的表达(P<0.05或P<0.01);第6~8 d时E2组的作用强于ATF组(P<0.05)。
2.5 ATF对原代成骨细胞BMP-2、Runx-2蛋白表达的影响
用ELISA法检测细胞上清中分泌型BMP-2蛋白的表达,结果见图5。
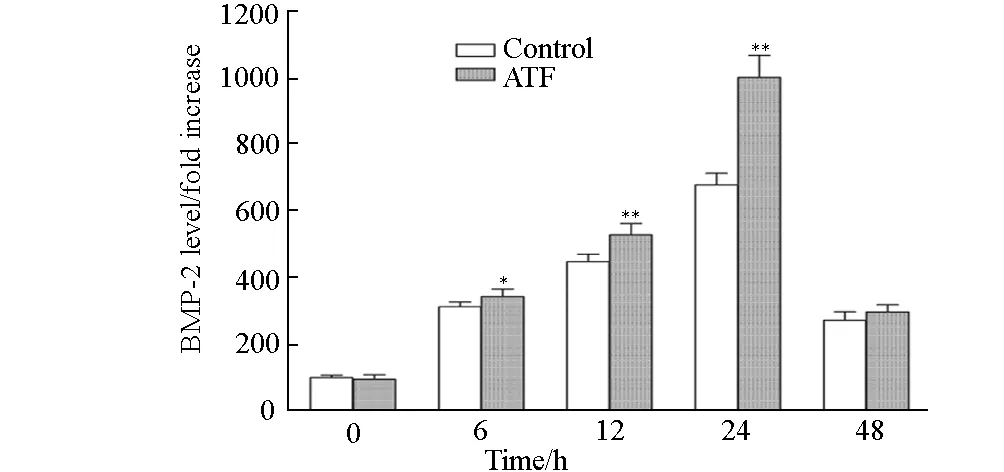
*表示P<0.05 vs Control,**表示P<0.01 vs Control
由图5可看出,在0~24 h,BMP-2蛋白的表达逐渐升高,24 h达到最高,48 h时BMP-2蛋白的表达反而下降。表明,6~24 h,ATF能显著促进BMP-2蛋白表达(P<0.05或P<0.01)。
用Western blot法检测细胞中Runx-2蛋白的表达,结果见图6。
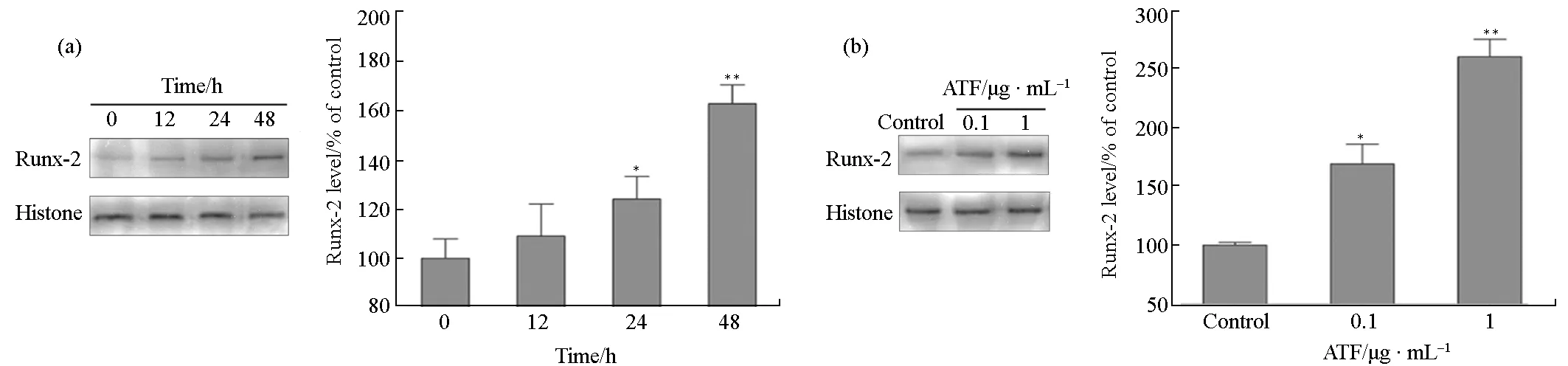
*表示P<0.05 vs Control,**表示P<0.01 vs Control
由图6可看出,在0~48 h,Runx-2蛋白的表达逐渐升高,在48 h 达到最高(图6a);0.1 μg·mL-1及1 μg·mL-1ATF能显著促进Runx-2蛋白的表达(P<0.05或P<0.01),且呈剂量依赖性变化(图6b)。
2.6 讨论
2.6.1 ATP对原代成骨细胞增殖、分化及矿化影响的讨论
(1)成骨细胞不仅决定骨形成,同时也调节破骨细胞的骨吸收,是骨代谢的重要功能细胞。成骨细胞的增殖与分化受到抑制,从而使骨质量和骨量下降,骨小梁稀疏、断裂,是导致骨质疏松的病理机制之一。因此防治骨质疏松的关键是提高成骨细胞的增殖和分化水平。用MTT法检测细胞增殖的原理是:增殖的活细胞通过线粒体能量代谢,将淡黄色的MTT还原成蓝紫色的结晶(甲瓒)沉积在细胞内和细胞周围,形成的结晶与增殖的活细胞数成正比。本研究发现,ATF能显著促进大鼠原代成骨细胞增殖,浓度为10 μg·mL-1时促增殖作用最强,而ATF浓度为100 μg·mL-1时开始抑制细胞增殖。
(2)碱性磷酸酶ALP是参与骨代谢的重要蛋白质,是识别和评价成骨细胞分化程度的早期指标。Ⅰ型胶原蛋白及骨钙素的合成及分泌是成骨细胞分化成熟的标志。本研究发现,ATF浓度为0.01~1 μg·mL-1时,能剂量依赖性地促进成骨细胞的ALP活性(P<0.01),ATF浓度为1 μg·mL-1、给药6 d时的促进作用最强,第6 d时阳性对照E2组比ATF组强(P<0.05)。同时,浓度为1 μg·mL-1的ATF给药4~8 d能显著促进Ⅰ型胶原及骨钙素的表达(P<0.05或P<0.01)。
(3)细胞进入分化末期后,细胞局部聚集形成细胞团,相互促进成熟,胞体变小,随着矿化基质的增多而逐渐被埋入其内,最终形成明显的矿化结节。矿化结节的形成是成骨细胞体外成骨的重要标志之一,是成骨功能的形态表现[8]。本研究发现,与对照组相比,1 μg·mL-1ATF组显著增加了成骨细胞矿化结节的数量(P<0.01)。
ATF对成骨细胞增殖、分化及矿化的促进作用虽弱于阳性对照E2组,但是雌激素对子宫具有明显的刺激作用[9],而未见报道ATF有明显的毒副作用。
2.6.2 ATF对原代成骨细胞BMP-2、Runx-2蛋白表达影响的讨论
骨形态发生蛋白系列(Bone morphogenetic proteins,BMPs)属于转化生长因子-β(Transforming growth factor,TGF-β)超家族,是调节成骨细胞生长最重要的生长因子。其中以BMP-2活性最强,其对人骨髓间充质干细胞有强烈的成骨诱导活性,而且能使诱导性骨细胞向确定性骨细胞转化,从而促进骨形成[10]。核心结合因子αl(Core binding factorαl,Cbfαl,Runx-2)是近来发现的成骨细胞特异性转录因子,在成骨细胞的分化成熟以及骨形成中起着关键性的作用[11],可调节骨钙素、Ⅰ型胶原、骨桥蛋白、骨涎蛋白等骨基质蛋白的表达[12]。本研究发现,1 μg·mL-1ATF能显著促进大鼠原代成骨细胞BMP-2、Runx-2蛋白的表达,提示ATF促进大鼠原代成骨细胞成骨活性的作用机理,可能是通过上调骨形成蛋白BMP-2的表达,以激活其下游细胞核内与细胞增殖分化密切相关的转录因子Runx-2表达,最终促进细胞的增殖、分化。
3 结论
黄芪总黄酮能促进大鼠原代成骨细胞的增殖、分化与矿化,从细胞水平为黄芪总黄酮抗骨质疏松提供有力依据。其作用机制可能是通过上调BMP-2的表达,激活下游的转录因子Runx-2表达,以促进细胞的成骨活性。天然产物的成分非常复杂,其作用不可能用一两种机制就能解释清楚,而骨质疏松本身也是一种多因素、多环节的疾病,治疗中需要标本兼治、整体调节方能奏效,这也是中医药治疗的特色。为确保中药质量标准化,使其更好地走向市场,走向国际,进一步明确中药的活性成分及药理机制是十分必要的。
[1] 邓力,郑虎,翁玲玲,等.用培养成熟大鼠头盖骨的成骨细胞筛选药物[J].华西药学杂志,1998,13(2):85-87.
[2] 周军杰,曹成福,纪斌,等.丹黄补骨方调控骨形成功能的疗效特征[J].中国临床康复,2006,10(31):37-39.
[3] 阳波,杨静.黄芪对绝经后骨质疏松症患者影响的临床研究[J].四川医学,2007,28(3):291-292.
[4] 孔祥鹤,牛银波,王婷梅,等.黄芪多糖对大鼠原代成骨细胞的影响及其机制研究[J].中草药,2011,42(10):2065-2069.
[5] 刘心萍,陈方亮,程亚军.黄芪总黄酮防止大鼠骨质疏松的实验研究[J].浙江中西医结合杂志,2005,15(5):282-283.
[6] 陈华庭,王虎,郑菁,等.黄芪总黄酮提取物对维甲酸所致大鼠骨质疏松的影响[J].中国药师,2005,8(11):895-897.
[7] Yang R S,Lin W L,Chen Y Z,et al.Regulation by ultrasound treatment on the integrin expression and differentiation of osteoblasts[J].Bone,2005,36(2):276-283.
[8] Lynch M P,Capparelli C,Stein J L,et al.Apoptosis during bone-like tissue developmentinvitro[J].J Cell Biochem,1998,68(1):31-49.
[9] Rossouw J E,Anderson G L,Prentice R L,et al.Risks and benefits of estrogen plus progestin in healthy post-menopausal women:Principal results from the women′s health initiative randomized controlled trial[J].J Am Med Assoc,2002,288(3):321-333.
[10] Troen B R.Molecular mechanisms underlying osteoblast formation and activation[J].Exp Gerontol,2003,38(6):605-614.
[11] Lian J B,Javed A,Zaidi S K,et al.Regulatory controls for osteoblast growth and differentiation:Role of Runx/Cbfα/AML factors[J].Crit Rev Eukaryot Gene Expr,2004,14(1-2):1-41.
[12] Ducy P,Starbuck M,Priemel M,et al.A Cbfαl-dependent genetic pathway controls bone formation beyond embryonic development[J].Genes Dev,1999,13(8):1025-1036.
