HSP70、突变型P53在复发性、耐药性卵巢癌中的表达及临床意义
2012-07-21李雅静
李雅静,石 红
(1.山西省人民医院,山西 太原 030012;2.大连医科大学附属第一医院,辽宁大连 116011)
卵巢癌是妇科常见恶性肿瘤之一,目前多采取肿瘤细胞减灭术辅以铂类为基础化疗的综合治疗,但大多数患者会复发或产生耐药,化疗是卵巢癌治疗中不可缺少的重要辅助手段。研究表明,HSP70、mtP53可阻止多种化疗药物或放疗引起的肿瘤细胞凋亡,抑制化疗药物在肿瘤细胞中的核苷酸改变,导致肿瘤细胞耐药[1,2]。而E1B缺陷型腺病毒能在P53基因突变肿瘤细胞中有效地复制、溶瘤,同时它还可以显著增强化疗药物的抗瘤作用,化疗药物及腺病毒溶瘤作用产生的多种肿瘤特异性抗原降解成多肽,可与HSP70结合,形成热休克蛋白抗原肽复合体(HSP-antigen complex,HAC),共同表达于细胞表面,可激活机体免疫效应,达到协同抗癌的作用[3,4]。本文采用免疫组化法检测卵巢癌组织中HSP70和mtP53表达率,同时用Western blot法测定卵巢癌患者血清中HSP70在手术前后、化疗前后表达水平,旨在探讨E1B缺陷型腺病毒联合化疗在卵巢癌中应用的可行性及应用时机,为解决复发、耐药性卵巢癌的治疗探索一种新的治疗方法。
1 资料与方法
1.1 研究对象
2000年1月至2004年12月山西省人民医院收治卵巢上皮性癌59例,其初治癌36例,复发癌23例,平均发病年龄为53岁(32~69岁)。根据1985年FIGO分期,Ⅰ期4例,Ⅱ期9例,Ⅲ期40例,Ⅵ期6例。免疫组化法检测mtP53、HSP70阳性率。对其中31例卵巢癌患者(初治癌29例,复发癌2例),同时测定手术前后、化疗前后末梢血中的HSP70水平。所选患者均为首次治疗,术后采用以铂类药物为主的联合化疗6~8个疗程。应用铂类药物化疗后、复发时间大于6个月的卵巢癌患者,为对铂类药物敏感型卵巢癌;用铂类药物化疗后、复发时间小于6个月的卵巢癌患者,为对铂类药物耐药型卵巢癌。
1.2 免疫组化染色
采用 EliVisionTM Plus法。步骤如下:a)常规10%甲醛溶液固定组织标本,石蜡包埋,切片厚度4 μm,每个标本均制备苏木精曙红(HE)染色对照片。b)石蜡切片脱蜡和水化;高压锅抗原修复1.5 min;内源性过氧化物酶阻断10 min;滴加鼠抗人mtP53单克隆抗体、鼠抗人HSP70抗体(一抗)60 min;加聚合物增强剂(试剂A)20 min;加酶标抗鼠聚合物(试剂B)30 min;加DAB显色,冲洗、复染、封片。每次染色均用已知阳性的乳腺癌切片作阳性对照,用PBS代替一抗作阴性对照。结果判定HSP70阳性为胞浆、胞核着色,mtP53阳性为细胞核着色。阳性标准参考Bosari[5]的方法并略作修改,mtP53:核阳性细胞<10%为阴性(-);10%≤核阳性细胞<30%为低度阳性(+);30%≤核阳性细胞<60%为中度阳性(++);核阳性细胞≥60%为强阳性(+++)。HSP70:(-)为胞浆着色浅棕色,核阳性细胞<10%;(+)为胞浆着色浅棕色,10%≤核阳性细胞<50%;(++)为胞浆着色浅棕色,核阳性细胞≥50%或为胞浆着色深棕色,10%≤核阳性细胞<50%;(+++)为胞浆着色深棕色,核阳性细胞≥50%。
1.3 Western blot法检测血浆中HSP70水平
步骤如下:a)样品的收集与处理:抽取患者清晨空腹静脉血3 mL,加肝素抗凝,离心后分离血浆,低温-80℃保存,待用。b)考马斯亮兰标准曲线法作蛋白浓度测定;各标本每泳道取约20 μg蛋白,10%SDS-聚丙烯酰胺凝胶电泳分离蛋白;将蛋白电转移至硝酸纤维薄膜(NC膜);5%脱脂奶粉封闭NC膜过夜;与HSP70单抗(1∶200稀释)37℃3 h;加生物素标记的马抗小鼠IgG(1∶300稀释)37℃1 h;加碱磷酶标记的链酶亲合素(1∶400稀释)37℃40 min;加 NCIP/NBT显色,适时终止;结果扫描保存,并用Syngene全自动凝胶成像分析系统分析HSP70的水平(单位:积分光密度)。
1.4 统计学方法
SPSS12.0统计软件进行数据分析,采用χ2检验,t检验处理数据,P<0.05为具有统计学意义。
2 结果
2.1 HSP70和mtP53在卵巢上皮肿瘤中的表达
HSP70阳性为胞浆、胞核着色。卵巢癌组织中HSP70总阳性率为67.80%。与复发性卵巢癌组织HSP70总阳性率为78.26%比较,无统计学意义(P>0.05)。且初治卵巢癌组织阳性率与复发卵巢癌组织中的比较,有统计学意义(P<0.05)。见表1。
mtP53定位于细胞核。卵巢癌组织中mtP53阳性率62.71%,其中复发卵巢癌组织中的阳性率为78.26%,强阳性率为43.48%,而初治卵巢癌组织中阳性率为52.78%,强阳性率为22.22%,两者相比较具有统计学意义(P <0.05)。见表2。

表1 卵巢上皮肿瘤中HSP70表达的阳性率Table 1 Positive Rate of HSP70 Expression in Epithelial Ovarian Tumor
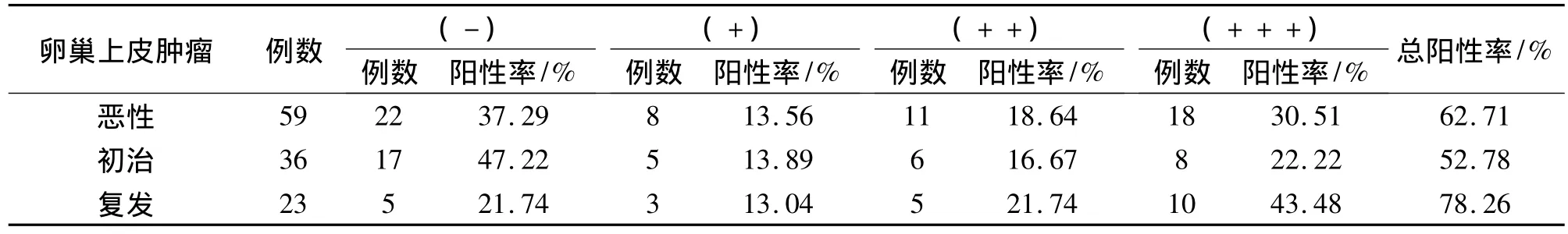
表2 卵巢上皮肿瘤中mtP53表达的阳性率Table 2 Postive Rate of mtP53 Expression in Epithelial Ovarian Tumor
2.2 HSP70、mtP53与卵巢癌进展期及肿瘤分化程度的关系
HSP70、mtP53在进展期卵巢癌中的阳性率均明显高于早期卵巢癌(P<0.05);在低分化卵巢癌组织中的阳性率均明显高于高分化和中分化卵巢癌(P<0.05)。见表3,表4。

表3 不同进展期HSP70、mtP53阳性率比较 %Table 3 Comparison of HSP70 and mtP53 Positive Rate in Different Progressive Stages %

表4 HSP70、mtP53阳性表达与肿瘤病理分级 %Table 4 HSP70 and mtP53 Postive Expression and Pathologic Grading of Cancer %
2.3 卵巢癌中HSP70表达与mtP53高表达的相关性
卵巢癌中HSP70和mtP53共同阳性率为55.9%(33/59)。37例P53阳性卵巢癌组织中,HSP70阳性33例,阴性4例;而22例mtP53阴性卵巢癌组织中,HSP70阳性7例,阴性15例。两者比较差异有统计学意义(P<0.05)。其中复发癌中HSP70和mtP53共同阳性率为69.57%(16/23),初治癌中为47.22%(17/36),前者明显高于后者(P <0.05)。见表5。

表5 mtP53和HSP70阳性表达在卵巢癌中的关系 例Table 5 Relationship between mtP53 and HSP70 Positive Expression in Epithelial Ovarian Caner case
2.4 复发卵巢癌HSP70、mtP53阳性表达与铂类耐药的关系
HSP70、mtP53在铂类耐药型卵巢癌中的阳性率(14/16,14/16)均明显高于非耐药型卵巢癌(4/7,3/7)(P <0.05)。见表6。

表6 HSP70、mtP53在铂类耐药型卵巢癌阳性率的比较 %Table 6 HSP70 and mtP53 Positive Rate in Two Recurrent Epithelial Ovarian Cancers %
2.5 血浆中HSP70表达水平在手术前后及化疗前后的变化
SDS-PAGE和Western blot检测结果见表7,图1,图2。结果显示,HSP70在术后2 d、4 d的表达水平较术前明显升高(P<0.05),术后2 d与4 d比较差异无统计学意义(P>0.05),术后2 d、4 d明显高于术后6 d(P <0.05),术后6 d(化疗前)与化疗后2 d比较,后者表达水平略高于前者,但差异无统计学意义(P>0.05),化疗后2 d明显高于化疗后4 d、6 d(P <0.05)。

表7 手术前后及化疗前后血浆HSP70表达水平的比较Table 7 Comparison of HSP70 Expression in Plasma before and after Surgery and Chemotherapy

图1 SDS-PAGE图谱显示血浆HSP70分离情况Fig 1 Separation Condition of Plasma HSP70 in SDS-PAGE Atlas

图2 血浆HSP70 Western blot显色情况Fig 2 Coloration Condition of Plasma HSP70 Western Blot
3 讨论
3.1 HSP70、P53在卵巢癌中表达的意义
野生型P53(wild type P53,wtP53)为肿瘤抑制基因,被称为是“基因卫士”,具有稳定细胞基因组的功能。当wtP53基因发生突变时会促进细胞的增殖和转化,从而失去抑癌作用引起肿瘤的发生。到目前为止,P53基因突变是肿瘤中最为常见的遗传变异。HSPs是一组广泛存在于原核、真核生物的高度保守的应激蛋白,参与蛋白折叠、转运、机体免疫、细胞凋亡等多种生物功能。HSP70是HSP家族中最丰富和最重要的一种。研究表明,HSP70可能在与P53相关的肿瘤发生中扮演重要的角色,它可能通过与mtP53基因及其蛋白产物的相互作用在肿瘤的发生、发展中起作用[6,7]。本研究发现,mtP53和 HSP70在卵巢癌中高表达,其表达与卵巢癌的进展期及细胞分化程度相关,晚期和低分化的卵巢癌中mtP53、HSP70阳性率明显高于早期和高分化型,提示两者可作为推测卵巢癌预后的指标。
一方面HSP70、mtP53可能参与肿瘤的发生、发展,另一方面研究发现,许多肿瘤中,P53突变往往引起肿瘤对放化疗的不敏感,而且HSP70也通过参与肿瘤细胞周期调控和表型改变,阻止细胞终末分化后凋亡,保护肿瘤细胞免受抗癌药物、射线照射等因素诱发的凋亡,研究表明mtP53、HSP70可能参与了肿瘤细胞耐药机制[2,8~10]。本研究发现,复发卵巢癌中铂类耐药型卵巢癌mtP53、HSP70表达率明显高于非耐药型卵巢癌,且复发性卵巢癌mtP53、HSP70共同阳性率明显高于初治卵巢癌,表明mtP53、HSP70的相互作用可能在复发性卵巢癌发展中起作用。
3.2 E1B-55KD缺陷型腺病毒联合化疗治疗在卵巢癌中应用的可行性及应用时机
治疗后容易复发是卵巢癌一大特点,化疗耐药是卵巢癌治疗上急需攻克的难题。本实验数据表明,卵巢癌中mtP53高表达与恶性程度有关,且其高表达还可能直接或间接参与了卵巢癌的耐药、复发,导致卵巢癌预后不良。研究发现,E1B-55KD缺陷型腺病毒可以选择性地在P53缺陷型肿瘤细胞或P53正常功能受到抑制的P53野生型肿瘤细胞中复制并裂解杀伤细胞,同时释放大量子代病毒再感染其他细胞,从而发挥连锁杀伤的抗肿瘤作用[3,4]。同时它还可以显著增强化疗、放疗的抗瘤作用。因此E1B-55KD缺陷型腺病毒联合化疗为治疗mtP53高表达的耐药性、持续性、难治性卵巢癌提供了有效的新的治疗手段。目前,用于复发头颈肿瘤的临床试验已经初步显示了一定的疗效和安全性。
另有研究表明,化疗杀伤及腺病毒的溶瘤作用在引起肿瘤细胞裂解的同时,产生多种肿瘤特异性抗原(如P53突变癌蛋白和病毒相关抗原),这些抗原性蛋白降解成多肽后,可以与HSP70结合,形成热休克蛋白多肽复合物(heat shock protein 70 peptide-complexes,HSP-PC70)具有很强的免疫原性,表达于细胞表面,可激活多个肿瘤特异性细胞毒T淋巴细胞(cytotoxic T lymphocytes,CTL)克隆,产生抗肿瘤免疫效应[4]。可见E1B-55KD缺陷型腺病毒联合化疗可以同时诱发机体强大的抗肿瘤免疫,两者结合,协同抗瘤,疗效更好。本研究也显示,HSP70在卵巢癌中高表达,特别是在进展期、低分化、复发耐药型卵巢癌中表达更强;且其表达与mtP53高表达密切相关,即两者共同阳性率达69.57%,使溶瘤性腺病毒的应用成为可能。表明在难治性卵巢癌中应用E1B-55KD缺陷型腺病毒联合化疗法,疗效可能会更好。那么如何将腺病毒联合化疗法和机体的抗肿瘤免疫效应更加有效地结合起来,应用时机将是治疗的关键。研究表明,HSP70在细胞核中合成,主要储存在胞浆中,与血浆中水平相关;且只有在肿瘤细胞中,HSp70才表达于质膜[11]。因此,本研究检测了31例卵巢癌患者血浆HSP70表达水平,观察其在手术前后、化疗前后的变化,发现术后2~4 d及化疗后2 d内HSP70表达量明显增高。提示,E1B-55KD缺陷型腺病毒联合化疗可以在卵巢癌尤其是复发、耐药性卵巢癌的治疗方面发挥作用。目前关于腹腔注射腺病毒治疗铂类耐药型卵巢癌患者的Ⅰ期临床研究正在进行。本研究提示腺病毒应用时机选择在手术或化疗后2 d之内可能效果更佳,为临床应用E1B-55KD缺陷型腺病毒联合化疗治疗难治性卵巢癌的用药时机提供了理论依据。
[1]Hollstein M,Sidransky D,Vigedstein B,et al.P53 Mutants in Human Cancers[J].Science,1991,253(5015):49-53.
[2]Kwak HJ,Jun CD,Pae HO,et al.The Role of Inducible 70-KD Heat Shock Protein in Cell Cycle Control,Differentiation ,and Apoptotic Cell Death of the Human Myeloid Leukemic HL-60 cells[J].Cell Immunol,1998,187(1):1-12
[3]Heise C,Sampson-Johannes A,Williams A ,et al.ONYX-015,an E1B Gene-attenuated Adenovirus,Causes Tumor-specific Cytolysis and Antitumoral Efficacy that can be Augmented by Standard Chemothera Peutic Agents[J].Nat Med,1997,3(6):639-645
[4]Issii T,Udono H,Yamano T,et al.Isolation of MHC ClassⅠ-Restricted Tumor Antigen Peptide and its Precursors Associated with Heat Shock Protein Hsp70 ,Hsp90,and gp96[J].J Immunol,1999,162(3):1303-1309.
[5]Bosari S,Viale G,Radaelli U,et al.P53 Accumulation in Ovarian Carcinomas and its Prognostic Implication[J].Hum Pathol,1993,24:1175.
[6]Agoff SN,Hou J,Linzer DIH,Wu B:Regulation of the Human HSP70 Promoter by p53[J].1993,259:84-86.
[7]Chang-Soo Park,M.D.,In-Sook Joo,M.D.et al.An Immunohistochemical Analysis of Heat Shock Protein 70,p53,and Estrogen Receptor Status in Carcinoma of the Uterine Cevix[J].Gynecologic Oncology,1999,74(1):53-60
[8]Witkin SS.Heat Shock Protein Expression and Immunity:Relevance to Gynecologic Oncology[J].Eur J Gynaecol Oncol,2001,22(4):249-56.
[9]Liu FF,Miller N,Levin W,et al.The Potential Role of HSP70 as an Indicator of Response to Radiation and Hyperthermia Treatments for Recurrent Breast Cancer[J].Int J Hyperthermia.1996,12(2):197-210.
[10]何骁生,潘秋萍,邬堂春,等.Western斑点印迹法检测主要热应激蛋白[J].中国劳动卫生职业病杂志,1996,4(2):376-377.
[11]Vasey PA,Shulman LN,Campos S,et al.Phase I Trial of Intrapefitoneal Injection of the E1B-55-kd·gene-deleted Adenovirus ONYX-015(dll520)Given Oil Days 1 through 5 every 3 Weeks in Patients with Recurrent/Refractory Epithelial Ovarian Cancer[J].J Clin Onc01.2002,20(6):1562-1569.
