CerbB-2蛋白在胃癌组织中的表达及临床意义
2012-07-21王龙跃段伟宏朱震宇周宁新
王龙跃,连 婧,段伟宏,朱震宇,周宁新
(1.山西医科大学,山西 太原 030001;2.山西省肿瘤医院,山西太原 030013;3.解放军第二炮兵总医院肝胆胃肠病研究所,北京100088)
胃癌是我国常见的消化系统恶性肿瘤,有一些病例,临床确诊较晚,预后较差。治疗方式仍以外科手术为主,早期胃癌可以通过手术治愈,但多数胃癌患者确诊时已到中晚期。尽管联合围术期化疗或术后辅助化疗治疗,但进展期胃癌生存率仍很低。随着CerbB-2基因与乳腺癌靶向治疗取得的显著成果,关于CerbB-2基因与胃癌之间的关系,也被人们进一步关注和研究。
CerbB-2基因亦称HER2基因。HER2基因是表皮生长因子受体家族成员之一,其表达的蛋白产物为人表皮生长因子受体2,基因定位于染色体17q21,编码相对分子质量为185 000的跨膜酪氨酸激酶受体,即CerbB-2蛋白。正常情况下该基因处于非激活状态,参与组织细胞生长发育的调节。当受体内外环境因素刺激的作用下,其结构和表达调控失常,造成细胞增殖,促进细胞恶性转化,与肿瘤的发生发展密切相关[1]。现有研究发现,人类多种肿瘤组织中都有不同比例的CerbB-2基因的表达和扩增。CerbB-2过表达常见于乳腺癌、卵巢癌、前列腺癌、卵巢癌、胃癌等,与肿瘤的侵袭、转移、化疗耐药及预后不良有明显的相关性[2]。CerbB-2的检测方法包括免疫组织化学染色(immunohistochemistry,IHC)和原位杂交(in situ hybridization)技术,后者包括荧光原位杂交(fluorescence in situ hybridization,FISH)和双色银染原位杂交(dual chromogen visualization with silver in situ hybridization,DSISH)。本文采用组织病理学、免疫组织化学方法,研究CerbB-2蛋白在胃癌组织中的表达,探讨其表达及肿瘤临床病理特点和生物学行为关系,为个体化治疗CerbB-2阳性胃癌患者制定方案提供参考依据。
1 资料与方法
1.1 资料
选取2012年4月至2012年7月在山西省肿瘤医院行胃癌外科手术治疗的病理标本118例。病例入选标准:a)病历及手术后病理学资料完整者;b)排除胃的其他恶性肿瘤如淋巴瘤、平滑肌肉瘤等;c)排除合并其他原发恶性肿瘤,如结直肠癌等;d)术前未行任何辅助化疗或免疫治疗。所有标本经10%甲醛固定,常规取材,石蜡包埋,并经HE染色确诊。
按照2003年WHO消化系统肿瘤病理学和遗传学中胃癌组织学分类标准将进展期胃癌分为腺癌、乳头状腺癌、管状腺癌、黏液腺癌和印戒细胞癌等。根据Lauren胃癌分型将胃癌分为肠型(intestinal type)和弥漫型胃癌(diffuse type)两类。按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)胃癌TNM分期标准(第7版)进行TNM分期评估和临床分期评估。
1.2 方法
组织处理使用10%中性缓冲甲醛液作为固定剂,组织离体后尽快固定,最迟不超过1 h,固定时间为6~48 h,石蜡包埋,制备4 μm厚连续切片,首先脱蜡5 min,共5 次;抗原修复,pH6.0,37 ℃,30 min;滴加一抗,37℃,32 min;滴加二抗,37℃,30 min;DAB显色8 min;苏木精复染细胞核;常规梯度酒精脱水,二甲苯透明,中性树胶封片。
抗体选择,一抗为C-erbB-2,二抗为抗一抗体(美国Invitrogen/Zymed公司生产)。
1.3 免疫组化结果判定
手术标本染色形态,无反应或<10%的肿瘤细胞出现细胞膜反应,分值为0。大于等于10%的肿瘤细胞出现微弱或难以察觉的细胞膜反应;细胞的部分细胞膜有反应,分值为1+。大于等于10%的肿瘤细胞出现微弱至中等强度的完整、基底侧或侧膜反应,分值为2+。大于等于10%的肿瘤细胞中出现高强度的完整、基底外侧或侧膜反应 ,分值为3+[3]。CerbB-2为细胞胞膜、细胞质着色呈棕黄色颗粒,0分和(1+)为阴性;阳性为(2+)~(3+)。CerbB-2在胃癌组织中的不同表达结果见图1。
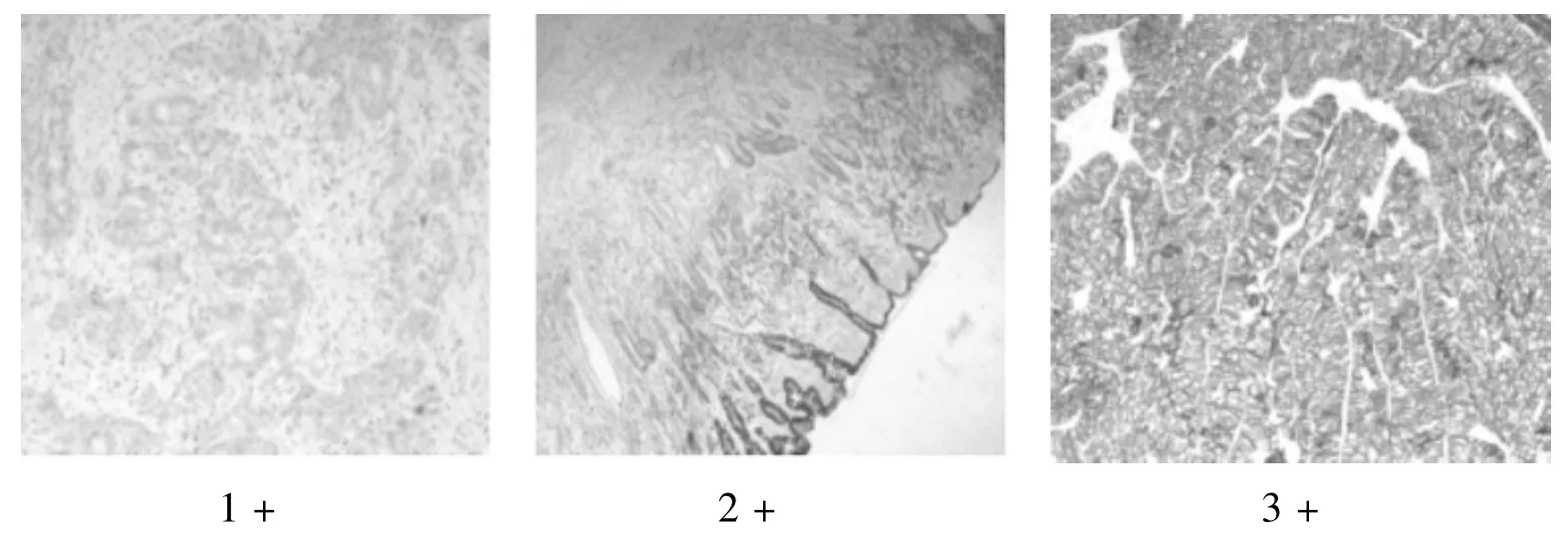
图1 CerbB-2在胃癌组织中的不同表达结果Fig 1 Different Expression Results of CerbB-2 in Gastric Cancer Tissue
1.4 统计学方法
采用SPSS13.0统计软件进行统计分析,计数资料采用χ2检验进行CerbB-2状态分析,以P<0.05为差异有统计学意义。
2 结果
2.1 临床及病理情况
118例胃癌中男性87例,女性31例,男女比例为2.8∶1。中位年龄60岁(32~83岁),其中57例患者<60岁,61例患者≥60岁。所有患者术前均经胃镜活检病理学证实为原发性胃癌。其中手术方式以D2根治术者101例,姑息性切除术者17例;肿瘤位于食管胃连接部者70例,胃体者19例,胃窦部者29例;肿瘤最大直径≤5 cm者66例,>5 cm者52例;病理类型中高分化者47例,低分化者71例;远处转移17例;切缘阳性2例;肿瘤侵犯神经73例,肿瘤侵犯脉管87例,肿瘤侵犯食道下段27例。临床分期:Ⅰ~Ⅱ期25例(其中Ⅰ期5例,Ⅱ期20例),Ⅲ~Ⅳ期93例(其中Ⅲ期 76例,Ⅳ期17例);其中阳性表达肠型胃癌18例,弥漫型胃癌7例,中高分化胃癌18例,低分化胃癌11例。胃癌组织中CerbB-2表达与临床病理参数的相关性分析见表1。

表1 胃癌组织中CerbB-2表达与临床病理参数的相关性分析 例Table 1 Analysis of Relevance to CerbB-2 Expression and Clinicopathologic Parameters in Gastric Cancer Tissue case
2.2 免疫组化结果
在118例胃癌中,CerbB-2免疫组织化学标记(0)者49例,免疫组织化学标记(1+)者40例,免疫组织化学标记可疑(2+)者21例,免疫组织化学标记(3+)者8例,其中免疫组织化学标记(3+)和免疫组织化学标记可疑(2+)者共29例,CerbB-2阳性表达率24.6%。
2.3 统计结果
CerbB-2表达与病理类型、Lauren分型、脉管侵犯和神经侵犯有关(P<0.05)。肠型胃癌的表达率(38.3%)明显高于弥漫型胃癌(18.4%,P < 0.05)。CerbB-2蛋白表达与患者性别、年龄、肿瘤大小、肿瘤部位、肿瘤侵袭深度、TNM分期无关。
3 讨论
1986年日本学者K.Sakai首次利用免疫组化方法(immunohisto-chemistry,IHC)发现胃癌中 CerbB-2的过表达[4]。随后越来越多的研究报道胃癌中存在CerbB-2 过表达,但表达率不尽相同,有报道[5~9]约6.8% ~34.0%的胃癌有CerbB-2过表达或扩增。其差异率可能是由于样本数量、检测方法、评分标准的不同而产生差异性。本资料的结果显示其阳性率为24.6%,位于其范围之内。
CerbB-2在胃癌组织中的表达能否为胃癌靶向治疗药物的选择提供理论依据,是近年来的研究热点。在1项203例胃癌 CerbB-2表达情况的前瞻性研究中,Ailgayer等[10]发现 CerbB-2阳性的病例其无病生存期和整体生存期更低,提示CerbB-2与根治性切除、肿瘤TNM分期等均是影响胃癌患者整体生存期的独立因素;Tanner等[6]研究调查了131例胃癌患者的生存期,发现CerbB-2阳性患者中位生存期仅为6.6个月,相比CerbB-2阴性患者中位生存期明显缩短(12.7个月),但无统计学差异(P=0.37),可能与样本量有关,另外还有报道分析了182例手术治疗后胃癌患者CerbB-2基因表达情况,发现CerbB-2阳性的胃癌患者预后差、且5年生存率较低,多变量分析结果显示年龄、TNM分期和CerbB-2基因扩增均是影响生存期相对独立因素[11]。总之,越来越多的研究提示胃癌CerbB-2表达与胃癌预后存在相关性,可以作为评估胃癌预后的独立因子。
1965年芬兰人Lauren按照组织发生学将胃癌分为肠型和弥漫型(胃型)两类,通常认为肠型胃癌常见于老年人,细胞分化程度一般较高。C.Gravalos等[7]对166例胃癌组织标本进行研究,发现CerbB-2阳性率为肠型16%,弥漫型7%,具有统计学差异;而在最近的ToGA试验中,CerbB-2阳性率与胃癌组织分型差异显著,其中肠型36%,弥漫型6%,混合型10%[12]。本资料结果显示,肠型胃癌与弥漫型胃癌CerbB-2阳性率分别为38.3%和18.4%,(P <0.05),具有统计学差异,这与国外的研究一致。高中分化型胃癌 CerbB-2阳性率高于低分化型胃癌CerbB-2阳性率分别为38.3%和15.5%,(P <0.05)。这与 Lauren 分型相符合是因为高中分化癌多为肠型胃癌,低分化癌包括印戒细胞癌多为弥漫型胃癌,同样提示了胃癌CerbB-2基因的扩增和蛋白表达具有选择性。国外有关研究表明[13],就淋巴结转移率、肿瘤浸润深度相比较,CerbB-2阳性比CerbB-2阴性的高中分化胃癌均高,提示CerbB-2表达可能影响胃癌预后。
国外有研究显示,CerbB-2表达在胃癌原发部位具有相关性,尤其是在胃食管结合部(gastroesphageal,GEJ)癌存在更高表达。还有结果表明,GEJ癌相比胃部癌存在更高的CerbB-2阳性表达,表达率25%~36%[14],C.Gravalos等[7]研究提示了胃食管连接部癌CerbB-2阳性率为25%,其他部位胃癌CerbB-2阳性率9.5%,具有统计学意义;Tanner等[6]研究也表明 GEJ癌CerbB-2基因扩增明显高于其他部位胃癌;ToGA试验中报道1 580胃癌患者中,GEJ癌 CerbB-2阳性率32%,而其他部位胃癌CerbB-2阳性率18%[12]。这些结果间接提示针对CerbB-2阳性表达患者治疗对于GEJ癌患者受益范围更大。
但在本资料结果显示,胃癌原发部位中,胃底、贲门癌CerbB-2阳性率为20.0%,胃体、胃窦癌CerbB-2阳性率为31.3%,胃底贲门癌CerbB-2表达低于胃部癌的表达,差异无统计学意义,而全球胃癌发病的流行病学分析发现欧美国家以食管胃连接部肿瘤多见,而亚洲国家包括日本和我国胃癌发病部位以胃窦体部为多见,食管胃连接部肿瘤相对较少。国内有研究报道胃窦癌发病率明显高于贲门部癌(45.7%,11.9%)[15],这种区别也反映了东西方胃癌患者的发病机制不同。更大样本量的统计需要我们进一步研究以证实。与有关报道[10,11]结论相反,Garcia 等[16]认为CerbB-2水平与胃癌患者的临床病理特性无明显关系。还有报道CerbB-2基因的表达与胃癌患者的临床分期和预后无任何关系[17]。本研究的结果中显示,CerbB-2阳性表达与TNM分期及肿瘤侵犯深度无关,但与脉管侵犯及神经侵犯密切相关(P<0.05),可能与样本量及胃癌发病流行病学等相关因素有关,但脉管及神经侵犯与患者预后仍密切相关。
赫赛汀对CerbB-2阳性和阴性胃癌细胞,都没有明显杀伤效应,但赫赛汀作用阳性细胞48 h后可以明显下调胃癌细胞 CerbB-2 的表达[18]。Tanner等[6]进行了赫赛汀对胃癌和乳腺癌药物敏感性比较的研究发现,赫赛汀对CerbB-2高表达的胃癌N87细胞和乳腺癌SKBR-3细胞的抑制率相似,说明两种肿瘤细胞对赫赛汀的敏感性相同,因此从理论上证明了赫赛汀治疗CerbB-2高表达胃癌的有效性。Rebischung等[19]证实赫赛汀联合化疗对CerbB-2过表达的转移性胃癌有效。一项Ⅱ期临床研究结果显示[20],赫赛汀联合顺铂治疗CerbB-2过表达或扩增的晚期胃癌的客观有效率比单用顺铂要高。
2009年,关于胃癌研究的国际多中心随机对照临床Ⅲ期实验(ToGA)结果显示[21],在标准化治疗药物联合曲妥珠单抗后,能显著延长CerbB-2阳性的晚期和不适合手术胃癌患者的生存期,使患者的存活期由11.1月提高到了13.5月,死亡率降低了26%,而且无明显的不良反应。TOGA试验发现,若把FISH作为首选筛选病例,只有少数IHC 3+病例会漏选,但会出现较多靶向治疗不敏感病例。因此有人认为在胃癌中IHC预测价值比FISH要高。亮视野原位杂交可能比FISH有优势,这都与胃癌的异质性相关[21]。因此IHC可作为胃癌患者CerbB-2靶向治疗初筛,FISH也不能作为首次或唯一决定是否适合靶向治疗的检验。ToGA研究表明 IHC 3+(无论 FISH状态)或IHC 2+/FISH+者均可从曲妥珠单抗治疗中获益[22,23]。
本研究免疫组化结果显示,118例胃癌细胞中Her-2阳性总表达率为24.6%。CerbB-2表达与肿瘤大小、病理类型、Lauren分型、脉管侵犯和神经侵犯有关,而与性别、年龄、肿瘤部位、肿瘤侵袭深度和TNM分期无关。肠型胃癌的表达率(38.3%)明显高于弥漫型胃癌(18.4%,P<0.05)。其中 CerbB-2 阳性患者(3+)8例(6.78%),这些患者可根据具体情况进入赫赛汀辅助治疗的临床研究。而Her-2(2+)患者21例(17.80%),可进一步采用FISH技术检测CerbB-2基因扩增情况,以明确是否为CerbB-2阳性胃癌。对于晚期不能手术的胃癌患者,应采取因人而异的个体化治疗策略,免疫组化可以对CerbB-2阳性患者进行初步筛选以为个体化治疗提供参考依据。
[1]Sebastian S,Settleman J,Reshkin SJ,et al.The Complexity of Targeting EGFR Signalling in Cancer:from Expression to Turnover[J].Biochim Biophys Acta,2006,1766:120-139.
[2]Dent R,Trudeau M,Pritchard KI,et al.Triple-negative Breast Cancer:Clinical Features and Patterns of Recurrence[J].Clin Cancer Res,2007,13:4429-4434.
[3]《胃癌HER2检测指南》编写组 .胃癌HER2检测指南[J].中华病理学志,2011,40(8):553-557.
[4]Sakai K,Mori S,Kawamoto T,et al.Expression of Epidermal Growth Factor Receptors on Normal Human Gastric Epithelia and Gastric Carcinomas[J].JNatl Cancer Inst,1986,77:1047-1052.
[5]Hoffmann M,Stoss O,Shi D,et al.Assessment of a Her-2 Scoring System for Gastric Cancer:Results from a Validation Study[J].Histopathology ,2008,52:797-805.
[6]Tanner M,Hollmén M,Junttila TT,et al.Amplification of HER2 in Gastric Carcinoma:Association with Topoisomerase Li-alpha Gene Amplification,Intestinal Type,Poor Prognosis and Sensitivity to Trastuzumab[J].Ann Oncol,2005 ,16(2):273-278.
[7]Gravalos C,Jimeno A.HER2 in Gastric Cancer:a New Prognostic Factor and a Novel Therapeutic Target[J].Ann Oncol,2008,19:1523-1529.
[8]Barros-Silva JD,Leitao D,Afonso L,et al.Association of ERBB2 Gene Status with Histopathological Parameters and Disease-specific Survival in Gastric Carcinoma Patients[J].Br J Cancer,2009,100(3):487-493.
[9]武鸿美,刘艳辉,林 锋,等.中国胃癌患者HER2蛋白表达与临床病理学参数及预后的关系[J].中华病理学杂志,2011,4(5);296-299.
[10]Allgayer H,Babic R,Gruetzner KU,et al.CerbB-2 is of Independent Prognostic Relevance in Gastric Cancer and is Associated with the Expression of Tumor-associated Protease Systems[J].J Clin Oncol,2000,18(11):2201-2209.
[11]Park DI,Yun JW,Park JH,et al.HER2/neu Amplification is an Independent Prognostic Factor in Gastric Cancer[J].Dig Dis Sci.,2006,51(8):1371-1379.
[12]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in Combination with Chemotherapy Versus Chemotherapy alone for Treatment of HER2-positive Advanced Gastric or Gastro-oesophageal Junction Cancer(ToGA):a Phase 3,Open-label,Randomised Controlled trial[J].Lancet,2010,376:687-697.
[13]Reichelt U,Duesedau P,Tsourlakis MCh,et al.Frequent Homogenous HER2 Amplication in Primary and Metastatic Adenocarcinomas of Theesophagus[J].Mod Path,2007,20(1):120-129.
[14]J.León-Chong,F.Lordick,Y.K.Kang,el at.HER2 Positivity in Advanced Gastric Cancer is Comparable to Breast Cancer[J].Journal of Clinical Oncology,2007,25(185):15027.
[15]王 妍,王晶桐.429例胃癌流行病学资料分析[J].胃肠病学和肝病学杂志.2007,16(6):525-527.
[16]Garcia I,Vizoso F,Martin A,et al.Clinical Significance of the Epidermal Growth Factor Receptor and Her-2 Receptor in Respectable Gastric Cancer[J].Ann Surg Oncol,2010(3):234-241.
[17]Grabsch H,Sivakumar S,Gray S,et al.HER2 Expression in Gastric Cancer:Rare,Heterogeneous and of no Prognostic Value-conclusions from 924 Cases of Two Independent Series[J].Oncol,2010,32(1-2):57-65.
[18]Gong SJ,Jin CJ,Rha SY,Chung HC.Growth Inhibitory Effects of Trastuzumab and Chemotherapeutic Drugs in Gastric Cancer CellLines[J].Cancer Lett,2004,214:215-224.
[19]Rebischung C,Barnoud R,Stéfani L,et al.The Effectiveness of Trastuzumab(Herceptin)Combined with Chemotherapy for Gastric Carcinoma with Overexpression of the C-erbB-2 Protein[J].Gastric Cancer,2005,8:249-252.
[20]Cortes- Funes H,Rivera F,Ales I,et al.Phase II of Trastuzumab and Cisplatin in Patients with Advanced Gastric Cancer(AGC)with HER-2/neu Overexpression/amplify Cation[J].J Clin Oncol,2007,25(18S):4613.
[21]Van Cutsem E,Kang Y,Chung H,et al.Efficacy Results from the ToGA trial:A Ph1aseⅢStudy of Trastuzumab Added to Standard Chemotherapy(CT)in First-line Human Epidermal Growth FactorReceptor 2(Her-2)-positive Advanced Gastric Cancer(GC)[J].J Clin Oncol,2009,27(18S).
[22]Rüschoff J,Pietel M,Baretton G,et al.HERI Diagnostics in Gastric Cancer-guide-line Valid-ation and Revelopment of Standardized Immunochistochemical Testing[J].Virchows Arch,2010,457(3):299-307.
[23]Lordick F,Bang YJ,Kang YK,et al.HER2 Positivity in Advanced Gastric Cancer:Similar HER2 Positivity to Breast Cancer[J].Eur J Cancer,2007,5(4):271.
