仙人掌多糖主要组分对糖尿病小鼠的免疫调节作用
2012-07-21张松莲赵龙岩袁清霞曾富华
张松莲,赵龙岩,袁清霞,程 杰,曾富华
(1.湛江师范学院 生命科学与技术学院,广东 湛江 524048;2.资兴市农业局,湖南 资兴 423400)
糖尿病(diabetes mellitus,DM)是一种常见的多发性内分泌代谢性疾病,其死亡率仅次于肿瘤和心血管病。DM患者的并发症和各种感染与DM患者免疫功能低下密切相关。尤其是1型DM是一种发生于胰岛β细胞的器官特异性自身免疫病[1]。从天然药物中筛选降糖药,已为世界各国关注。大量药理及临床研究表明,野生仙人掌多糖(Opuntia dillenii Haw.polysaccharides,ODPs)具有降血糖等功效,并由本实验室证实[2-3],但其机理研究得较少。而研究证实多糖的免疫活性是其最重要的活性之一[4-5]。本研究建立复合型DM小鼠模型,从免疫学角度探讨ODPs治疗DM的机理,以期为ODPs临床应用及功能性食品的研发提供参考。
1 材料
1.1 药品与试剂
新鲜仙人掌采自湛江东海岛,由湛江师范学院陈燕副教授鉴定为Opuntia dillenii Haw.。ODP-I为本实验室分离纯化得到的ODPs的主要组分[3],经苯酚-硫酸法测定多糖含量为92.44%,不含蛋白质核酸等,微量凯氏定氮法测定总氮含量为0.152%,具有显著降血糖活性。链脲佐菌素(STZ),CALBIOCHEM公司;左旋咪唑片,广东南国药业有限公司;绵羊红细胞(SRBC),金华市康大试剂公司,用时无菌吸取,按常规方法制备;注射用环磷酰胺(Cyclophosphamide,Cy),山西普德药业有限公司;血糖检测试剂盒,上海荣盛生物技术有限公司;NO试剂盒,南京建成生物有限公司;鸡红细胞(CRBC)悬液,从市售健康鸡抽取静脉血,按常规方法制备;豚鼠血清(补体),羊抗小鼠IgG,北京鼎国公司;GVB2+稀释液、淋巴细胞分离液,国药集团化学试剂有限公司;细胞培养液RPMI 1640,Gibco公司,用时加入10%小牛血清,100 u/mL青霉素,100 μg/mL 链霉素,0.01 mol/L 谷氨酰胺;小牛血清,上海广茂生物有限公司;刀豆蛋白(ConA),四甲基偶氮唑盐(MTT),华美生物有限公司;2-巯基乙醇(2-ME),脂多糖(LPS),Sigma公司;二甲亚砜(DMSO),天津科密欧化学试剂开发中心;T淋巴细胞亚群试剂盒,晶美公司;其他试剂均为国产分析纯。
1.2 仪器
TU1800S紫外可见光分光光度计,北京普析通用仪器有限责任公司;ANALYTECH_738 PLUS半自动生化分析仪,上海安泰分析仪器有限公司;eppendorf台式高速冷冻离心机;Bio-rad 450型酶标仪。
1.3 动物
健康昆明种小鼠(KM小鼠),雄性,25~29 g,清洁级,广东医学院动物中心,标准:GB14925-2001。
2 方法
2.1 动物分组和给药
[6-7],KM小鼠62只,随机分组,除模型组12只外,其余各组每组10只,并按照本实验室方法[3]进行管理应用。设模型组,ODP-I低、中、高剂量组,阳性对照组和正常组。除正常组外其余各组第1 天腹腔注射30 mg/kg STZ 溶液(pH 4.0,0.1 mol/L柠檬酸钠缓冲液配制,0.22 μm微孔滤膜过滤除菌,0℃保存),第2和第3天腹腔注射60 mg/kg STZ溶液,每次注射前禁食12 h,第3次注射后48 h尾部采血测血糖浓度,以血糖值≥12 mmol/L为造模成功(血糖值<12 mmol/L的小鼠可禁食12 h,再次腹腔注射60 mg/kg STZ溶液),注射后48 h测血糖浓度,同时开始灌胃给药。低、中、高剂量组灌胃ODP-I剂量分别为100,200,400 mg/(kg·d),模型组、正常组灌胃等量生理盐水,阳性对照组灌胃30 mg/(kg·d)左旋咪唑,1次/d。灌胃给药16 d后除正常组外均注射100 mg/kg Cy。
2.2 DM小鼠模型的评价
开始灌胃后第8天再次测全部小鼠的血糖值。同时每天观察小鼠饮水、摄食、排尿情况,每周称体重3次。记录各组小鼠灌胃25 d内的死亡率。
2.3 ODP-I对DM小鼠血清NO含量影响的测定
动物分组及给药方法同2.1项。灌胃25 d后,摘眼球取血处死小鼠。收集的血静置1 h,2 500 r/min离心10 min,血清-20℃保存备用。NO的测定按试剂盒说明进行。
2.4 ODP-I对DM小鼠腹腔巨噬细胞吞噬功能的测定
动物分组及给药方法同2.1项。灌胃22 d后,每只小鼠腹腔注射6%淀粉肉汤1.0 mL,3 d后,每只小鼠腹腔注射5%CRBC 0.2 mL。30 min后,腹腔注射生理盐水2.0 mL,轻揉腹部边缘,用注射器吸取腹腔液涂片,显微镜下计数及照相,对照片再进行计数,计算吞噬百分率。吞噬率(%)=(吞噬CRBC的巨噬细胞数/计数的巨噬细胞数)×100%。
2.5 ODP-I对DM小鼠体液免疫功能影响的测定
动物分组及给药方法同2.1项,灌胃19 d后每鼠腹腔注射20%SRBC 0.2 mL致敏,6 d后再次注射。第26天时摘眼球取血制备血清。按照文献方法[8]测定血清各型溶血素含量(Hemolysin concentration,HC),包括 IgM溶血素(HCIgM)和 IgG溶血素(HCIgG)。
2.6 ODP-I对DM小鼠细胞免疫功能影响的测定
按2.1分组灌胃25 d后,摘眼球取血处死,分组用75%乙醇浸泡5 min,换75%乙醇再泡5 min。无菌操作取脾脏,用完全RPMI 1640培养液制备2.0×106个/mL的脾细胞悬液,台盼兰检测活细胞>95%以上,备用。在超净工作台上,将脾细胞悬液加入96孔板,每孔100 μL,共加2块板。一块板前3行每孔再加入 ConA 溶液10 μL(终浓度5 μg/mL)和完全RPMI 1640培养液90 μL,每组小鼠各做6复孔,观察T细胞增殖反应;中间4行每孔再加入LPS溶液10 μL(终浓度10 μg/mL)和完全RPMI 1640培养液90 μL,每组小鼠各做8复孔,观察B细胞增殖反应;最后一行每孔只加完全RPMI 1640培养液200 μL做空白对照。另一块板每孔再加入完全RPMI 1640培养液100 μL,每组小鼠各做10复孔,并做3个复孔的空白对照,观察小鼠淋巴细胞自然增殖反应。将两块板于37℃,5%CO2培养箱中温育72 h,用MTT法于酶标仪测定570 nm波长处的吸光度(A)值。用加ConA孔的A值减去不加ConA孔的A值表示T淋巴细胞的增殖能力,用加LPS孔的A值减去不加LPS孔的A值表示B淋巴细胞的增殖能力。
外周血T淋巴细胞亚群的检测按2.1项分组灌胃25 d后摘眼球取血,按照文献方法[9]操作,磷酸盐缓冲液(PBS)洗3次后用流式细胞仪检测。
2.7 统计学处理
数据用(x±s)表示,采用SAS统计软件进行统计分析,进行t检验。
3 结果
3.1 DM小鼠模型的评价
注射STZ 3次后48 h测血糖,66.7%小鼠血糖值>12 mmol/L。血糖值<12 mmol/L的小鼠禁食12 h,再一次腹腔注射60 mg/kg STZ溶液,48 h后测血糖,80%小鼠血糖值>12 mmol/L。开始灌胃后第8天后再次测全部小鼠的血糖值,均>12 mmol/L,其中90%小鼠血糖值>13 mmol/L,60%小鼠血糖值>20 mmol/L。最后一次注射完STZ后的第7天开始,小鼠出现“三多一少”症状。注射Cy后第3天饮水量和排尿量出现倒置,即模型组和低剂量组小鼠的饮水量、排尿量明显少于中、高剂量组和阳性对照组。模型组、各剂量组、阳性对照组的体重明显小于正常组(P<0.05)。灌胃ODP-I 25 d后,模型组和低、中剂量组小鼠精神明显不振,患胰岛炎的比率均达到80%以上,高剂量组患胰岛炎的比率较低,为40%左右。正常组和高剂量ODP-I组小鼠死亡率为0,而模型组、阳性对照组和低、中剂量组小鼠死亡率分别为41.7%,20%,30%和 30%。
3.2 ODP-I对DM小鼠血清NO的影响
由表1可知,模型组NO水平显著高于正常组(P<0.05)。低、中、高剂量组血清NO水平低于模型组,呈量效关系。其中高剂量组血清NO水平显著低于模型组(P<0.05),与正常组血清NO水平相当。低、中剂量组血清NO水平与模型组相比,差异不显著(P >0.05)。
3.3 ODP-I对DM小鼠非特异性免疫功能的影响
由表1可知,模型组比正常组吞噬率低,有显著性差异(P<0.05),说明本实验STZ诱导的DM模型小鼠免疫功能低下。与模型组相比,高剂量组可极显著提高小鼠巨噬细胞吞噬CRBC的能力(P<0.01),有明显的量效关系,其中高剂量组吞噬率远远超过正常组,而低剂量组吞噬率低于模型组(P<0.01)。
3.4 ODP-I对DM小鼠血清IgM、IgG含量的影响
由表1可知,与模型组相比,各剂量组和阳性对照组均显著促进小鼠血清IgM的生成(P<0.05),中、高剂量组有极显著性差异(P<0.01)。高剂量组小鼠血清IgG的含量明显增加,较模型组有显著性差异(P<0.05),与正常组相当;而低、中剂量组、阳性对照组小鼠血清IgG的含量与模型组相比,差异不显著(P >0.05)。
表1 ODP-I对DM小鼠巨噬细胞吞噬能力和血清NO、IgM、IgG含量的影响(± s,n=6)Tab.1 Effect of ODP-I on phagocytosis of macrophage,and serum NO,IgM and IgG levels of diabetic mice(± s,n=6)
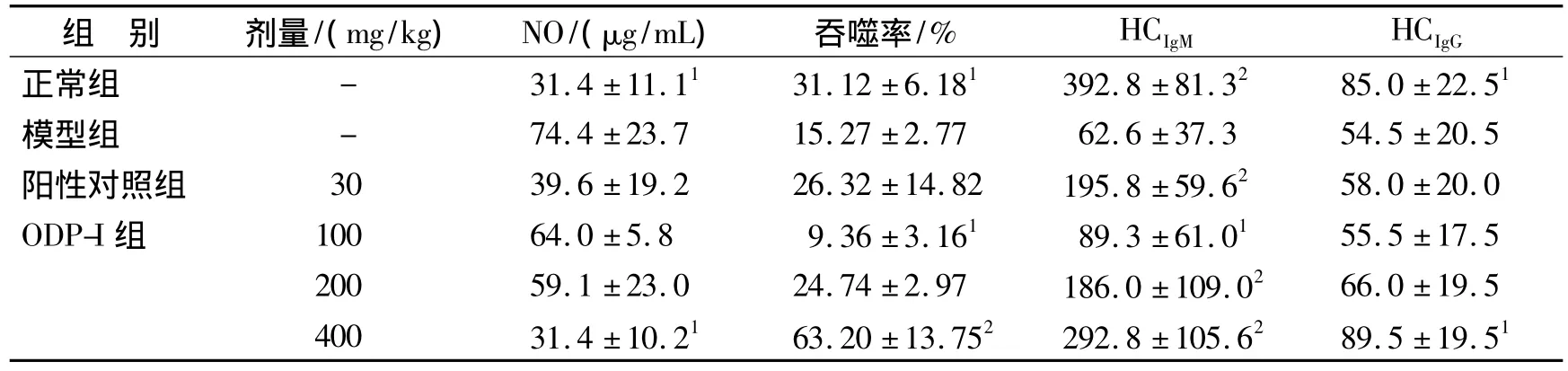
表1 ODP-I对DM小鼠巨噬细胞吞噬能力和血清NO、IgM、IgG含量的影响(± s,n=6)Tab.1 Effect of ODP-I on phagocytosis of macrophage,and serum NO,IgM and IgG levels of diabetic mice(± s,n=6)
与模型组比较:1P <0.05,2P <0.01Compared with model group:1P <0.05,2P <0.01
组 别 剂量/(mg/kg) NO/(μg/mL) 吞噬率/% HCIgM HCIgG正常组 - 31.4±11.11 31.12 ±6.181 392.8 ±81.32 85.0 ±22.51模型组 - 74.4±23.7 15.27 ±2.77 62.6 ±37.3 54.5 ±20.5阳性对照组 30 39.6 ±19.2 26.32 ±14.82 195.8 ±59.62 58.0 ±20.0 ODP-I组 100 64.0 ±5.8 9.36 ±3.161 89.3 ±61.01 55.5 ±17.5 200 59.1 ±23.0 24.74 ±2.97 186.0 ±109.02 66.0 ±19.5 400 31.4 ±10.21 63.20 ±13.752 292.8 ±105.62 89.5 ±19.51
3.5 ODP-I对DM小鼠脾淋巴细胞增殖的影响
显微镜下观察发现,模型组、低、中剂量组、阳性对照组刚分离的淋巴细胞体积增大,而高剂量组、正常组刚分离的淋巴细胞体积较小。
由表2可知,与模型组相比,中、高剂量组和阳性对照组脾淋巴细胞自然增殖能力显著增强(P<0.05),其中高剂量组、阳性对照组和正常组达极显著性水平(P<0.01)。与模型组相比,各组T、B淋巴细胞增殖能力均较高,其中高剂量组均达显著性水平(P <0.05),与正常组相当。
表2 ODP-I对DM小鼠脾淋巴细胞增殖的影响(± s,n=6)Tab.2 Effect of ODP-I on spleen lymphocyte proliferation of diabetic mice(± s,n=6)
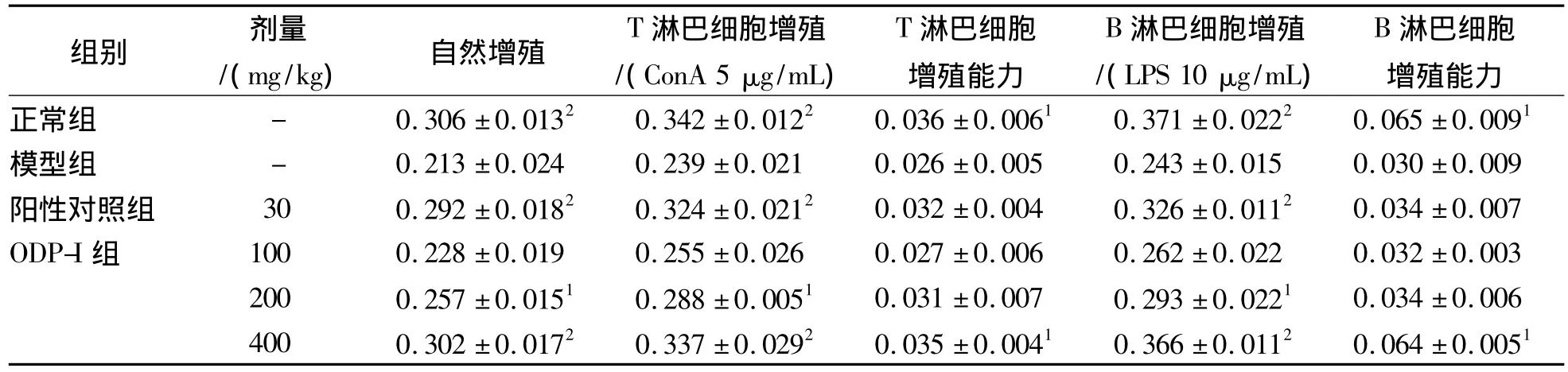
表2 ODP-I对DM小鼠脾淋巴细胞增殖的影响(± s,n=6)Tab.2 Effect of ODP-I on spleen lymphocyte proliferation of diabetic mice(± s,n=6)
与模型组比较:1P <0.05,2P <0.01Compared with model group:1P <0.05,2P <0.01
组别 剂量/(mg/kg) 自然增殖T淋巴细胞增殖/(ConA 5 μg/mL)T淋巴细胞增殖能力B淋巴细胞增殖/(LPS 10 μg/mL)B淋巴细胞增殖能力正常组 - 0.306±0.0132 0.342 ±0.0122 0.036 ±0.0061 0.371 ±0.0222 0.065 ±0.0091模型组 - 0.213±0.024 0.239 ±0.021 0.026 ±0.005 0.243 ±0.015 0.030 ±0.009阳性对照组 30 0.292 ±0.0182 0.324 ±0.0212 0.032 ±0.004 0.326 ±0.0112 0.034 ±0.007 ODP-I组 100 0.228 ±0.019 0.255 ±0.026 0.027 ±0.006 0.262 ±0.022 0.032 ±0.003 200 0.257 ±0.0151 0.288 ±0.0051 0.031 ±0.007 0.293 ±0.0221 0.034 ±0.006 400 0.302 ±0.0172 0.337 ±0.0292 0.035 ±0.0041 0.366 ±0.0112 0.064 ±0.0051
3.6 ODP-I对DM小鼠外周血T淋巴细胞亚群的影响
由表3可知,本研究建立的DM动物模型CD8+T细胞比例显著减少,CD4+T/CD8+T细胞比值显著升高。与模型组相比,各剂量组的CD4+T细胞比例差异不显著,CD8+T细胞比例增加,CD4+T/CD8+T细胞比值下降。其中高剂量组CD4+T细胞比例、CD8+T细胞比例及CD4+T/CD8+T细胞比值均与正常组相当。
表3 ODP-I对DM小鼠外周血CD4+和CD8+T细胞的影响(± s,n=6)Tab.3 Effect of ODP-I on CD4+and CD8+T cell of peripheral blood of diabetic mice(± s,n=6)

表3 ODP-I对DM小鼠外周血CD4+和CD8+T细胞的影响(± s,n=6)Tab.3 Effect of ODP-I on CD4+and CD8+T cell of peripheral blood of diabetic mice(± s,n=6)
与模型组比较:1P<0.05Compared with model group:1P <0.05
组 别 剂量/(mg/kg)CD4+/% CD8+/% CD4+/CD8+正常组 - 21.63±1.56 11.05±3.461 2.11±0.681模型组 - 22.73±1.86 5.53±2.00 3.37±0.86阳性对照组 30 14.76 ±1.941 5.26 ±0.42 2.88 ±0.42 ODP-I组 100 20.02 ±0.94 6.02 ±0.54 3.35 ±0.26 200 21.39 ±3.34 7.01 ±0.27 3.07 ±0.61 400 20.50 ±1.39 10.27 ±1.521 2.02 ±0.321
4 讨论
已有研究结果表明,DM患者胰岛β细胞破坏主要由自身免疫性组织相容性复合体Ⅰ类制性T细胞引起,并与巨噬细胞有关。其中巨噬细胞不仅通过抗原递呈作用介导DM,而且其产生的NO可直接发挥细胞毒作用损伤胰岛β细胞。血清NO含量代表体内NO水平,高浓度NO是损伤β细胞的终末因子[10]。本研究发现高剂量 ODP-I可调节 NO至正常水平。
单核巨噬细胞系统是机体非特异性免疫系统的重要组成部分,能迅速清除多种致病物质,是维持机体内环境稳定的一个重要系统。而单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的标志之一[11]。本研究结果发现DM模型建立22 d后腹腔巨噬细胞吞噬率明显低于正常组,而高剂量组明显高于正常组。但低剂量组显著低于模型组,原因有待考察。
血清溶血实验是动物体液免疫的重要内容,是体液中抗体、补体等免疫因子参与的免疫反应,在免疫抗菌防病中发挥重要作用。血清IgM、IgG的含量在一定程度上能体现机体的体液免疫功能。本研究发现ODP-I能显著提高IgM含量,且使其接近正常水平。高剂量组小鼠血清IgG含量也显著增加,也与正常组相当。
淋巴细胞增殖反应是非常重要的免疫指标,尤其T淋巴细胞增殖反应是反映T细胞功能和机体细胞免疫功能的主要指标之一。本实验结果显示,高剂量ODP-I均显著促进了DM小鼠T、B淋巴细胞的增殖,这可能与有丝分裂原ConA和LPS有相似的作用机制,都是对该两种细胞的直接作用。
华觉明:传统工艺是非物质文化遗产的重要组成部分,在国家级非物质文化遗产名录(四批,共1372项)中占四分之一。振兴传统工艺已成为国家战略,传统工艺的学科建设也被提上了议事日程。在这种情势下,有必要对传统工艺的学科定位进行明确的界定。
正常机体中各T淋巴细胞亚群相互作用,维持着机体正常的免疫功能。大量的报道提出,1型DM的发病机制包括辅助性T细胞(Th)活性增强和抑制性T细胞(Ts)细胞缺陷两个方面,造成免疫调节失控和细胞因子不平衡[12-13]。与阳性对照组不同,ODP-I主要通过上调CD8+T细胞比例,使CD4+/CD8+T细胞比值恢复正常,进而改善DM小鼠的免疫紊乱现象。
本研究ODPs是由80%乙醇浸泡7~10 d的完整仙人掌茎片制得的干粉中提取得到。多糖在柱色谱进样及灌胃前都经0.22 μm滤膜过滤。因此可排除脂多糖污染的可能,实验结果并非细菌脂多糖污染而导致的假象。经以上分析,ODP-I可通过提高腹腔巨噬细胞的吞噬能力,调节机体NO的产生,提高体液免疫功能,促进T、B淋巴细胞增殖,改善T淋巴细胞亚群免疫紊乱现象,来增强DM小鼠免疫力,改善DM小鼠的症状,提高存活率。其免疫调节作用效果比提高免疫力的阳性对照药左旋咪唑好,有望作为临床辅助药物治疗DM[14]。
参考文献:
[1]陈维军,宋方方,刘烈刚,等.罗汉果皂甙提取物对1型糖尿病小鼠细胞免疫功能的影响[J].营养学报,2006,28(3):221-225.
[2]Yang N,Zhao M M,Zhu B H,et al.Anti-diabetic effects of polysaccharides from Opuntia megacantha cladode in normal and streptozotocin-induced diabetic rats[J].Innov Food Sci Emerg,2008,9:570-574.
[3]Zhao L Y,Lan Q J,Huang Z C,et al.Antidiabetic effect of a newly identified component of Opuntia dillenii polysaccharides[J].Phytomedicine,2011,18:661-668.
[4]Schepetkin I A,Xie G,Kirpotina L N,et al.Macrophage immunomodulatory activity of polysaccharides isolated from Opuntia polyacantha[J].Int Immunopharmacol,2008,8:1455-1466.
[5]卞 俊,储智勇,鲍蕾蕾,等.孔石莼多糖对小鼠免疫功能的影响[J].中国生化药物杂志,2006,27(5):276-279.
[6]Harada M,Makino S.Promotion of spontaneous diabetes in nonobese diabetes-prone mice by cyclophosphamide[J].Diabetologia,1984,27:604-606.
[7]于德民,吴 锐,尹 潍,等.实验性链脲佐菌素糖尿病动物模型的研究[J].中国糖尿病杂志,1995,3:105.
[8]藏星星,钱伯初.溶血素类型和含量的分光光度测定法[J].药学学报,1987,22(4):301-304.
[9]Li J,Li Q W,Gao D W,et al.Antitumor and immunomodulating effects of polysaccharides isolated from Solanum nigrum Linne[J].Phytother Res,2009,23(11):1524-1530.
[10]Im S A,Kim K,Lee C K.Immunomodulatory activity of polysaccharides isolated from Salicornia herbacea[J].Int Immunopharmacol,2006,6(9):1451-1458.
[11]Kim J H,Park J S.Potentiation of the immunotoxicity of ethanol by acetaminophen in mice[J].Int Immunopharmacol,2002,2(1):15-24.
[12]Pahwa S,Read J S,Yin W,et al.CD4+/CD8+T cell ratio for diagnosis of HIV-1 infection in infants:Women and Infants[J].Pediatrics,2008,122(2):331-339.
[13]Koretzky G A.Multiple roles of CD4 and CD8 in T cell activation[J].J Immunol,2010,185(5):2643-2644.
[14]曾富华,赵龙岩,饶力群.仙人掌多糖研究进展与开发利用前景[J].中国生化药物杂志,2011,32(5):411-414.
