麻醉剂量异丙酚对缺血性脑损伤大鼠的神经保护作用研究
2012-07-13广东省清远市佛冈县中医院511600邱小春
广东省清远市佛冈县中医院(511600) 邱小春
广 州 中 医 药 大 学 黄伟新
临床上多种心脑血管疾病的手术(如心脏瓣膜手术、颈动脉内膜剥脱术等)均有较高的发生脑缺血性损伤的风险,如何有效地降低或避免此类风险是目前研究的热点之一。异丙酚能降低脑血流量、脑耗氧量及颅内压力,是临床上常用的静脉麻醉药。有研究表明[1],其对脑缺血性损伤具有一定的保护作用,但其起保护作用的机制尚不明确。本研究通过检测脑缺血性损伤大鼠血清乳酸脱氢酶(LDH)及神经元特异性烯醇化酶(NSE)含量,探讨其可能的保护机制。
1 实验材料
健康的SD大鼠40只,雌雄兼用,体重250~300g,月龄3~4个月,由广东省医学实验动物中心提供(动物合格证号:SCXY(粤)2003-0001)。实验前,所有大鼠在实验室喂养2~3天以适应实验室环境。10%水合氯醛由本院药剂室配制。HR-120天平(常熟市衡器厂),-20℃冰箱(日本novu m),恒温孵箱,台式离心机(日本三洋公司),7060-020型全自动生化分析仪(日立公司),动脉夹(宁波医用缝针厂),丝线(0号手术缝合线),尼龙线(上海强生公司),异丙酚(英国阿斯利康公司),乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所),神经元特异性烯醇化酶(NSE)试剂盒(武汉博士德生物工程有限公司)。
2 方 法
2.1 实验方法 实验采用改良后尼龙线栓塞法[2](即Longa线栓法)制作大鼠缺血性脑损伤模型。将长40mm、直径0.26mm的尼龙线一端用酒精灯加热为光滑的直径0.40mm球形,在距离球形2cm处用黑色油性笔标记,使用细砂纸打磨使球形端光滑、钝圆,用75%酒精擦净置于生理盐水备用。将大鼠以10%水合氯醛(4mL/kg)腹腔注射,待翻正反射消失后,仰卧固定,剪去颈部被毛,碘伏消毒局部皮肤,于颈部正中做一长约2cm纵行切口,暴露并钝性游离右侧颈总动脉(CCA),置线备用;向上分离颈内动脉(ICA)及颈外动脉(ECA),用无创动脉夹分别夹闭CCA近心端和ICA远端,ECA和ICA分叉处置一丝线,打活结,在距ECA起始处1cm结扎ECA主干,切断颈外动脉使之游离,并将颈内、外动脉交角拉成直线。在ECA残端0.5cm处剪一微小切口,将备用尼龙线球形端从ECA插入,缓缓推进,经CCA分叉处进入ICA扎紧活结,松开动脉夹。线栓插入深度以大鼠TC线(门齿中缝距离颈动脉分叉点的连线)为参考(其中以TC=39mm,深度17mm为基准调整)。逐层缝合手术切口,切口外留1.0cm长的线栓,碘伏消毒伤口。术后2小时将尼龙线轻轻向外拔出,遇阻力即停止,此时尼龙线球形端已经退至ECA残端,大鼠大脑中动脉可恢复供血,实现再灌注。对照组于造模缺血前10分钟腹腔注入生理盐水,治疗组于造模缺血前10分钟腹腔注入麻醉剂量的异丙酚。术中用37℃恒温加热垫保暖,术后将大鼠置于32℃的恒温孵箱3h,然后置于笼中自然条件饲养,光线及湿度适中。
2.2 实验分组及处理 将40只健康SD大鼠随机分为两组,对照组(对照组)20只,治疗组(异丙酚组)20只。其中对照组在缺血前10分钟腹腔注射生理盐水(110mg/kg),治疗组在缺血前10分钟腹腔注射异丙酚[3](110mg/kg)。
2.3 指标测定 LDH和NSE测定:每只大鼠眼眶取血2mL,离心分离取血清,置于-20℃冰箱内保存,采用ELISA法测定LDH和NSE含量。
2.4 神经功能评分 两组大鼠在再灌注后24小时,由不了解分组情况的观察者采用Longa 5级评分标准[4]评定动物神经系统损伤情况:0级,正常活动,无神经功能缺损;1级,将大鼠尾巴提起,瘫痪侧前肢不能充分伸展;2级,大鼠有向瘫痪侧侧旋的行为;3级,大鼠向瘫痪侧倾倒;4级,无自主活动,有意识障碍。
2.5 统计学分析 计量资料符合正态分布者采用(±s)表示,两组间比较采用成组t检验;计数资料采用率(%)或构成比表示,两组间比较采用χ2检验。检验水平α=0.05。数据库建立及分析在SPSS 18.0统计软件包上实现。
3 结 果
3.1 两组大鼠神经功能损伤情况比较 见表1。由表1可知,经异丙酚预处理后的治疗组,大鼠出现神经损伤的情况较对照组明显减少,差异具有显著性(P<0.05)。
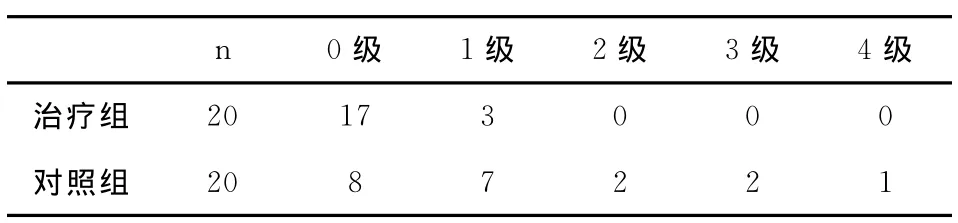
表1 Longa5级评分标准评定24小时大鼠神经功能损伤情况(例)
3.2 两组大鼠LDH、NSE水平的比较 治疗组LDH(794.05±248.9)U/L,NSE(10.53±6.12)μg/L;对照组 LDH(1478.21±279.5)U/L,NSE(19.34±8.75)μg/L。经过异丙酚预处理的大鼠,LDH、NSE水平明显低于对照组,差异具有显著性(P<0.05)。
4 讨 论
围手术期脑血管并发症是神经外科、心脏及大血管等手术的常见问题,其发生的主要机制是脑缺血性损伤,目前临床仍缺乏有效的预防方法。异丙酚是一种静脉麻醉药,广泛应用于外科手术患者的麻醉和重症监护室患者的镇静。研究表明,异丙酚具有潜在的神经保护作用,其作用机制可能有以下几个方面:1)降低脑血流、脑代谢率和颅内压[5]。2)清除自由基,降低脂质过氧化物[6]。3)增强氯离子内流和细胞膜超极化[7]。4)减少谷氨酸的释放,增加谷氨酸的吸收,同时抑制谷氨酸受体[8]。
脑缺血性损伤在细胞水平主要表现为脑神经元的坏死。LDH是机体一种重要的存在于胞质氧化还原酶,广泛存在于神经元及神经胶质细胞胞浆中。当发生脑缺血性损伤时,三磷酸腺苷(ATP)耗竭,引起钙超载、膜通透性增高、自由基增加等病理改变,导致细胞坏死,使LDH从胞内漏出增多,血中LDH活性增高。因此,血清LDH是反映细胞活性功能的敏感生化指标之一,可以作为细胞损伤的标志[9]。本研究结果显示,两组大鼠造模后LDH均升高,而治疗组(经异丙酚预处理)LDH水平明显低于对照组LDH水平(P<0.05),提示异丙酚可能通过清除自由基、稳定细胞膜等机制增加细胞对缺血的耐受性,降低细胞坏死,从而发作神经保护作用。
烯醇化酶是普遍存在于生物体细胞浆的一种糖酵解代谢酶,而NSE特异地存在于脑神经细胞和神经内分泌细胞中,神经胶质细胞和其他脑神经组织均不含NSE,因此NSE可作为神经元损伤的敏感指标。正常情况下体液中NSE含量很低,当发生脑缺血性损伤,神经细胞受损情况下,NSE从神经元中漏出,进入细胞间隙和脑脊液中,同时可通过受损血脑屏障进入血液,使脑脊液和血清中NSE含量升高,并与病情的轻重相关[10]。本研究结果显示,治疗组(经异丙酚预处理)NSE水平明显低于对照组NSE水平(P<0.05),提示异丙酚可以保护细胞的完整性,减少NSE漏出,从而减轻脑缺血性损害。
虽然多数研究证明,异丙酚具有神经保护作用,但在异丙酚有效剂量方面仍存在分歧。有的研究表明[11],静脉单次注射10mg/kg的异丙酚或静脉持续输注16mg/(kg·h)的异丙酚均未能有效保护脑组织。另又有研究[12]发现,5mg/kg或10mg/kg的异丙酚静脉注射可有效降低永久性大脑中动脉阻塞大鼠的脑梗死面积、脑梗死体积、降低脑水肿。本研究采用麻醉剂量(110mg/kg)异丙酚预处理脑缺血损伤大鼠,从神经功能损伤情况、LDH、NSE等方面均证实,此剂量的异丙酚能保护脑神经。
综上所述,麻醉剂量异丙酚能有效抑制LDH、NSE的升高程度,降低神经损伤因子的表达,改善脑缺血后的神经功能损伤情况,说明异丙酚具有神经保护作用,其作用机制可能与清除自由基、稳定细胞膜等有关。
[1] Ozturk E,Demirbilek S,Koroglu A,et al.Propofol and erythropoietin antioxidant properties in rat brain injured tissue[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(1):81
[2] 武强,武文元,王涛.改良线栓法制备大鼠局灶性脑缺血/再灌注模型的实验研究[J].中国临床神经外科杂志,2009,14(3):162
[3] Lei Xiuzhen XY.Protective effects of propofol on focal ischemia-reperfusion Injury in rats[J].Zhejiang Journal of Preventive Medicine,2007,(11):438
[4] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84
[5] Koerner IP,Brambrink AM.Brain protection by anesthetic agents[J].Curr Opin Anaesthesiol,2006,19(5):481
[6] Sagara Y,Hendler S,Khoh-Reiter S,et al.Propofol hemisuccinate protects neuronal cells from oxidative injury[J].J Neurochem,1999,73(6):2524
[7] Ito Y,Izumi H,Sato M,et al.Suppression of parasympathetic reflex vasodilatation in the lower lip of the cat by isoflurane,propofol,ketamine and pentobarbital:implications for mechanisms underlying the production of anaesthesia[J].Br J Anaesth,1998,81(4):563
[8] Sitar SM,Hanifi-Moghaddam P,Gelb A,et al.Propofol prevents peroxide-induced inhibition of glutamate transport in cultured astrocytes[J].Anesthesiology,1999,90(5):1446
[9] Steen E,Terry BM,Rivera EJ,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease is this type 3diabetes[J].J Alzheimers Dis,2005,7(1):63
[10] 王琨,李彦敏.NSE、S-100蛋白与脑损伤关系的研究[J].脑与神经疾病杂志,2009,17(5):396
[11]Tsai YC,Huang SJ,Lai YY,et al.Propofol does not reduce infarct volume in rats undergoing permanent middle cerebral artery occlusion[J].Acta Anaesthesiol Sin,1994,32(2):99
[12] Kotani Y,Nakajima Y,Hasegawa T,et al.Propofol exerts greater neuroprotection with disodium edetate than without it[J].J Cereb Blood Flow Metab,2008,28(2):354
