Bmi-1和EZH2基因在皮肤血管瘤组织中的表达及意义
2012-07-05张端莲
刘 涓 王 赟 张端莲
(1武汉大学人民医院老年病科,武汉 430060;2中国人民解放军95825部队医院 湖北432111;3武汉大学基础医学院人体解剖与组织胚胎学系,武汉430071)
皮肤血管瘤是婴幼儿时期常见的一种良性肿瘤,其发生率约为1%-12%不等[1-2]。虽然皮肤血管瘤是一种良性肿瘤,但其病理变化主要是由于血管内皮细胞异常增殖,因此有部分皮肤血管瘤生长迅速,可引起容貌缺陷和局部畸形,往往给患者及其家人带来极大痛苦,但关于血管瘤的发病机制,目前还没有明确的说法,因此对于皮肤血管瘤的临床治疗也是目前急待解决的关键问题。
多梳基因家族(PcG)具有高度保守性,除能抑制其下游靶基因转录外[3],还能调节干细胞自我更新,参与细胞分化,在胚胎发育、肿瘤发生及干细胞维持中发挥重要作用[4-6]。Bmi-1、EZH2 同 属 于PcG家族,并在PcG家族中起核心作用。
本文应用免疫组织化学方法和图像分析技术检测了血管瘤增生期、退化期以及正常皮肤组织中Bmi-1和EZH2的表达水平,探讨Bmi-1和EZH2在血管瘤发生、发展过程中的作用机制,为临床上治疗血管瘤提供实验依据。
材料和方法
1.材料
1.1 材料来源
收集武汉大学人民医院病理科2008年-2011年皮肤毛细血管瘤存档蜡块40例,其中男性15例,女性25例。这些血管瘤所在的部位有头皮、前额、眼睑、耳背、颈部、背部、上臂、大腿、手和足的皮肤等。患者术前均未做任何辅助性治疗。
1.2 材料分组
将所有标本进行免疫组织化学S-P法检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),按Mulliken分类标准并结合PCNA的表达进行分组:石蜡标本中增生期血管瘤22例,退化期血管瘤18例。另取距瘤组织5cm外的周围正常皮肤组织5例作对照。
1.3 主要试剂
即用型鼠抗人PCNA单克隆抗体、鼠抗人Bmi-1和EZH2单克隆抗体(购于北京中杉生物技术有限公司);超敏即用型SP通用型免疫组织化学试剂盒(购于福州迈新公司);DAB显色试剂盒及多聚赖氨酸(购于北京中杉生物技术有限公司)。
2方法
2.1 免疫组织化学SP法检测Bmi-1、EZH2和PCNA相关抗原
具体步骤:(1)4μm组织切片常规脱蜡入水;(2)抗原修复(柠檬酸缓冲液微波抗原修复法);(3)滴加3%过氧化氢,37℃湿盒孵育10min以抑制内源性过氧化物酶活性;(4)正常羊血清37℃湿盒孵育10min以减少非特异性背景;(5)分别滴加一抗(PCNA:1:100;Bmi-1:1:200;EZH2:1:150);(6)滴加链霉素抗生物素蛋白-过氧化物复合物37℃湿盒孵育;(7)滴加新鲜配置的DAB显色液显色;(8)苏木素复染;(9)梯度酒精脱水,二甲苯透明,中性树胶封片并镜检;(10)用PBS代替一抗作为阴性对照组,购买的阳性片作为Bmi-1和EZH2的阳性对照组,人正常皮肤表皮作为PCNA的阳性对照组。
2.2 免疫组织化学结果判断
(1)Bmi-1和EZH2都是以细胞核或胞质出现棕黄色颗粒为阳性反应,PCNA以细胞核出现棕黄色颗粒为阳性反应。阴性对照组除细胞核染成蓝色外,应无棕黄色反应物。
(2)采用HPIAS-1000高清晰度彩色病理图文报告管理系统(同济千屏影像公司)对Bmi-1和EZH2的表达进行定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性反应的平均光密度、阳性反应面积和所有细胞总面积,计算阳性面积率。以每例5个视野的平均光密度、阳性面积率的平均值作为该例的测量值。(阳性面积率=单位面积中阳性反应的总面积/单位面积中细胞的总面积×100%)
2.3 统计学处理
数据以均数±标准差(±s)表示,用SPSS11.5软件对各组免疫组织化学反应阳性颗粒的平均光密度、阳性面积率做单因素方差分析和SNK(q)检验,检验水准α为0.05。
结 果
1.PCNA的表达
增生期血管瘤内皮细胞核肥大,核内弥漫分布棕黄色颗粒,PCNA表达强(图1);退化期血管瘤内皮细胞核扁平,胞核内有少量棕黄色颗粒,PCNA表达弱(图2)。
2.Bmi-1的表达
增生期血管瘤内皮细胞核或胞质内有较多棕黄色颗粒,Bmi-1呈高表达(图3);退化期血管瘤内皮细胞胞核或胞浆内有少量的棕黄色颗粒,Bmi-1呈低表达(图4);正常皮肤组织内皮细胞核或胞浆内有少量的棕黄色颗粒,Bmi-1呈低表达(图5)。图像分析结果见表1。增生期组Bmi-1的表达明显高于退化期组和正常皮肤组织组(P<0.05),而后两组比较差异无统计学意义(P>0.05)(表1)。
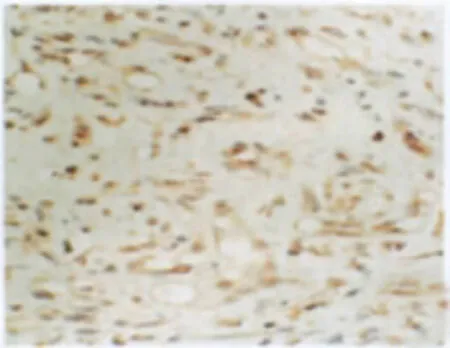
图1 增生期血管瘤PCNA的表达 增生的内皮细胞核内弥漫分布棕黄色颗粒(→),PCNA表达强,S-P×400Fig.1 PCNA expression in proliferating hemangioma.There were plenty of brown particles in the nucleus of proliferating endothelial cells,which showed PCNA expressed strongly(→).S-P×400

图2 退化期血管瘤PCNA的表达 内皮细胞核内有少量棕黄色颗粒(→),PCNA表达弱,S-P×400Fig.2 PCNA expression in involuting hemangioma.There were few brown particles in the nucleus of less endothelial cells,which showed PCNA expressed weakly(→).S-P×400
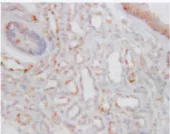
图3 增生期血管瘤Bmi-1的表达 内皮细胞胞浆内有较多棕黄色颗粒(→),Bmi-1表达强,S-P×400Fig.3 Bmi-1expression in proliferating hemangioma.There were plenty of brown particles in cytoplasm the of proliferating endothelial cells,Bmi-1expressed strongly(→).S-P×400

图4 退化期血管瘤Bmi-1的表达 内皮细胞胞浆内有少量棕黄色颗粒(→),Bmi-1表达弱,S-P×400Fig.4 Bmi-1expression in involuting hemangioma.There were few brown particles in cytoplasm the of involuting endothelial cells,Bmi-1expressed weakly(→).S-P×400

图5 正常对照组Bmi-1的表达 内皮细胞胞浆内有少量棕黄色颗粒(→),Bmi-1表达弱,S-P×400Fig.5 Bmi-1expression in normal skin Group.There were few brown particles in cytoplasm the of in normal skin endothelial cells,Bmi-1expressed weakly(→).S-P×400
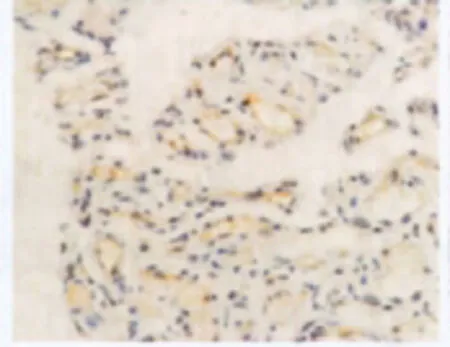
图6 增生期血管瘤EZH2的表达 血管瘤内皮细胞核或胞质内有较多棕黄色颗粒(→),EZH2表达强,S-P×400Fig.6 EZH2expression in proliferating hemangioma.There were plenty of brown particles in cytoplasm the of involuting endothelial cells,EZH2expressed strongly(→).S-P×400
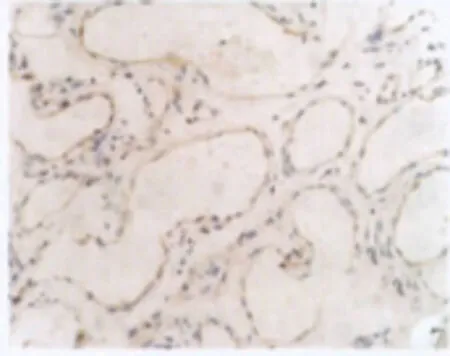
图7 退化期血管瘤EZH2的表达血管瘤内皮细胞胞核或胞质内有较少棕黄色颗粒,EZH2表达弱或无表达(→),S-P×400Fig.7 EZH2expression in involuting hemangioma.There were few brown particles in cytoplasm the of involuting endothelial cells,EZH2expressed weakly(→).S-P×400

图8 正常组EZH2的表达 血管内皮细胞胞核或胞质内有较少棕黄色颗粒,EZH2表达弱或无表达(→),S-P×400Fig.8 EZH2expression in normal skin Group.There were few brown particles in cytoplasm the of in normal skin endothelial cells,EZH2expressed weakly(→).S-P×400
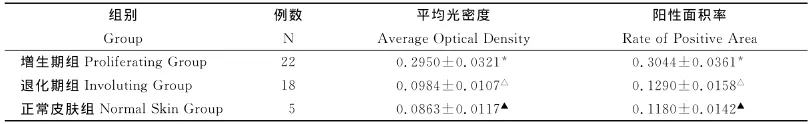
表1 血管瘤不同时期Bmi-1表达的平均光密度和阳性面积率(x¯±s)Table1 The average optical density and the rate of Bmi-1positive area of in differ period of human dermal hemangiomas(x¯±s)
3.EZH2的表达
增生期血管瘤内皮细胞核或胞质内有较多棕黄色颗粒,EZH2表达强(图6);退化期血管瘤内皮细胞胞核或胞质内有较少棕黄色颗粒,EZH2表达弱(图7);正常皮肤组织内皮细胞核或胞质内有少量的棕黄色颗粒,EZH2表达弱(图8)。图像分析结果见表2。增生期血管瘤内皮细胞EZH2的表达显著低于退化期血管瘤内皮细胞和正常组织 (P<0.05),而后两组比较差异无统计学意义(P>0.05)(表2)。
表2 血管瘤不同时期EZH2表达的平均光密度和阳性面积率(±s)Table2 The average optical density and the rate of EZH2positive area of in differ period of human dermal hemangiomas(±s)
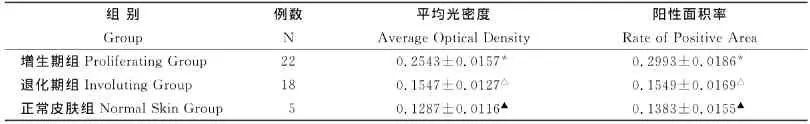
表2 血管瘤不同时期EZH2表达的平均光密度和阳性面积率(±s)Table2 The average optical density and the rate of EZH2positive area of in differ period of human dermal hemangiomas(±s)
*增生期组与退化期组比较,P<0.05;(Comparison between proliferating hemangiomas and involuting hemangiomas)*P<0.05;△退化期组与正常皮肤组比较,P>0.05;(Comparison between involuting hemangiomas and normal skin tissue)△P>0.05;▲正常皮肤组与增生期组比较,P<0.05(Comparison between proliferating hemangiomas and normal skin tissue)▲P<0.05
组别Group例数N平均光密度Average Optical Density阳性面积率Rate of Positive Area增生期组Proliferating Group 22 0.2543±0.0157* 0.2993±0.0186*退化期组Involuting Group 18 0.1547±0.0127△ 0.1549±0.0169△正常皮肤组 Normal Skin Group 5 0.1287±0.0116▲ 0.1383±0.0155▲
讨 论
血管瘤的自然病程包括增生期、退化期和退化完成期三个阶段。目前血管瘤的发病机制还不完全清楚[7-9],尽管多数血管瘤本身不会危及生命,且可能随着年龄增长有消退趋势,然而由于血管瘤的生长往往不同于一般良性肿瘤,在早期特别是在1岁以内具有生长迅速的特点,部分血管瘤可向周围组织呈浸润性生长,而且它的发病部位大多位于头面部体表部位[3],所以它不仅仅可引起容貌缺陷和局部畸形,还往往给患者及其家人带来极大的精神压力和心理负担,此外还有少部分血管瘤因溃烂、感染、出血、阻塞或压迫重要组织器官而加重损伤,甚至可能发生严重的危及生命的并发症。目前关于治疗血管瘤方法的成效并不十分显著,一些治疗模式的显著副作用也限制了其应用。因此探讨皮肤血管瘤的发病机制对临床上治疗血管瘤有着重要的意义。
原癌基因 Bmi-1(B-cell specificMo loney murineleukem ia virus insertion site 1)它属于polycomb家族,直接参与细胞生长、增殖的调节[10]。研究证实人类多种肿瘤,如白血病、乳腺癌、胃癌、肺癌、膀胱癌、大肠癌及食管癌等的发生、发展过程均与 Bmi-1基因表达异常有关[11-13]。
在生物体生长发育过程中,PcG蛋白是基因调控决定细胞命运的组成部分,通过形成巨大的多目标复合物,作用在染色体上的不同位点,致使染色体变构,从而调控基因的表达[14]。PcG蛋白的主要作用目标是Homeotic基因簇,hox基因在决定细胞的定向分化与增殖,以及调控机体组织器官的发育方面起决定性作用。因此,PcG基因,如Bmi-1、Pc2、Cbx7、EZH2的失调与癌细胞的异常增殖密切相关[15],其中的Bmi-1基因与EZH2一起通过形成多蛋白复合体维持hox的抑制状态。
Breuer等在研究支气管鳞癌及癌前病变中Bmi-1表达的相关机制中发现,癌前病变及癌组织中的Bmi-1表达明显高于正常组织,同时伴有P16的低表达EZH2表达增强,推测EZH2可能为Bmi-1在肿瘤发生发展中的一个重要中介产物[16]。
本研究结果显示:在增生期血管瘤组织中Bmi-1、EZH2蛋白表达明显高于正常组织,提示Bmi-1、EZH2基因可能通过调节细胞周期参与了血管瘤的增生过程。同时发现Bmi-1与EZH2蛋白的表达呈正相关,提示Bmi-1和EZH2蛋白可能共同促进了血管瘤的发生和发展,推测其机制可能是两者都抑制HOX基因的转录,通过调控细胞周期、抑制细胞分裂、阻止细胞凋亡等来共同促进血管瘤的发生发展,但具体机制尚不明确,有待进一步探讨。
[1]Jinnin M,Ishihara T,Boye E,et al.Recent progress in studies of infantile hemangioma.The Journal of Dermatology,2010,37(4):283-298
[2]Cm W,A T,C G.HLA system and embryo development.Reprod Biomed Online,2002,4(2):133-139
[3]Ringrose L,Paro R.Epigenetic regulation of cellu-larmemory by thepolycomb and trithorax group proteins.Annu RevGenet,2004,38(11):413-443
[4]Jacobs JJ,Kieboom K,Marino S,et al.The oncogene and Polycomb-group gene bmi-1regulates cell proliferation and senescence through the ink4alocus.Nature,1999,397(6715):164-168
[5]Weikert S,Christoph F,Kollermann J,et al.Expression levels of the EZH2polycomb transcriptional repressor correlate with aggressiveness and invasive potential of bladder carcinomas.Int J Mol Med,2005,16(2):349-353
[6]Jacobs JJ,Scheijen B,Voncken JW,et al.Bmi-1collaborates with c-Myc in tumorigenesis by inhibiting c-Mycinduced apoptosis via INK4a/ARF.GenesDev,1999,13(20):2678-2690
[7]Ito T,Ito N,Saathoff M,et al.Immunology of the Human Nail Apparatus:The Nail Matrix Is a Site of Relative Immune Privilege.J Investig Dermatol.2005,125(6):1139-1148
[8]Blaschitz A,Lenfant F,Mallet V,et al.Endothelial cells in chorionic fetal vessels of first trimester placenta express HLA-G.Eur J Immunol.1997,27(12):3380-3388
[9]Jurisicova A,Casper R F,Maclusky N J,et al.HLA-G expression during preimplantation human embryo development.Proc Natl Acad Sci USA.1996,93(1):161-165
[10]Zhi zhong L,Ru Cao,Ming Wang,et al,Structure of a Bim-1-Ring1BPolycomb Group Ubiquitin Ligase Com-plex.J Biological Chemistry,2006,281(29):20643-20649
[11]Hga K,Ohno S,Yugawa T,et al.Efficient immortalization of primary human cells by p16INK4a-specific short hairp in RNA or Bmi-1,combined with introduction of Htert.Cer Sci,2007,98(2):147-154
[12]Kang MK,Kim RH,Kim SJ,et al.Elevated Bmi-1 expression is associated with dysplastic cell transformation during oral carcinogenesis and is required for cancer cell replication and survival.Br J Cancer,2007,96(1):126-133?
[13]Lee K,Adhikary G,Balasubramanian S,et al.Expression of Bmi-1in epiderm is enhances cell survivalby altering cell cycle regulatory prote in expression and inhibiting apoptosis.J Invest Dermatol,2008,128(1):9-17
[14]Gil J,Bernard D,PetersG.Role of polycomb group proteins in stem cell self-renewal and cancer.DNA Cell Biol,2005,24(2):117-125
[15]FrankM,Raaphorst,Folkert J,et al.Coexpression of BMI-1and EZH2polycomb group genes in Reed-Sternberg cells ofHodgkin's disease.Am J Pathol,2000,157(3):709-715
[16]Breuer RH,Snijders PJ,Sutedja GT,et al.expression of thep16(INK4a)geneproduct,methylation of the p16(INK4a)promoter region and expression of the polycombgroup gene BMI-1in squamous cell lungcarcinom a and premali-gnanten dobronchial lesions.Lung Cancer,2005,48(3):299-306
