维吾尔族妇女子宫颈癌和CIN中miRNA-101的表达及其与HPV的关系*
2012-06-29贠江力古力娜尔库尔班
叶 静,林 晨,贠江力,古力娜尔·库尔班
(新疆医科大学基础医学院病理学教研室,乌鲁木齐830011)
子宫颈癌一直是新疆地区发病率居首位的妇女恶性肿瘤,尤其维吾尔族妇女子宫颈癌的收治比例明显高于其他民族,且发病年龄早,平均年龄为45.04岁(汉族为50.85岁)[1],晚期患者较多。因此,寻找有助于子宫颈癌早期诊断的分子标志物是近年来子宫颈癌研究的热点之一。微小RNA(microRNAs,miRNAs)是一类新发现的内源性非蛋白质编码小RNA分子,有研究发现miRNA可作为筛查肿瘤的早期诊断指标之一[2]。高危型人乳头瘤病毒(human papilomavirus,HPV)是目前公认的子宫颈癌发生的高危因素之一[3]。而关于HPV与miRNA之间是否具有相关性说法不一。因此,本研究应用锁定核苷酸原位分子杂交(LNA-ISH)技术检测新疆维吾尔族妇女子宫颈鳞状细胞癌、宫颈上皮内瘤变(CIN)Ⅰ~Ⅲ级及慢性宫颈炎中miRNA-101的表达,并分析子宫颈鳞状细胞癌中miRNA-101与HPV之间的关系,探讨其在子宫颈癌发生、发展中的作用。
1 资料与方法
1.1一般资料 (1)标本来源:收集新疆医科大学附属肿瘤医院病理科2008年6月至2010年6月维吾尔族妇女子宫颈鳞状细胞癌、慢性宫颈炎石蜡标本各30例,CINⅠ、Ⅱ、Ⅲ级各15例,均未经放疗、化疗、免疫治疗或近期局部物理治疗。所有组织均经10%的甲醛固定,常规石蜡包埋,连续切片厚2μm。本研究中子宫颈癌的高危型HPV数据来自组织标本所对应的临床病历资料。(2)试剂:miRNA-101探针为Exiqon公司产品;通用型原位杂交检测试剂盒Ⅲ MK1031购自武汉博士德生物工程有限公司;DEPC购自美国Amresco公司。
1.2方法 所有液体试剂均需用0.1%DEPC处理或用DEPC水配置。(1)二甲苯脱石蜡,梯度乙醇脱水;(2)3%H2O2室温作用10min;(3)胃蛋白酶(成分为1 000μL纯净水、100μL HCl、10μL浓缩胃蛋白酶)37 ℃消化30min,0.5 mol/L TBS洗涤5min×3次;(4)杂交,每张切片20μL杂交液(浓度为1∶200),将原位杂交专用盖玻片盖于组织上,切片置于杂交仪内,37℃孵育14~16h;(5)37℃2×柠檬酸缓冲液(SSC),5min×2次,洗去部分非特异性结合的探针;(6)滴加封闭液,37℃孵育20min,甩去多余液体,不洗;(7)滴加碱性磷酸酶标记小鼠抗地高辛(用0.5mol/L TBS按1∶200稀释),37℃孵育60min;(8)BCIP/NBT显色:按1∶20的比例用0.01mol/L TBS(pH9.5)稀释,混匀,显色液加至标本上,室温显色10min,充分水洗,核固红复染5~15min,水洗,水溶性封片剂封片。用已知阳性片做阳性对照,用PBS替代miRNA-101抗体作为阴性对照。
1.3统计学处理 应用SPSS17.0统计软件进行分析,计数资料率的比较采用χ2检验。相关性分析采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结 果
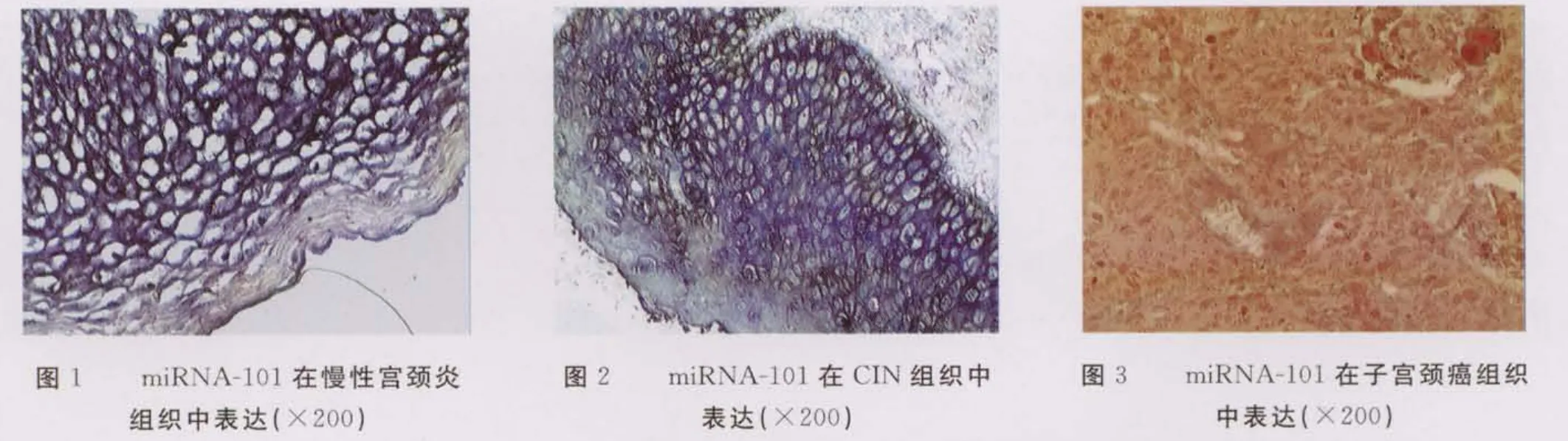
miRNA-101定位于子宫颈上皮细胞细胞质,阳性表达为细胞质着色呈紫蓝色。miRNA-101在慢性宫颈炎中表达为阳性,细胞质弥漫性着色呈紫蓝色(封3图1);在CINⅠ~Ⅲ级中miRNA-101阳性表达呈逐渐下降趋势(封3图2);而在子宫颈鳞状细胞癌中miRNA-101为阴性表达,癌巢中未见有蓝紫色的阳性表达颗粒,因有核固红,故组织呈现红色(封3图3)。阴性对照组全部为阴性。miRNA-101在慢性宫颈炎,CINⅠ、Ⅱ、Ⅲ及子宫颈鳞状细胞癌中的阳性表达率分别为80.00%(24/30)、73.33%(11/15)、46.67%(7/15)、26.67%(4/15)及10.00%(3/30),差异有统计学意义(χ2=36.295,P=0.000)。在子宫颈鳞状细胞癌中 HPV阳性率为86.67%(26/30),其miRNA-101表达与 HPV呈负相关(r=-0.767,P=0.000)。在子宫颈鳞状细胞癌高危型HPV阳性26例患者中,HPV16检出率最高,达73.08%(19/26),明显高于 HPV18(19.23%)及其他亚型(7.69%)(χ2=28.500,P=0.000)。
3 讨 论
本课题组在前期研究中用miRNA微阵列芯片,检测维吾尔族妇女子宫颈鳞状细胞癌及慢性宫颈炎组织中差异表达的miRNA,发现在维吾尔族妇女宫颈癌中有12个miRNA表达下调,其中 miRNA-101下调最明显,并用RT-PCR方法验证了芯片检测结果[4]。miRNA-101是一类单链核糖核酸的负调控基因表达的非编码小RNA。miRNA-101前体是一个茎环状结构,大约有70个核苷酸,在Dicer的作用下,剪切为21~24个核苷酸的成熟miRNA-101。在多种肿瘤中miRNA-101的表达下调,如胃癌[5]、结肠癌[6]、前列腺癌[7]、非小细胞肺癌[8]、肝细胞性肝癌[9]等。
本研究发现,miRNA-101在慢性宫颈炎上皮组织中阳性率最高,在CINⅠ~Ⅲ级中表达呈阶梯样下降,而在子宫颈鳞状细胞癌中阳性率最低,即在子宫颈由癌前病变发展到子宫颈癌的过程中miRNA-101表达逐步降低。这与国外大多数文献报道相一致,提示miRNA-101的表达失调可能与子宫颈癌的发生有关。Hiroki等[10]在miRNA与子宫内膜浆液性腺癌的研究中发现,miRNA-101表达下调,转染miRNA-101或前体miRNA-101到子宫内膜浆液性腺癌的细胞株中,细胞生长受抑制。Friedman等[11]对膀胱移形细胞癌中miRNA-101的表达进行研究,发现miRNA-101抑制膀胱移形癌细胞株中的细胞增殖和集落形成。
本研究发现,miRNA-101在CINⅠ、Ⅱ、Ⅲ级中均有表达,且其阳性率呈阶梯样下降,即miRNA-101在子宫颈鳞状细胞癌前病变阶段随着病情发展其阳性率逐步下降,提示miRNA-101有可能成为新的检测宫颈癌的早期指标之一。这与以往文献报道相似。Hanke等[2]研究发现miRNA-152可能用于膀胱癌的无创性早期诊断;血清标本中的miRNA-21也可作为弥散性巨大B细胞淋巴瘤(DLBCL)非损伤性的诊断标记物[12],而痰液miRNA-21水平诊断法可能成为一种有效的肺癌无创伤检查法[13]。
本研究通过对维吾尔族妇女子宫颈鳞状细胞癌临床病例中高危型HPV数据的分析,发现高危型HPV阳性的子宫颈鳞状细胞癌中miRNA-101低表达,在慢性宫颈炎上皮组织中miRNA-101高表达。即在高危型HPV阳性的子宫颈鳞状细胞癌癌组织与正常宫颈组织中miRNA-101差异表达,提示miRNA-101表达改变可能与HPV阳性子宫颈鳞状细胞癌的发生有密切关系。本研究中,高危型HPV阳性为26例,其中,HPV16检出率最高(73.08%),明显高于 HPV18及其他亚型,提示维吾尔族妇女子宫颈鳞状细胞癌高危型HPV感染以HPV16为主。而关于miRNA与HPV是否在子宫颈癌发生、发展中起相互作用,国内、外研究者的看法不一。Melar-New等[14]的研究发现,高水平的 miRNA-203抑制高危型HPV的扩增,而高危型HPV病毒蛋白也能够抑制分化细胞中miRNA-203的表达。与此相反,Cai等[15]对 HPV31型复制周期的潜伏期和繁殖期进行miRNAs分析,发现的500余种细胞miRNAs中没有一个HPV31特异的miRNAs,他们认为HPV31及所有亚型的HPV均不表达病毒编码的miRNAs。造成这种截然相反结果的原因可能包括:(1)研究对象的异质性。不同的子宫颈癌组织构成(如组织学类型、病理分期、临床分级)和正常对照宫颈组织来源,均可能导致结论不一致。(2)采用不同的筛选方法及定量方法可能导致结果差异。因此,有必要进行大样本、高通量、标准化的子宫颈癌 miRNA-101表达谱研究,以明确miRNA-101的表达变化与HPV阳性子宫颈鳞状细胞癌之间的相关性。所以,探讨高危型HPV感染及致癌过程中miRNA-101的表达特征及作用机制,对阐明HPV致癌机制和探索阻断宫颈癌发生的新策略和新靶点具有极其重要的意义。
综上所述,miRNA-101参与了维吾尔族妇女子宫颈鳞状细胞癌的发生、发展;miRNA-101与高危型 HPV感染有关;miRNA-101可能作为子宫颈癌筛查以及早期诊断的分子指标。高危型HPV与miRNA-101在子宫颈癌中的具体作用机制有待进一步深入研究。
[1]拉莱·苏祖克,彭玉华,周康,等.新疆不同民族子宫颈癌发病趋势分析[J].新疆医科大学学报,2006,29(7):569-571.
[2]Hanke M,Hoefig K,Merz H,et al.A robust methodology to study urine microRNA as tumor marker:microRNA-126and microRNA-182are related to urinary bladder cancer[J].Urol Oncol,2010,28(6):655-661.
[3]王雪春,孙蓬明,林芬,等.某地区HPV不同亚型感染与宫颈病变的相关研究[J].国际检验医学杂志,2011,32(10):1024-1026.
[4]林晨,顾霞,拉莱·苏祖克,等.子宫颈癌组织中miRNAs的差异表达[J].中华妇产科杂志,2011,46(2):136-137.
[5]Wang HJ,Ruan HJ,He XJ,et al.MicroRNA-101is downregulated in gastric cancer and involved in cell migration and invasion[J].Eur J Cancer,2010,46(12):295-303.
[6]Strillacci A,Griffoni C,Sansone P,et al.MiRNA-101downregulation is involved in cyclooxygenase-2overexpression in human colon cancer cells[J].Exp Cell Res,2009,315(8):1439-1447.
[7]Chiang CW,Huang Y,Leong KW,et al.PKCalpha mediated induction of miRNA-101in human hepatoma HepG2cells[J].J Biomed Sci,2010,17(1):35.
[8]Zhang JG,Guo JF,Liu DL,et al.MicroRNA-101exerts tumor-suppressive functions in non-small cell lung cancer through directly targeting enhancer of zeste homolog 2[J].J Thorac Oncol,2011,6(4):671-678.
[9]Li S,Fu H,Wang Y,et al.MicroRNA-101regulates expression of the v-fos FBJ murine osteosarcoma viral oncogene homolog(FOS)oncogene in human hepatocellular carcinoma[J].Hepatology,2009,49(4):1194-1202.
[10]Hiroki E,Akahira J,Suzuki F,et al.Changes in microRNA expression levels correlate with clinicopathological features and prognoses in endometrial serous adenocarcinomas[J].Cancer Sci,2010,101(1):241-249.
[11]Friedman JM,Liang G,Liu CC,et al.The putative tumor suppressor microRNA-101modulates the cancer epigenome by repressing the polycomb group protein EZH2[J].Cancer Res,2009,69(6):2623-2629.
[12]Lawrie CH,Gal S,Dunlop HM,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J].Br J Haematol,2008,141(5):672-675.
[13]Xie Y,Todd NW,Liu Z,et al.Altered miRNA expression in sputum for diagnosis of non-small cell lung cancer[J].Lung Cancer,2010,67(2):170-176.
[14]Melar-New M,Laimins LA.Human Papillomaviruses modulate expression of MicroRNA 203upon epithelial differentiation to control levels of p63proteins[J].J Virol,2010,84(10):5212-5221.
[15]Cai X,Li G,Laimins LA,et al.Human papillomavirus genotype 31does not express detectable microRNA levels during latent or productive virus replication[J].J Virol 2006,80(21):10890-10893.
