美洲大蠊i型溶菌酶基因的克隆及其功能预测
2012-06-29龙高群张春林
王 赟,龙高群,张春林*,田 茂
(1.贵阳医学院医学生物技术教研室,贵州 贵阳 550004;2.贵阳医学院生物学教研室,贵州 贵阳 550004)
溶菌酶(EC3.2.1.17),又称 N-乙酰胞壁质聚糖水解酶,它能切断肽聚糖中的N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键之间的联结,破坏肽聚糖支架,在内部渗透压的作用下使细胞胀裂开,引起细菌裂解[1]。因此,它是一种广谱的抗菌效应分子。除此之外,它还可诱导调节其他免疫因子的合成和分泌[2-3]。
在动物中有3种不同类型的溶菌酶,即c型溶菌酶(chicken-lysozyme type)、g 型溶菌酶(goosetype)和i型溶菌酶(invertebrate-type)[4-5]。其中,c型溶菌酶是同时存在于无脊椎动物和脊椎动物中的类型,g型溶菌酶主要存在于脊椎动物,而i型溶菌酶存在于无脊椎动物中。近年来对i型溶菌酶的研究多见于海洋生物,如文蛤[6]、斑节对虾[7]等,但对昆虫i型溶菌酶的研究较为少见。昆虫具有许多免疫功能的多肽类物质,与血细胞一起组成了昆虫体内免疫功能体系。受到细菌等异物刺激后,很多昆虫均能有效诱导溶菌酶、抗菌肽、凝集素和血素等血淋巴抗菌蛋白的增加,从而增强机体的免疫防卫机能,维持内环境的稳定[8]。
美洲大蠊属于昆虫纲蜚蠊目,是南方地区室内优势品种,它能携带许多病原微生物如痢疾杆菌、副伤寒沙门菌、绿脓杆菌和寄生虫等,是家畜及人类许多传染性疾病的重要传播媒介。因而它可能具有独特的免疫防御机制,比一般生物更能有效抵御病原微生物的感染。有研究报道,发现美洲大蠊在大肠埃希菌诱导后,其血淋巴的抗菌活性增强,考虑经诱导后其溶菌酶、抗菌肽、凝集素和血素等血淋巴的抗菌蛋白增加[9]。本研究通过RT-PCR技术和RACE PCR技术获得了美洲大蠊i型溶菌酶全长编码区,并预测了其可能具有的功能,为今后对该基因功能及分子进化的研究提供了重要的基础资料。
1 材料与方法
1.1 材料
实验动物为美洲大蠊(Periplaneta americana),由贵阳医学院生物学教研室饲养繁殖。
1.2 方法
1.2.1 美洲大蠊i型溶菌酶基因片段的获取 以冈比亚按蚊i型溶菌酶氨基酸序列(XP-309527)为探针,对美洲大蠊EST序列库进行tBLASTn检索,仅得到1条与之同源的序列。将此序列用ORF Finder查找开放阅读框,并进行BLAST比对,为潜在i型溶菌酶编码基因,但其编码区5'端不完整。
1.2.2 利用RT-PCR获得美洲大蠊i型溶菌酶基因片段 采用Trizol法提取新鲜美洲大蠊组织样本总RNA,用紫外分光计测定总RNA纯度和浓度,cDNA第一链的合成按照Fermentas第一链合成试剂盒操作说明进行。根据比对获得的美洲大蠊潜在i型溶菌酶基因片段设计引物,上游引物5'-CAAAGTCTCTGGTTCTGGTG-3',下游引物5'-ACACTAGACAGCAGAGGAG-3',由上海生工生物工程技术服务有限公司合成。PCR反应体系为25μL:10×buffer缓冲液 2.5μL,MgCl2(25 mmol/L)2.5μL,dNTPs Mixture(10nmol/L)2.0 μL,mtP1引物(10mmol/L)2.0μL,mtP2引物(10 mmol/L)2.0μL,模板 DNA(50ng/μL)2.0μL,Taq酶(5U/μL)0.2μL,双蒸水补足至25μL。扩增条件为:94℃预变性5min;94℃1min,55℃30s,72℃1min,30个循环;72℃延伸5min。扩增产物经琼脂糖凝胶电泳,回收目的片段,并与pMD-18T载体进行连接、转化大肠埃希菌DH5α;蓝白斑筛选阳性克隆并经菌落PCR验证后,送上海生工生物工程技术服务有限公司测序,从而得到美洲大蠊i型溶菌酶部分cDNA序列。
1.2.3 利用5'-RACE PCR扩增已知cDNA片段5'末端 根据测序获得的cDNA部分序列,设计5'-RACE PCR引物Lysozyme 5'GSP:5'-GCAGCCTGCACTTGTCGCTGACATT-3'和 Lysozyme 5'Nest:5'-AGCCACCTAGGCGATGGATGGCTGCAT-3'。本试验根据GeneRacerTM Kit试剂盒说明,扩增出已知cDNA片段的5'末端并进行测序。
1.2.4 用生物信息学方法对美洲大蠊i型溶菌酶基因序列进行分析 将RT-PCR和5'-RACE PCR测序结果用DNAMAN软件进行序列拼接,并用ORF Finder预测美洲大蠊i型溶菌酶的开放阅读框,推导出氨基酸序列。用NCBI Blast对该序列进行同源比对。用ProtParam分析该蛋白等电点、分子质量和分子式;ProtScale分析蛋白质的疏水性;Singal P进行信号肽预测;TMHMM对跨膜区进行分析;ExPASY的TargetP对该蛋白进行亚细胞定位;DNA Star软件预测蛋白质的二级结构;SWISSMODEL进行同源建模[10]。利用Clustal W对美洲大蠊和其他物种的i型溶菌酶进行同源比对,并用Mega软件构建c型溶菌酶、i型溶菌酶和g型溶菌酶的分子系统树,预测进化关系。

图1 美洲大蠊i型溶菌酶RT-PCR结果Fig.1 RT-PCR result of i-type lysozyme from Periplaneta americana
2 结果
2.1 美洲大蠊i型溶菌酶基因的获得
以冈比亚按蚊i型溶菌酶为探针,比对获得美洲大蠊潜在编码i型溶菌酶的EST序列,针对此序列设计引物经RT-PCR扩增,获得511bp的片段(图1)。将此序列在NCBI进行比对,发现其仅具备i型溶菌酶部分保守结构域,编码区具备终止密码子,无起始密码子。因此,针对此序列设计5'-RACE引物,经PCR扩增获得445bp的片段(图2)。将两端序列进行拼接,得到了总长为525bp的溶菌酶基因片段。将此序列登录GenBank,登录号为JQ754173。
2.2 美洲大蠊i型溶菌酶的生物信息学分析
2.2.1 美洲大蠊i型溶菌酶序列特征 在获得的美洲大蠊i型溶菌酶525bp片段中,包括5'非编码区12bp和3'非编码区18bp。其完整的开放阅读框长495bp,编码164个氨基酸(图3)。经ProtParam分析,该蛋白的等电点为5.69,分子质量计算值为17.6ku,分子式为C769H1192N210O234S16。
2.2.2 美洲大蠊i型溶菌酶信号肽预测 将推导的美洲大蠊i型溶菌酶氨基酸序列在丹麦技术大学生物序列分析中心(CBS)的网站ht tp://www.cbs.dt u.dk/services/SignalP/上进行在线分析,结果显示,其N端具有27个氨基酸的信号肽MATACKSLVLVAAAAIACSLFGSFTLG,从而可以判定其为胞外表达的效应分子,成熟肽包含136个氨基酸(图4)。

图2 美洲大蠊i型溶菌酶5'-RACE PCR结果Fig.25 '-RACE PCR result of i-type lysozyme from Periplaneta americana

图3 美洲大蠊i型溶菌酶核苷酸及推导的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of i-type lysozyme fromPeriplaneta americana
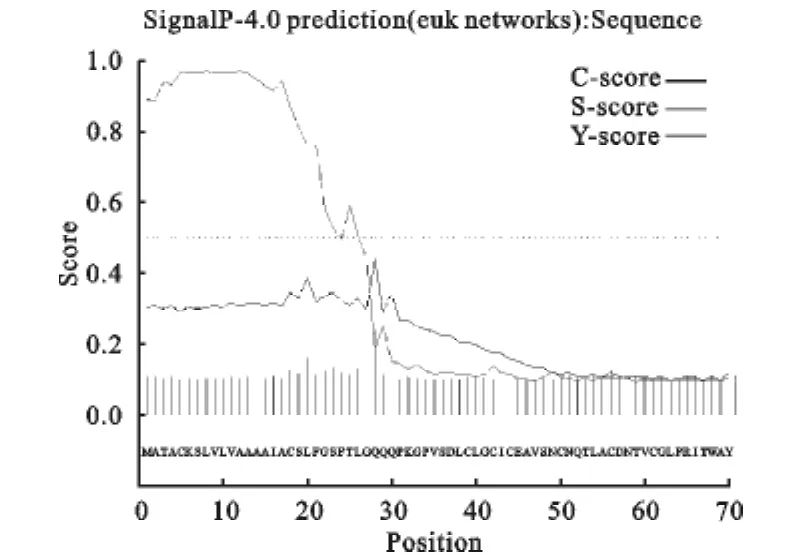
图4 美洲大蠊i型溶菌酶信号肽分析结果Fig.4 The prediction of signal peptide of i-type lysozyme fromPeriplaneta americana
2.2.3 美洲大蠊i型溶菌酶亲水性与疏水性分析通过 ProtScal(http://web.expasy.org/cgi-bin/protscale/protscale)分析该蛋白的亲水性和疏水性,结果显示该蛋白在1~20氨基酸处有一明显的疏水性区域(图5),其中第16位的异亮氨酸疏水性最强(分值为4.500),而第92位精氨酸亲水性最强(分值为-4.500)。
2.2.4 美洲大蠊i型溶菌酶跨膜区分析 TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)预测美洲大蠊i型溶菌酶在第7~26位氨基酸区域有一明显的跨膜区(图6)。
2.2.5 美洲大蠊i型溶菌酶的亚细胞定位 通过在线软件PSORT(http://psort.hgc.jp/form2.html)分析美洲大蠊i型溶菌酶的亚细胞定位,预测结果显示,该蛋白主要分泌到细胞外(55.6%),其余存在于细胞质、液泡、内质网和线粒体中(各占11.1%)。
2.3 美洲大蠊i型溶菌酶结构分析
2.3.1 美洲大蠊i型溶菌酶二级结构分析 利用DNA Star软件对美洲大蠊i型溶菌酶的二级结构进行预测(图7),结果显示按Chou-Fosman预测法,该蛋白α-螺旋、β-折叠和β-转角较均匀地分布于整个氨基酸链。
2.3.2 美洲大蠊i型溶菌酶三级结构的分析 将美洲大蠊i型溶菌酶的氨基酸序列进行蛋白质保守结构域数据库搜索(Conserved Domain Database,CDD),结果发现,它具有失稳酶家族(Destabilase superfamily)的保守结构域。利用SWISS-MODEL同源建模,得到美洲大蠊i型溶菌酶氨基酸序列的预测三级结构,与已知的i型溶菌酶的三级结构模型相似性很高。
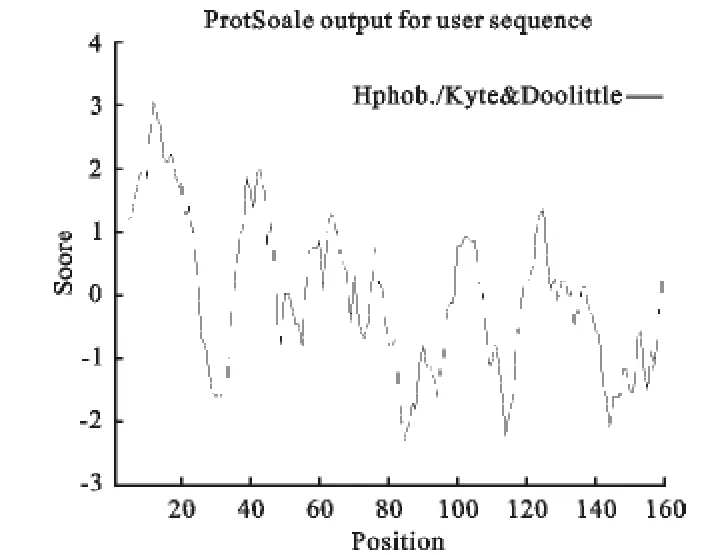
图5 美洲大蠊i型溶菌酶疏水性分析结果Fig.5 Hydrophobicity analysis of i-type lysozyme from Periplaneta americana
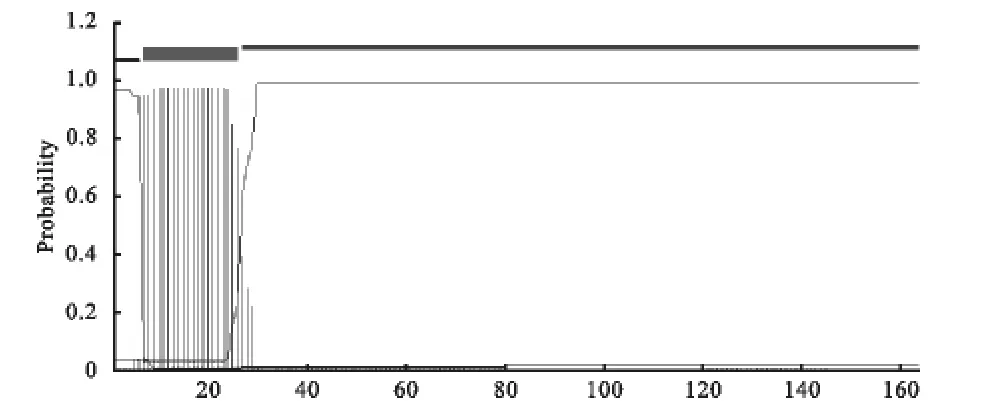
图6 美洲大蠊i型溶菌酶跨膜区分析结果Fig.6 Transmembrane domain analysis of i-type lysozyme fromPeriplaneta americana
2.4 美洲大蠊i型溶菌酶同源性比较和分子进化分析
美洲大蠊i型溶菌酶氨基酸序列经Blast分析显示,它与黑腹果蝇、冈比亚按蚊i型溶菌酶有较高的相似性(分别为64%和53%)(图8)。将该序列与线形动物门的秀丽隐杆线虫(Caenorhabditis elegans,登录号NP-500207),环节动物门的医蛭(Hirudo medicinalis,登录号 AAA96144)和安德爱胜蚓(Eisenia andrei,登录号 ABC68610),软体动物门的菲律宾蛤仔(Venerupis philippinarum,登录号BAB33389)、美洲牡蛎(Crassostrea virginica,登录号P83673),节肢动物门的冈比亚按蚊(A-nopheles gambiae,登录号AAT51799、ABP35929)、黑腹果蝇(Drosophila melanogaster,登录号ACD99447)、意大利蜜蜂(Apis mellifera,登录号XP_393161)、地熊蜂(Bombus terrestris,登录号 XP_003394100)和棘皮动物门的刺参(Apostichopus japonicus,登录号ABK34500)、红海盘车(Asterias rubens,登录号AAR29291)的i型溶菌酶成熟肽进行Clustal W比对(图8),可以看出所有物种的i型溶菌酶均具有异构肽活性位点H。除节肢动物门的动物外,线性动物门、环节动物门和棘皮动物门的动物都具有糖苷酶活性位点E/D/S;同时,这些门类动物的i型溶菌酶具有一段特有的保守序列MDVGSLSCG(P/Y)(Y/F)QIK。
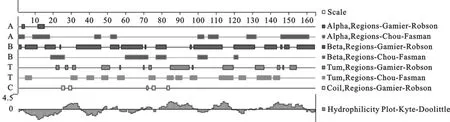
图7 美洲大蠊i型溶菌酶二级结构分析结果Fig.7 Secondary structure analysis of i-type lysozyme fromPeriplaneta americana
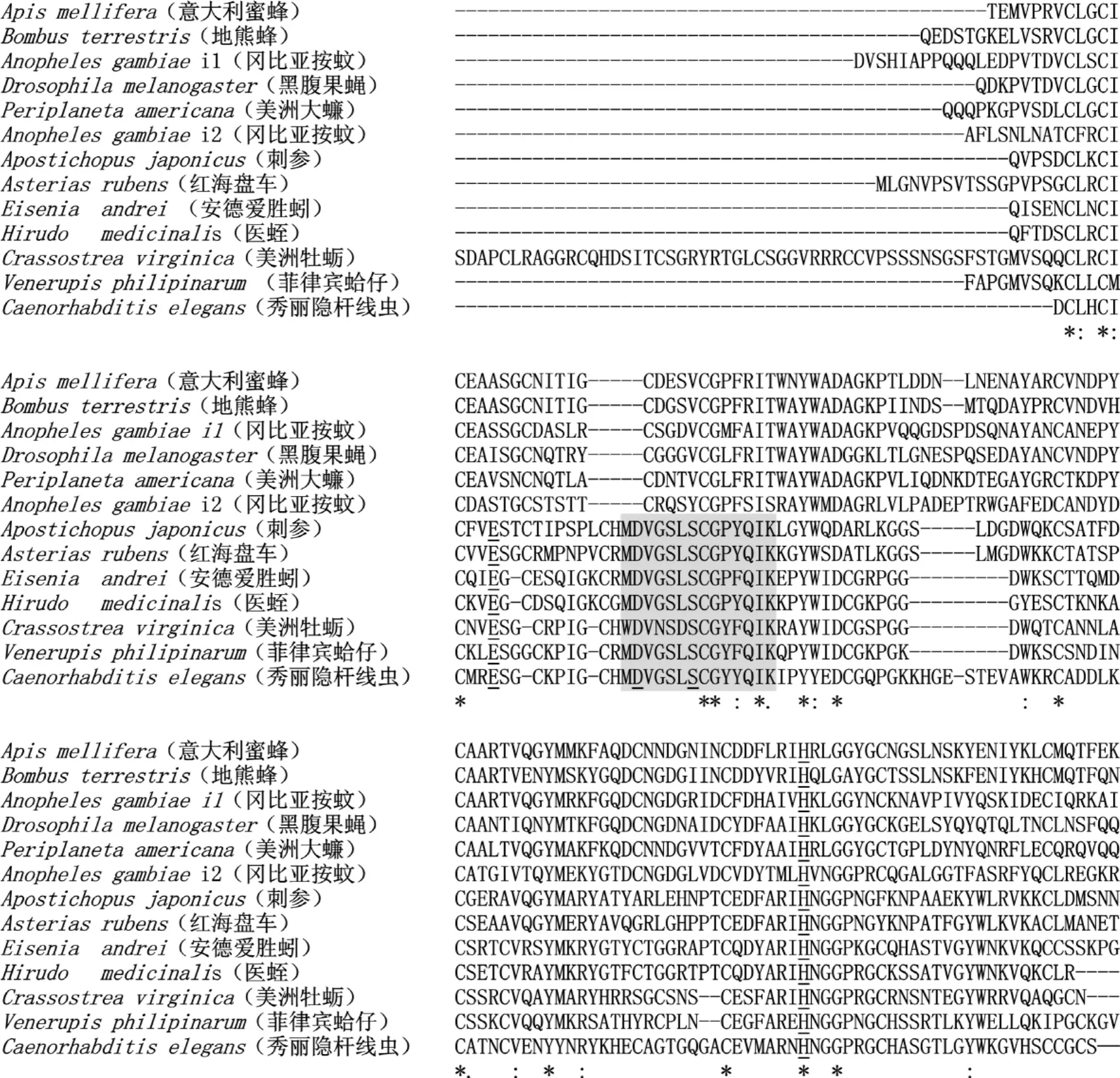
图8 美洲大蠊i型溶菌酶与其他物种i型溶菌酶多序列比对结果Fig.8 Multiple alignments of Periplaneta americanai-type lysozyme with other known i-type lysozyme deduced amino acid sequences
根据美洲大蠊i型溶菌酶氨基酸序列与其他动物的c型、g型和i型溶菌酶构建的系统发育树(表1和图9)结果显示,3种不同类型的溶菌酶分成3个大的分支,其中i型溶菌酶又根据有无糖苷酶活性位点划分为两个分支,美洲大蠊i型溶菌酶属于无糖苷酶活性位点分支。
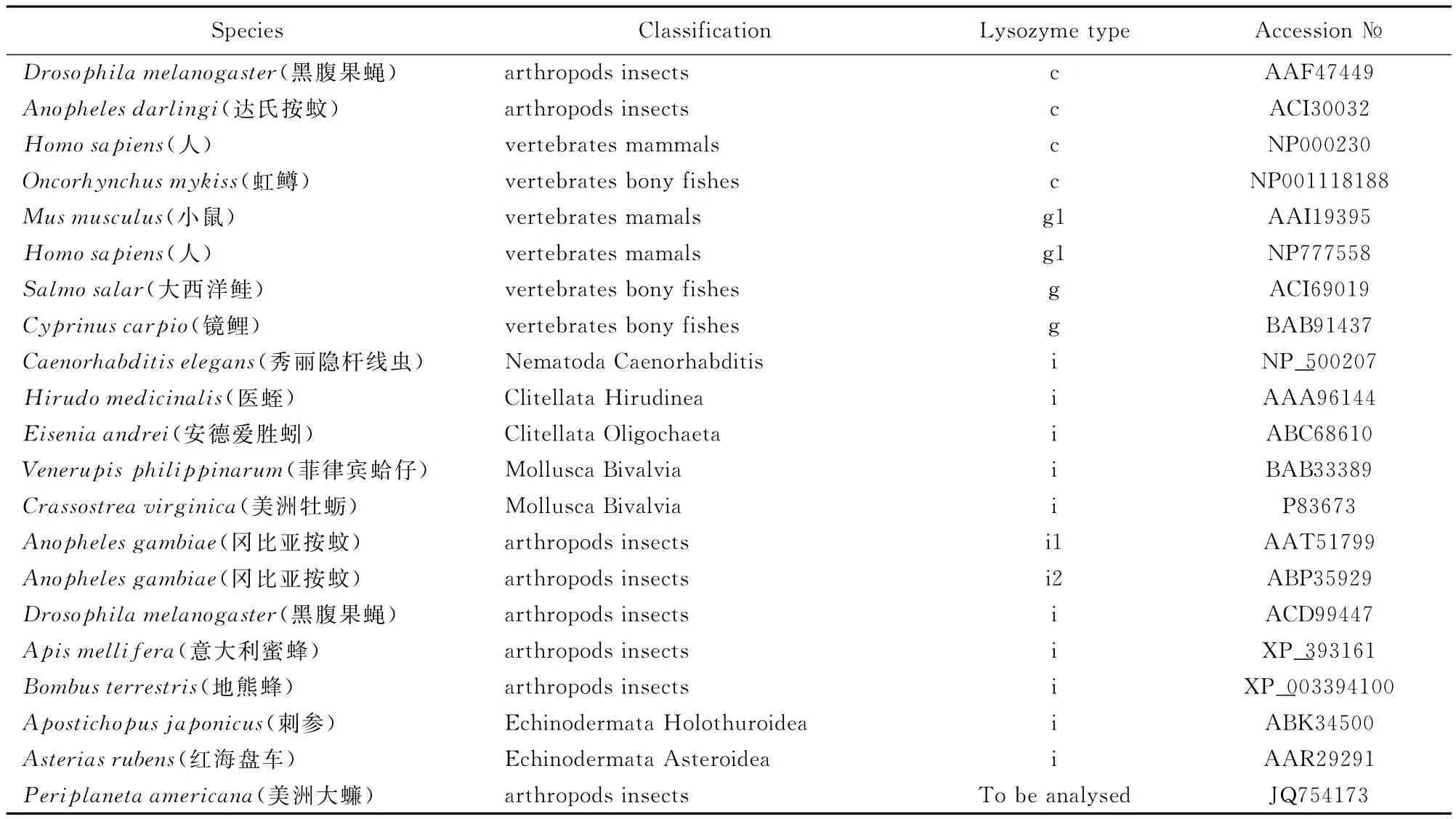
表1 多序列比对及构建系统发育树所用的序列Table1 Sequences used for multiple alignment and phylogenetic analysis
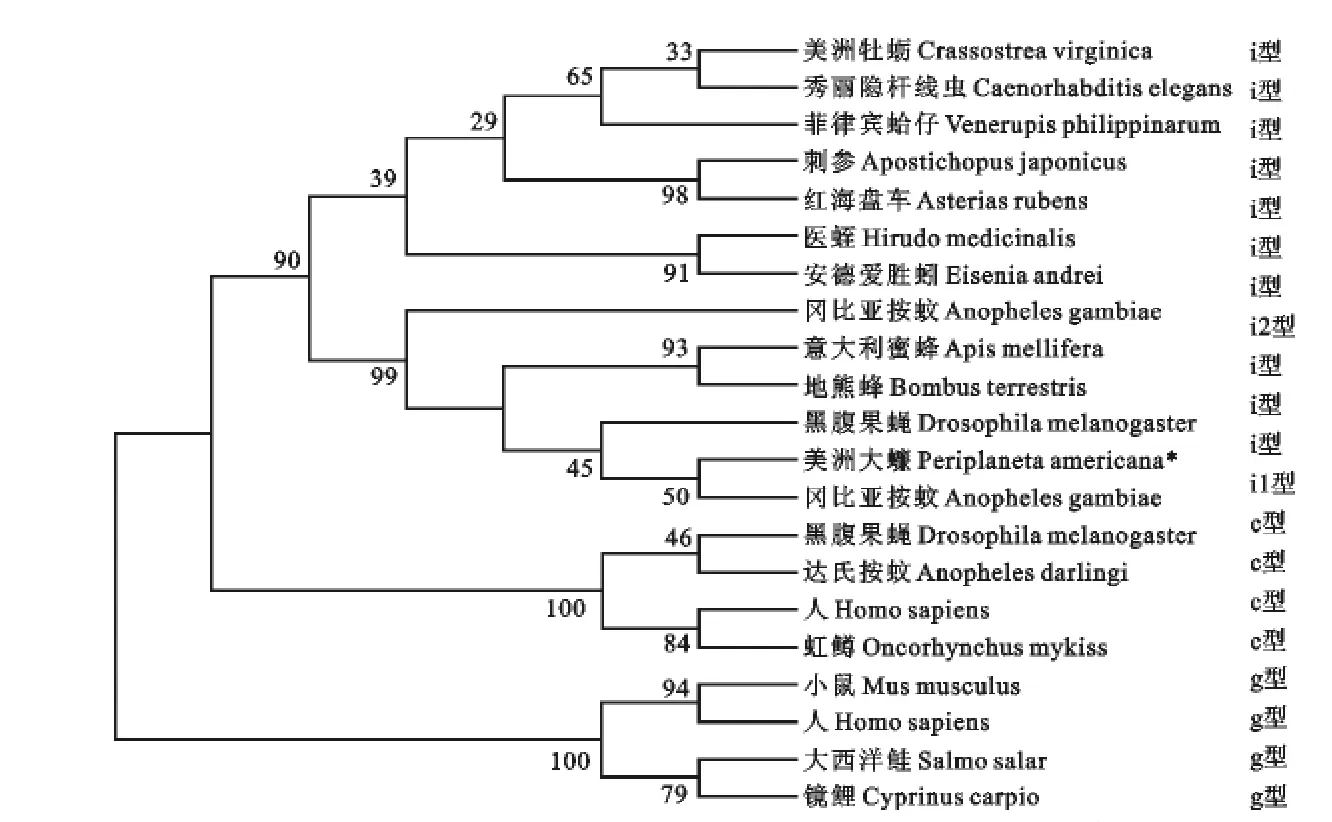
图9 基于i型、c型和g型溶菌酶氨基酸序列构建的系统发育树Fig.9 Phylogenetic analysis of the protein sequences of various i,c,and g type lysozymes
3 讨论
本试验以美洲大蠊为研究对象,通过RT-PCR和RACE PCR技术首次克隆得到其i型溶菌酶完整编码区序列(登录号:JQ754173),并对其氨基酸序列进行了基本生物信息学分析。通过同源比对,该序列与黑腹果蝇和冈比亚按蚊i型溶菌酶具有同源性。系统发育树分析表明,美洲大蠊i型溶菌酶与同属节肢动物门的冈比亚按蚊、黑腹果蝇、蜜蜂、熊蜂i型溶菌酶同聚于i型溶菌酶这一分支,而且,系统发育树的结果认同了c、i溶菌酶起源于同一祖先g型溶菌酶这一说法[5]。
通过蛋白质保守结构域分析,它具有失稳酶家族(Destabilase superfamily)的保守结构域,而且它和失稳酶的三级结构模型也极其相似。失稳酶(destabilase)最初发现存在于欧洲医蛭,研究表明其具有异构肽活性,能水解纤维蛋白的ε-(γ-Glu)-Lys的交联键,从而使纤维蛋白发生水解[11]。后来,人们在失稳酶中也发现了糖苷酶活力,于是失稳酶被认为是一种新的溶菌酶,进一步被认定为i型溶菌酶[12-13]。由于失稳酶既具有失稳酶活性,又具有糖苷酶活性,故称作DL(destabilase-lysozyme)。美洲大蠊i型溶菌酶具有失稳酶的保守结构域,三级结构与失稳酶的三级结构相似,而且本文在对不同物种i型溶菌酶的同源比对中发现,所有物种均具有H位点,此位点被认为是异构肽活性的功能位点[14]。同时,同源比对中的安德爱胜蚓(Eisenia andrei)i型溶菌酶(登录号:ABC68610),它也具有 H位点,而且有学者对安德爱胜蚓i型溶菌酶的功能进行研究,发现它具有异构肽的活性,能够切断p-NA中的L-γ-Glu-Pna[15],因而我们推测,美洲大蠊溶菌酶同样具有异构肽活性,能够水解纤维蛋白。
结构决定功能,溶菌酶的抑菌功能依赖于糖苷酶活力,由其自身结构决定。c型溶菌酶有2个活性位点E、D[16],g型溶菌酶有3个活性位点,即E和2个D[17],而i型溶菌酶为E、D、S[16]。对安德爱胜蚓和海刺参的i型溶菌酶研究发现,它们具有活性位点E、D、S,功能研究也证实其具有抑菌活性[15,18]。而对不具有此活性位点的冈比亚按蚊i型溶菌酶进行研究发现,经细菌诱导后的real-time定量结果并未提示其表达量的增加,但在血餐后i型溶菌酶的表达量上调,因而作者认为i型溶菌酶可能在冈比亚按蚊消化道发挥了消化细菌的作用,也有可能是它发挥了异构肽活性,水解纤维蛋白从而达到破坏血凝块的目的,但作者并未进行体外实验研究i型溶菌酶是否具有抑菌功能[19]。有趣的是,对节肢动物门的斑节对虾i型溶菌酶研究发现,它并不具备糖苷酶活性位点E、D、S,但其重组蛋白对革兰氏阴性菌有明显的抑菌作用[7]。本研究中的美洲大蠊i型溶菌酶并不具备糖苷酶活性位点,它是否具有抑菌活性,需要下一步的实验才能证实。但有学者提出,或许这些功能位点并不是i型溶菌酶抑菌活性必须具备的,可能不具备这些位点它同样具有抑菌活性[20]。
综上所述,我们对美洲大蠊i型溶菌酶的基本特征进行分析,并预测了其可能具备的功能。美洲大蠊i型溶菌酶具有活性位点H,推测其应该具备异构肽活性,能水解纤维蛋白。但它不具备抑菌活性必须的位点E、D、S,其是否具备抑菌活性,能在美洲大蠊独特的免疫机制中发挥重要的作用,还需要进一步的试验来证实。
[1]李 鹤,马 力,王维香.溶菌酶的研究现状[J].食品研究与开发,2008,29(1):182-185.
[2]Sonomi M,Junichi H ,Ikuo H ,et al.Expression of Japanese flounder c2type lysozyme cDNA in insect cells[J].Dev Comp Immunol,2001,25(5):439-445.
[3]Chipman D M,Sharon N.Mechanism of lyozyme action[J].Science,1969,165(892):454-465.
[4]Prager E M,Jollès P.Lysozymes:Model enzymes in biochemistry and molecular biology[M].Berlin:Birkhāuser,1996:9-31.
[5]Bachali S,Jager M,Hassanin A,et al.Phylogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function[J].J Mol Evo,2002,54(5):652-664.
[6]Yue X,Liu B Z,Xue Q G.An i-type lysozyme from the Asiatic hard clam Meretrix meretrix potentially functionging in host immunity[J].Fish &Shellfish Immunol,2011,30(2):550-558.
[7]Supungul P,Rimphanitchayakit V,Aoki T,et al.Molecular characterization and expression analysis of a c-type and two novel muramidase-deficient i-type lysozymes from Penaeus monodon[J],Fish &Shellfish Immunol,2010,28(3):490-498.
[8]王荫长.昆虫生物化学,[M].北京:中国农业出版社,2004:245-270.
[9]金小宝,王 艳,朱家勇.诱导前后美洲大蠊血淋巴抗菌活性的研究[J].广东药学院学报,2006,22(6):665-682.
[10]Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL Workspace:A web-based environment for protein structure homology modeling[J].Bioinformatics,2006,22(2):195-201.
[11]Zavalova L,Lukyanov S,Baskova I,et al.Genes from the medicinal leech(Hirudo medicinalis)coding for unusual enzymes that specifically cleave endo-ε-(γ-Glu)-Lys isopeptide bonds and help to dissolve blood clots[J].Mol Gen Genet,1996,253(1-2):20-25.
[12]Zavalova L,Baskova I P,Lukyanov S A,et al.Destabilase from the medicinal leech is a reprssentative of a novel family of lysozymes[J].Biochimi Biophysica Acta,2000,1478(1):69-77.
[13]Zavalova L L,Baskova I P,Barsova E V,et al.Recombinant destabilase-lysozyme:synthesis de novo in E.coli and action mechanismof the enzyme expressed in Spodoptera f rugiperda[J].Biochemistry(Moscow),2004,69(7):776-781.
[14]Yue X,Liu B Z,Xue Q G.An i-type lysozyme from the Asiatic hard clam Meretrix meretrix potentially functioning in host immunity[J].Fish &Shellfish Immunol,2011,30(2):550-558.
[15]JoskováR,ŠilerováM,ProcházkováP,et al.Martin bilej.Identification and cloning of an invertetrate-type lysozyme from Eisenia Andrei[J].Dev &Com Immuno,2009,33(8):932-938.
[16]Cheetham J C,Artymiuk P J,Phillips D C.Refinement of an enzyme complex with inhibitor bound at partial occupancy[J].J Mol Biol,1992,224(3):613-628.
[17]Kawamura S,Ohno K,Ohkuma M,et al.Experimental verifica tion of the crucial roles of Glu73in the catalytic activity and structural stability of goose type lysozyme[J].J Biochem,2006,140(1):75-85.
[18]Cong L,Yang X J,Wang X X,et al.Characterization of an itype lysozyme gene from the sea ccumber stichopus japonicus,and enzymatic and nonenzymatic antimicrobial activities of its recombinant protein[J].J Biosci Bioeng,2009,107(6):583-588.
[19]Paskewitz S M,Li B,Kajia M K.Cloning and molecular characterization of two invertebrate-type lysozymes from A-nopheles gambiae[J].Ins Mol Bio,2008,17(3):217-225.
[20]Callewaert L,Michiels C W.Lysozymes in the animal kingdom[J].J Biosci,2010,35(1):127-160.
