牛病毒性腹泻病毒牦牛分离株E0基因的克隆表达
2012-06-29叶成玉王光华蔡其刚王戈平张芳芳马利青周继章
叶成玉,王光华,蔡其刚,王戈平,陆 艳,张芳芳,马利青,周继章*
(1.青海省畜牧兽医科学院 ,青海 西宁 810016;2.中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室 农业部兽医公共卫生重点开放实验室,甘肃 兰州 730046)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV),也称牛病毒性腹泻-黏膜病病毒,与猪瘟病毒(Classical swine fever virus,CSFV)、羊边界病毒(Border disease virus,BDV)同属黄病毒科、瘟病毒属成员,是有囊膜的单股正链RNA病毒,整个基因组大小约为12.5kb,包含有一个大的开放阅读框和两侧的非编码区[1]。开放阅读框编码一个近4000个氨基酸的多聚蛋白(E2的克隆与序列分析),从 N端到C端的顺序为:Npro(p20)、EC(p14)、E0(gp48)、E1(gp25)、E2(gp53)、p7、NS 2-3(p125)、NS 4A(p10)、NS 4B(p32)、NS 5A(p58)、NS 5B(p75),其中 EC、E0、E1和E2为结构蛋白,其他的为非结构蛋白[2]。其编码的结构蛋白主要位于BVDV基因组5′-N端部分。其中E0、E1和E2是糖基化蛋白,而E0、E2为保护性抗原基因,其中结构蛋白E2是牛病毒性腹泻病毒主要的保护性抗原,具有中和表位,能诱导中和性抗体的产生,具有较强的免疫原性,可以用于研究基因工程亚单位疫苗[3],但E2是BVDV结构蛋白中变异率较高的一种蛋白,抗原逃逸及突变频率较高,是导致疫苗保护失效和牛持续性感染的主要原因[4]。E0是BVDV编码蛋白中保守性很高的蛋白,其上有中和表位,产生的中和抗体具有中和BVDV和丙型肝炎病毒(Hepatitis C virus,HCV)的能力[5],因此,它可用于研究基因工程亚单位疫苗及基因工程诊断抗原。目前,国内外针对牦牛源BVDV E0基因的研究报道较少[6]。本研究以青海发病牦牛中分离出的BVDV流行株为试验材料,克隆表达了BVDV QHZK株的E0基因,为进一步研究BVDV E0蛋白的生物学活性,制备基因工程诊断抗原奠定了基础。
1 材料与方法
1.1 材料
1.1.1 试剂 限制性内切酶EcoRⅠ、XhoⅠ、IPTG、ExTaq酶、pMD18-T载体、质粒提取试剂盒、胶回收试剂盒,购自宝生物工程(大连)有限公司;低分子质量蛋白质Marker,DL2000DNA Marker,T4 DNA连接酶,氨苄青霉素,购自上海生工生物工程技术服务有限公司;BVDV标准参考株、阴阳性血清,均购自中国兽医药品监察所;辣根过氧化物酶(HRP)标记的兔抗牛IgG,购自Sigma公司。
1.1.2 质粒与菌种 pMD18-T-E0质粒,由青海省畜牧兽医科学院兽医生物技术研究室构建并保存;DH5α菌株,购自宝生物工程(大连)有限公司,Rosetta菌株,购自北京全式金生物科技有限公司,原核表达载体pET-32a,由本实验室保存。
1.1.3 毒株 分离自青海省泽库县某牧户疑似牦牛病毒性腹泻病牛的样品,毒株命名为“QHZK10”,由青海省畜牧兽医科学院兽医生物技术研究室保存。
1.2 方法
1.2.1 BVDV E0基因生物信息学分析 采用DNA Star软件分析BVDV牦牛分离株E0基因的二级结构、亲水性,并将其抗原性与NADL、C24V毒株进行比较。
1.2.2 E0基因的扩增引物序列为:PF15′-CCCGAATTCATGGAGAACATAACACA -3′,PF25′-CCCCTCGAGTTATGCATATGCCCC -3′。反应条件及体系:按照RT-PCR试剂盒说明书操作,反应体系(25μL),10×RT-PCR buffer 2.5μL,dNTP mixture(2.5mmol/L)4.0μL,RNase inhibitor(40 U/μL)1.0μL,上下游引物(0.1μmol/L)各1μL,AMV reverse transcriptase(5U/μL)0.5μL,Taq polymerase(5U/μL)0.5μL,总 RNA (1μg/μL)2.0μL,DEPC水12.5μL。PCR反应条件为:45℃30min;95℃ 3min;94℃ 30s,58℃ 30s,72℃ 1 min,35个循环;72℃5min。反应结束后取5μL PCR产物以5V/cm恒定电压于10g/L琼脂糖凝胶中电泳。
1.2.3 E0基因的纯化及克隆 用胶回收试剂盒纯化BVDV QHZK株E0基因PCR产物,将纯化后的产物与pMD18-T载体连接。连接产物转化至DH5α菌株,经氨苄青霉素、X-gal筛选,挑取白色菌落接种于5 mL含氨苄青霉素(终浓度50μg/mL)的LB培养基中,37℃振荡培养12h之后提取质粒。
1.2.4 重组质粒pET-32a-E0的构建 将pET-32a原核表达载体和pMD18-T-E0克隆质粒分别用EcoRⅠ、XhoⅠ双酶切,用胶回收试剂盒回收具有黏性末端的E0基因和pET-32a原核表达载体,在T4DNA连接酶作用下16℃连接5h,连接产物转化至DH5α感受态细胞。酶切反应总体积60μL,10×buffer 6μL,EcoRⅠ(10U/μL)3μL,XhoⅠ(10 U/μL)3μL,重组质粒(50ng/μL)48μL,各成分加入PCR管后放于37℃恒温水浴锅内,酶切2h后用10g/L琼脂糖凝胶电泳鉴定。
连接反应总体积25μL,体系为:10×T4DNA ligase buffer 2.5μL,E0基因片段10μL,酶切处理的pET-32a载体5μL,T4DNA ligase 1μL,无菌水6.5μL。将各管混匀后,封口膜封口,16℃水浴,连接过夜。
1.2.5 重组质粒的鉴定 将5μL连接产物转化到感受态细胞 Rosetta(DE3)中,经IPTG/X-gal琼脂平板蓝白菌落筛选,随机挑选白色菌落用含氨苄抗性的LB培养基培养,提取质粒后进行EcoRⅠ和XhoⅠ双酶切及PCR鉴定。将鉴定正确的质粒命名为pET-32a-E0。
1.2.6 重组质粒的诱导表达、蛋白纯化与抗原性检测 取50μL阳性克隆菌液加入到5mL含50μg/mL氨苄青霉素的LB液体培养基中,37℃、220r/min振荡培养过夜。次日按1∶50增菌于含氨苄青霉素(50μg/mL)的LB培养基中,培养至吸光度OD600nm为0.6~1.0之间,取出1mL未诱导菌液做阴性对照,4℃保存。余者加入IPTG至终浓度1mmol/L,200r/min、37℃诱导表达4h收集菌液,取1mL于1.5mL的离心管中,6000r/min离心3min,弃上清,收集菌体。用聚丙烯酰胺凝胶电泳(SDS-PAGE)检测表达产物,表达的蛋白用His-Band镍柱进行亲合层析纯化,并对表达出的蛋白用Western blot试验进行抗原性检测。
2 结果
2.1 E0基因生物信息学分析
图1为BVDV QHZK、VEDEVAC和C24V株E0蛋白氨基酸抗原指数比较图,图2是BVDV QHZK、VEDEVAC和C24V株E0蛋白氨基酸亲水性比较图,图1和图2总体表明E0氨基酸的抗原性与亲水性指数呈平行相关性,QHZK株E0氨基酸的抗原性与亲水性指数与标准毒株VEDEVAC和C24V非常相似,从而证明E0基因在BVDV各毒株间具有很高的保守性,有利于研究该病的基因工程疫苗。
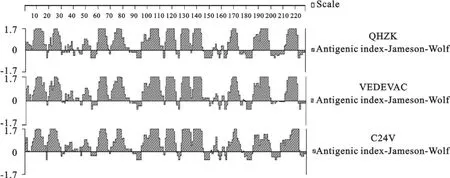
图1 BVDV QHZK、VEDEVAC和C24V株E0蛋白氨基酸抗原指数比较Fig.1 Compaison of amino acid antigencity of QHZK with VEDEVAC and C24V
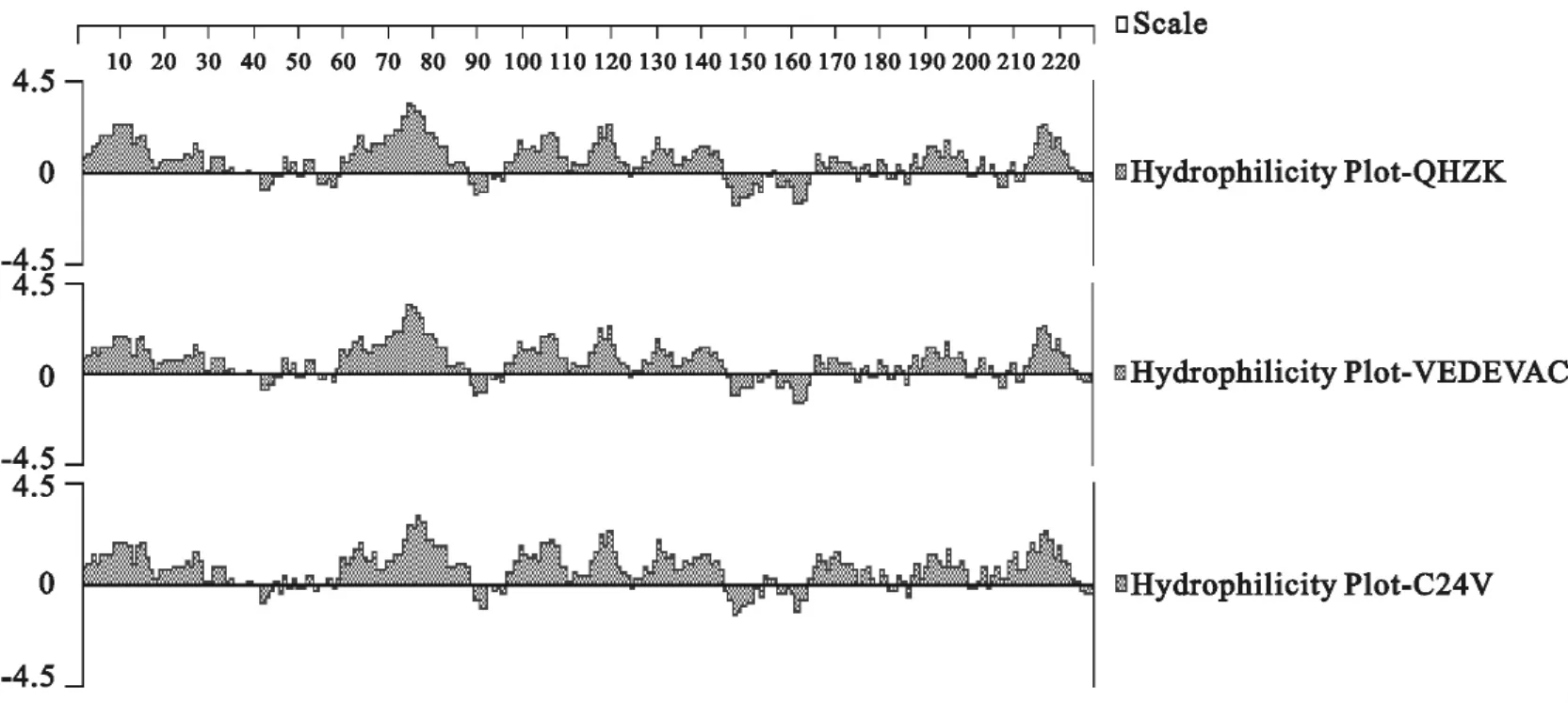
图2 BVDV QHZK、VEDEVAC和C24V株E0蛋白氨基酸亲水性比较Fig.2 Compaison of amino acid hydrophilicity of QHZK strain with VEDEVAC and C24V
图3表明,通过对QHZK株E0蛋白B细胞表位预测发现,在位点60~65、72~78、118~122、128~133、215~220处的峰值较高,而在该区域内E0蛋白氨基酸的亲水性与抗原性峰值均较高,因此,这些位点可能为BVDV QHZK株的B细胞抗原表位。

图3 BVDV QHZK株E0蛋白B细胞抗原表位预测Fig.3 Forecasting of B cell epitope of E0of BVDV QHZK strain
2.2 E0基因的原核表达
2.2.1 E0基因的 RT-PCR 扩增 将 RT-PCR产物用10g/L琼脂糖凝胶电泳鉴定,在700bp左右处有一特异性扩增条带,与预期产物大小相符(图4),表明从病料中成功扩增出了BVDV的E0基因。
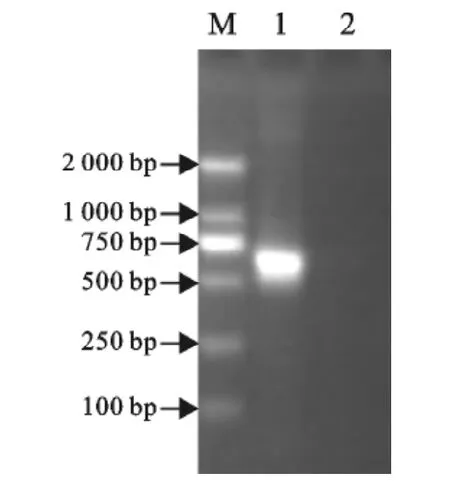
图4 E0基因RT-PCR扩增产物的鉴定Fig.4 Identification of RT-PCR product of E0gene
2.2.2 重组质粒pET-32a-E0的鉴定 重组质粒pET-32a-E0经PCR以及EcoRⅠ、XhoⅠ双酶切得到约700bp目的基因片段,与预期的结果一致(图5),证明重组质粒构建成功。
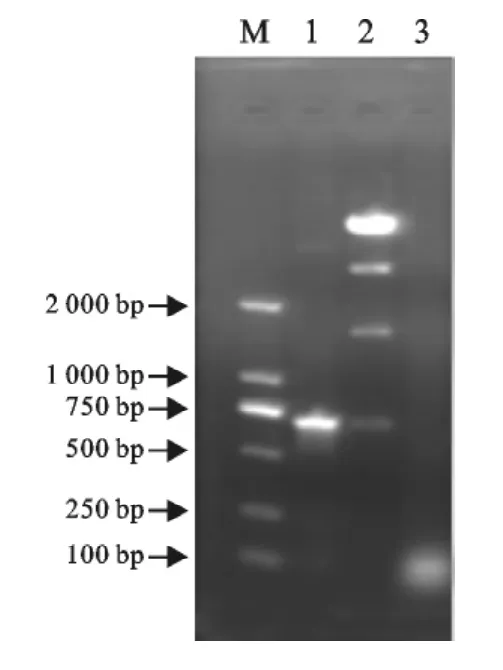
图5 重组质粒pET-32a-E0的PCR和酶切鉴定Fig.5 PCR and enzyme digestion identification of recombinant plasmid pET-32a-E0
2.2.3 E0基因表达产物的检测结果及纯化 重组质粒pET-32a-E0转化入Rosetta感受态细胞中,经IPTG诱导4h,将不同时间段收集的诱导菌液变性处理后进行SDS-PAGE分析(图6)。在约44ku分子质量标记处,出现明显的电泳条带,与预期结果相符,表明目的蛋白获得表达。表达的蛋白用His-Trap FF预装柱(GE公司)进行亲合层析纯化(图7)。
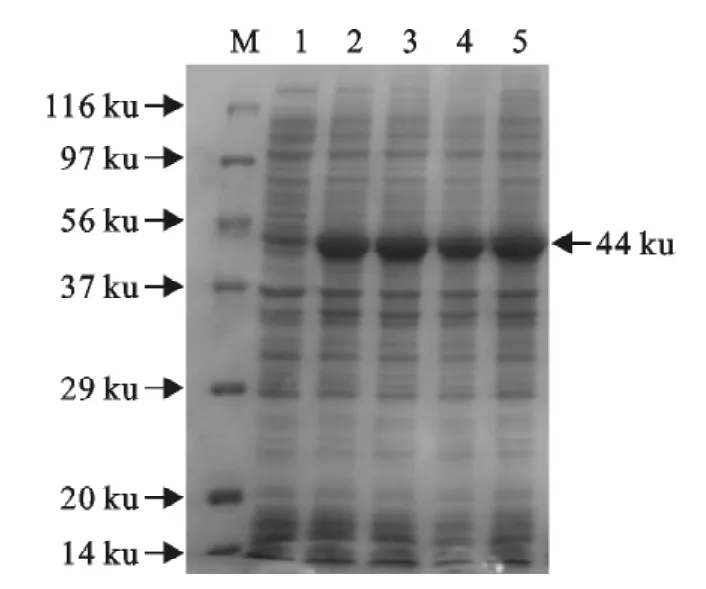
图6 E0基因表达产物的SDS-PAGE分析Fig.6 SDS-PAGE of E0gene expression
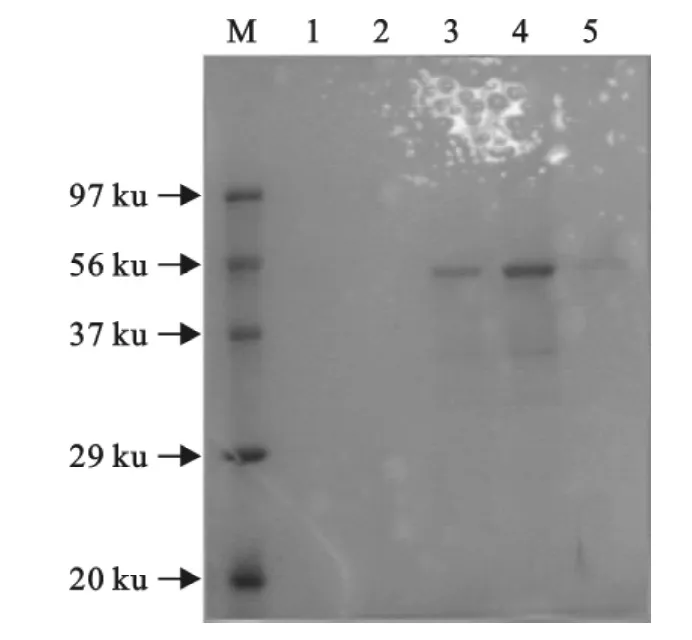
图7 E0基因表达产物纯化的SDS-PAGE分析Fig.7 SDS-PAGE of purified products of E0gene expression
2.2.4 QHZK株E0基因表达产物的 Western blot鉴定 用BVDV标准阳性血清与E0基因表达产物进行Western blot试验,结果显示牛抗BVDV标准阳性血清与表达的融合蛋白呈阳性反应,并且表达的蛋白与BVDV阴性血清不反应(图8),表明QHZK株BVDV E0基因获得正确表达。

图8 表达产物的Western blot检测Fig.8 Western blot analysis of the expressed protein
3 讨论
牦牛作为青藏高原上的稀有牛种,主要生长在我国2500m~5000m的高山草原上。自1983年,李佑民等[7]在我国首次分离并鉴定出BVDV以来,该病在我国牛群中流行较广,造成了极大的危害,此外,BVDV还能感染猪,并且在临床上不表现特征性的临床症状,多为持续性感染,这也是导致BVD广泛流行的原因之一,因此,建立特异、敏感、快速的诊断方法,研制有效的疫苗,预防和控制牛病毒性腹泻病的发生意义重大[8]。目前,国内学者对于牦牛BVDV分子生物学方面的报道较少,因此,开展牦牛BVDV的分子生物学研究意义重大。本研究对青海牦牛BVDV毒株的E0蛋白进行了生物信息学分析,采用生物学软件对E0蛋白的抗原指数、亲水性及B细胞抗原表位进行了分析。结果表明,E0蛋白氨基酸的亲水性与抗原性指数呈平行相关性,QHZK株E0蛋白氨基酸的亲水性与抗原性指数与标准毒株VEDEVAC、C24V非常相似,从而证明E0基因在BVDV各毒株间具有一定保守性,有利于亚单位疫苗研究。
本研究用原核表达载体表达BVDV E0基因时发现,E0基因所含的密码子有10%左右是E.coli不常用的稀有密码子。有资料表明,当目的基因中存在过多E.coli不常使用的密码子时,其在E.coli中的表达量一般很低[9],所以本研究在表达E0基因时采用了Rosetta(DE3)菌株,该菌株因可以提供密码子tRNAs,从而可以显著提高带有较多稀有密码子的E0基因在E.coli中的表达量,试验结果也证明E0蛋白得到了较高的表达量。
E0是BVDV编码蛋白中保守性较E2更高的蛋白,该蛋白上的中和表位产生的中和抗体具有中和BVDV和HCV的能力[10],氨基酸序列分析结果也表明,在此蛋白内有一高度保守的结构域,因此E0蛋白更适合做亚单位基因工程疫苗,E0蛋白氨基酸生物信息学分析也证明了这一点。本研究中所表达的E0蛋白在Western blot试验中能与标准毒株制备的抗BVDV阳性血清发生免疫反应。
[1]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001.
[2]Rumenapf T,Unger G,Strauss J H,et al.Processing of the envelope glycoproteins of peativiruses[J].J Virol,1993,67(6):3288-3294.
[3]胡炳峰,刘亚刚,王文伯,等.牦牛病毒性腹泻病病毒E2基因的克隆及序列分析[J].中国畜牧兽医,2010,37(2):93-96.
[4]Hertig C,Stalder H,Peterhans E.Genetic heterogenecity within the coding region of E2and NS2in strain of bovine viraldiarrhea virus[J].Gene,1995,153(2):191-195.
[5]项 勋,段 纲.牛病毒性腹泻/粘膜病病毒(BVDV)的分子生物学研究进展[J].家畜生态,2004,25(4):202-204.
[6]张芳芳,王光华,郑福英,等,青海牦牛病毒性腹泻病毒的分离与鉴定[J].中国兽医科学,2011,41(11):1101-1105.
[7]李佑民,刘振润.牛病毒性腹泻/粘膜病病毒株(长春184株)的分离与鉴定[J].兽医大学学报,1983,3(3):113-120.
[8]杨小燕,魏春华,刘建奎,等.猪源牛病毒性腹泻病毒的分离鉴定[J].中国兽医科学,2011,41(1):9-13.
[9]Chen T,Inouye M.Suppression of the negative effect of minor argine codons on gene expression,preferential usage of minor codons with in the first 25codons of the Eschiscoli genes[J].Nucleic Acids Res,1990,18:1465-1473.
[10]于吉锋,刘亚刚,杨小艳,等.牛病毒性腹泻病毒牦牛株E0基因生物信息学分析及原核表达与抗原性检测[J].西南民族大学学报,2009,35(3):504-507.
