猪繁殖与呼吸综合征病毒受体CD163基因敲除载体的构建
2012-06-29于飞飞陈福旺曹宇航傅震洲王安峰任林柱
于飞飞,陈福旺,宋 娜,杨 鑫,曹宇航,张 娟,傅震洲,王安峰,任林柱
(吉林大学畜牧兽医学院,吉林 长春 130062)
基因敲除是通过同源重组将外源基因整合入靶细胞基因组特定位置,以达到置换、修饰、改造靶基因,从而改变靶基因所控制的生物性状的目的[1]。随着分子生物学的发展,各种基因敲除动物相继问世。1987年Doetschman等建立了次黄嘌呤磷酸核糖基转移酶基因定点敲除的小鼠模型[2];1997年[3]英国科学家Willmut首次报道了克隆羊“多利”的诞生,开创了以体细胞为核供体的克隆动物先例,极大地推动了哺乳动物体细胞克隆技术的发展[4];潘求真等[5]研究了山羊体细胞基因打靶克隆,为高表达转基因动物的制备提供了良好的手段与方法。近年来将基因敲除技术与核移植技术结合起来,制备和培育转基因动物取得了较大的进步。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的以流产、死胎、胎儿木乃伊化和呼吸道疾病为特征的传染病[6]。PRRSV属于动脉炎病毒科、动脉炎病毒属,基因组为单股正链RNA病毒,基因组全长约15kb[7]。根据病原基因组和血清型特性主要分为美洲型(代表株为VR2332)和欧洲型(代表株为LV),两者的核苷酸序列同源性约为60%,现阶段在我国流行的主要为美洲型毒株[8]。完全分化的原代猪肺泡巨噬细胞(porcine alveolar macrophage,PAM)是 PRRSV感染的靶细胞。研究发现,在PAM上存在PRRSV的3个受体,分别为硫酸乙酰肝素(heparin sulphate,HS)、唾液酸黏附素 (sialoadhesin,Sn)和CDl63(cluster of differentiation 163)分子[9-12]。
CD163又名M130,为具有丰富半胱氨酸的清道夫受体家族(scavenger receptor cysteine rich,SRCR)成员之一,是单链跨膜糖蛋白分子,也是一种巨噬细胞分化的抗原。研究发现,CD163具有单核细胞-巨噬细胞特异性,在全身各种含丰富巨噬细胞的器官(如脾、肝、骨髓和淋巴结等)上高表达[13-14]。该蛋白在非易感的细胞表达,能使细胞获得感染PRRSV的能力,还能产生子代病毒,抗人CD163的抗体可以阻断PRRSV的感染,表明CD163是该病毒的必需受体。
本研究首先扩增CD163基因5'-端片段做为同源重组左臂,基因3'-端片段做为同源重组右臂,与正负向筛选基因连接,构建含正负筛选标记的CD163基因的打靶载体,为构建猪繁殖与呼吸综合征病毒受体CD163基因缺失细胞系和进一步明确CD163在PRRSV感染过程中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种及质粒 E.coli DH5α及含正、负筛选标志基因的打靶载体PSSC-9载体由本实验室保存。克隆载体pGEM-T购自天根生化科技(北京)有限公司。
1.1.2 工具酶及试剂盒 限制性内切酶SalⅠ、HindⅢ、BamHⅠ、SfiⅠ购自Fermentas Molecular Biology公司;T4连接酶、2×Taq plus PCR MasterMix、DNA Marker 2000、DNA Marker 15000、DNA MarkerⅢ、细胞组织基因组提取试剂盒购购自天根生化科技(北京)有限公司;质粒提取试剂盒、胶回收试剂盒购自博日科技(Bioflux)生物技术开发中心。
1.2 方法
1.2.1 同源臂扩增引物的设计与合成 依据Gen-Bank上的猪CD163基因,利用引物设计软件Oligo 6.0设计一对引物 PCDE2-3F和 PCDE3-4R,扩增同源左臂(Sarm,约1.1kb),引物 PCDE5-6F 和PCDE5-6R扩增同源右臂(Larm,约4.5kb)。
1.2.2 同源臂的扩增及克隆 采用北京天根生化技术有限公司的TIANamp Genomic DNA Kit从猪新鲜组织中提取猪基因组DNA,以上述引物分别扩增同源左、右臂。
左臂扩增反应体系为:模板DNA为3μL,Primer 1(10μmol/L)与Primer 2(10μmol/L)均为2μL,2×Mster Mix为25μL,其余用ddH2O补至50μL。PCR反应条件为94℃3min;94℃30s,55℃30s,72℃2 min,后延伸72℃10min,30个循环。
右臂扩增体系为:模板 DNA、Primer 3(10 μmol/L)与 Primer4(10μmol/L)均为1μL,2×Master Mix为12.5μL,其余用ddH2O补至20 μL。PCR反应条件94℃5min,94℃30s,55℃30,72℃5min;后延伸72℃10min,30个循环。
将上述同源臂PCR扩增产物经胶回收,连接在pGEM-T载体上。
1.2.3 T-Sarm与T-Larm重组质粒鉴定 对重组的质粒进行酶切鉴定,其中左臂用HindⅢ和BamHⅠ双酶切,右臂用SalⅠ单酶切。此外,对连接在pGEM-T载体上的同源左右臂进行测序分析,以检验其正确性。
1.2.4 打靶载体的构建 将鉴定正确的左、右臂片段酶切回收,亚克隆到pSSC-9载体上构建成CD163基因敲除打靶载体。其中左臂用HindⅢ和BamHⅠ双酶切,右臂用SalⅠ单酶切。用PCR方法和测序分析对重组质粒进行鉴定。
2 结果
2.1 同源臂的扩增
提取猪基因组DNA,用PCR法成功扩增了CD163基因打靶的同源左右臂,电泳及测序结果证明右臂大小约为4.5kb,左臂约为1.1kb(图1)。
2.2 同源臂克隆及鉴定
将上述扩增的CD163基因打靶的同源左右臂,与载体pGEM-T连接,经PCR、酶切及测序鉴定,证明成功地将CD163基因打靶的同源左右臂克隆到了pGEM-T载体上(图2,图3)。

图1 同源臂PCR扩增结果Fig.1 PCR amplification of homologous arms
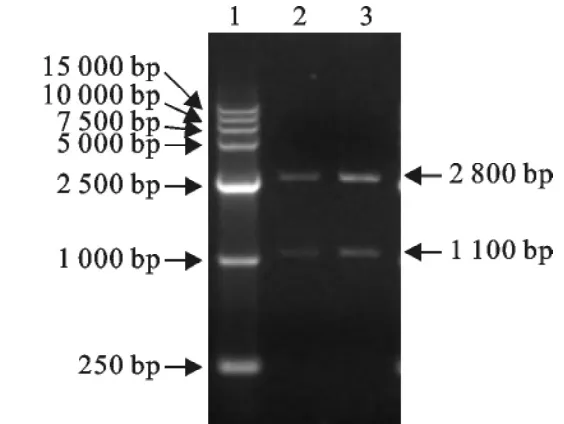
图2 T-Sarm的酶切鉴定Fig.2 Identification of T-Sarm with enzyme digesition
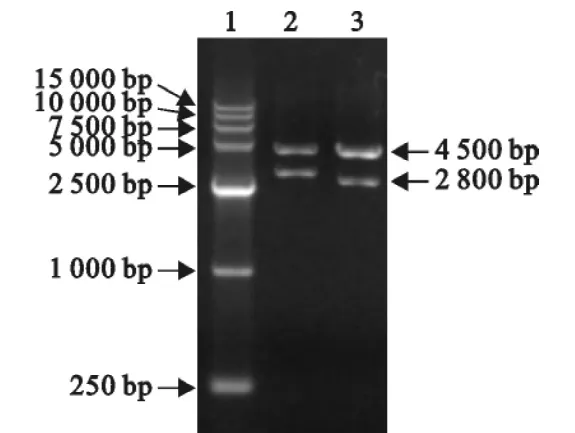
图3 T-Larm的酶切鉴定Fig.3 Identification of T-Larm withenzyme digesition
2.3 CD163基因敲除打靶载体的构建及鉴定
将上述成功克隆的CD163基因打靶的同源左右臂用内切酶进行酶切,回收相应的DNA片段,并与pSSC-9连接,经酶切鉴定、PCR鉴定和测序分析,证明成功的构建了CD163基因敲除打靶载体pSSC-Larm-Sarm(图4,图5)。
3 讨论

图4 左臂鉴定图Fig.4 Identification of the left homologous arm
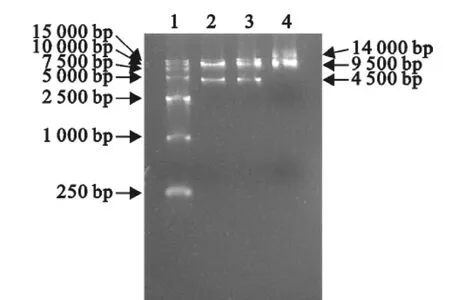
图5 右臂鉴定图Fig.5 Identification of the right homologous arm
同源重组被广泛用于基因敲除策略中,同源DNA序列发生遗传交换致使外源基因整合到靶细胞基因组中并将目的基因替换以达到基因敲除的目的,所以,试验要求同源左右臂要具有高度的同源性[15]。本试验提取猪基因组DNA,用PCR法成功扩增了CD163基因打靶的同源左右臂,成功获得了同源右臂(4.5kb)和左臂(1.1kb),并经测序发现,其同源性高,扩增效果好,同源左右臂中碱基错配机率小。此外,同源序列越长我们扩增的难度就越大,同时也影响胶回收的效果,而同源序列较短时,重组的概率减小[16],以至于影响阳性细胞的克隆,本试验中,右臂约4.5kb,左臂约为1.1kb,同源臂长度设计合理,扩增效果良好。
Chauhan S S等[17]构建了pSSC-9通用型载体,该载体上存在Neo和HSV-tk双标记基因,它们与同源左右臂相连,同源重组发生时,同源部分发生双交换,负筛选基因将被去除,正筛选基因整合到靶细胞基因组中,以配合G418、GANC双筛选,这个过程中载体与靶细胞基因组发生双交换,只有正确重组的基因组在正负筛选系统中得以保留[18]。其打靶效率高,阳性细胞易于筛选和鉴别,阳性克隆明显,整个操作过程可行性高,是目前最常用的敲除载体,也是我们的选择该载体的原因。
Calvert J G 等[13]发 现 CD163是 PRRSV 感 染Marc-145细胞所必须的受体。Van Gorp H 等[19]在Marc-145细胞检测到CD163,并将细胞内的CD163定位至早期内吞体。在非易感细胞系CHO-K1、BHK-21和PK-15中瞬时表达CD163基因后,病毒可以复制并产生子代病毒,但是病毒感染的效率比较低[13,19]。
本试验以猪基因组为模板,扩增猪繁殖与呼吸综合征病毒受体CD163基因同源左臂和同源右臂,将扩增片段与pGEM-T载体连接后进行部分序列测定,并与已知相应片段进行同源性分析;再将扩增的同源左右臂分别酶切后定向连接至pSSC-9载体中,构建含Neo和Tk基因的双标记打靶载体pSSCLarm-Sarm,为构建猪繁殖与呼吸综合征病毒受体CD163基因缺失细胞系奠定了基础。同时,我们已经将线性化的打靶载体用脂质体法导入猪的胎儿成纤维细胞,阳性细胞的筛选和鉴定工作正在进行之中。
[1]生秀杰,王大一.基因打靶的策略及其发展 [J].国外医学:遗传学分册,2001,24(1):8-10.
[2]Koller B H,Hagemann L J,Doetschman T,et al.Germline transmission of a planned alteration made in a hypoxanthine phosppphoribosyl-transferase gene by homologous recombination in embryonic stem cells[J].Pro Natl Acad Sci USA ,1989,86(22):8927-8937.
[3]Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385(6619):810-813.
[4]周 健,林爱星,陈永福.敲除猪α1,3-半乳糖基转移酶基因并敲入HLA-G1基因的打靶载体构建 [J].中国生物医学工程学报,2005,24(4):498-502.
[5]潘求真,陆泉枝,王 海,等.山羊体细胞转基因方法的探讨[J].畜牧兽医学报,2004,35(2):121-124.
[6]刘光清,蔡雪晖,仇华吉,等.猪繁殖与呼吸综合征的研究进展[J].中国预防兽医学报,2001,23(1):72-76.
[7]鑫 婷,侯绍华,贾 红,等.猪繁殖与呼吸综合征病毒的分子流行病学分析[J].中国畜牧兽医,2009,36(8):115-121.
[8]Cha S H,Choi E J,Park J H,et al.Molecular characteriza-tion of recent Korean porcine reproductive and respiratory syndrome(PRRS)viruses and comparison to other Asian PRRS viruses[J].Vet Microbiol,2006,117(2-4):248-257.
[9]Kim J K,Fahad A M,Shanmukhappa K,et al.Defining the cellular target(s)of porcine reproductive and respiratory syndrome virus blocking monoclonal antibody 7G10[J].J Virol,2006,80(2):689-696.
[10]李清州,达龙珠,鲍登克,等.猪繁殖与呼吸综合征病毒受体研究进展 [J].动物医学进展,2010,31(12):100-103.
[11]An T Q,Tian Z J,He Y X,et al.Porcine reproductive and respiratory syndrome virus attachment is mediated by the N-terminal domain of the sialoadhesin receptor[J].Vet Microbiol,2010,143(2-4):371-378.
[12]Delputte P L,Costers S,Nauwynck H J.Analysis of porcine reproductive and respiratory syndrome virus attachment and internalization:distinctive roles for heparan sulphate and sialoadhesin[J].J Gen Virol,2005,86(Pt5):1441-1445.
[13]Calvert J G,Slade D E,Shields S L,et al.CD163expression confers susceptibility to porcine reproductive and respiratory syndrome virus[J].J Virol,2007,81(14):7371-7379.
[14]Das P B,Dinh P X,Ansari I H,et al.The minor envelope glycoproteins GP2aand GP4of porcine reproductive and respiratory syndrome virus interact with the receptor CD163[J].J Virol,84(4):1731-1740.
[15]Capecchi M R.Altering the genome by homologous recombination[J].Science,1989,244(4910):1288-1292.
[16]Shukman M J,Nissen L,Collin C.Homologous recombination in hybridoma cells:dependence on time and fragment length[J].Mol Cell Biol,1990,10(9):4466-4472.
[17]Chauhan S S,Gottesman M M.Construction of a new universal vector for insertional mutagenesis by homologous recombination[J].Gene,1992,120(2):281-285.
[18]Smithies O,Gregg R G,Boggs S S,et al.Insertion of DNA sequences into the human chromosomal beta-globin locus by homologous recombination[J].Nature,1985,317(6034):230-234.
[19]Van Gorp H,Van Breedam W,Delputte P L,et al.Sialoadhesin and CD163join forces during entry of the porcine reproductive and respiratory syndrome virus [J].J Gen Virol,2008,89(Pt 12):2943-2953.
