体外分离子宫内膜干细胞3种方法的比较*
2012-06-20郭玉琪赵潇丹
郭玉琪,赵潇丹,路 平,张 展
郑州大学第三附属医院妇产科郑州450052
目前,可以通过体外培养获得大量的子宫内膜干细胞,通过介入途径、局部种植和静脉途径等方法来治疗子宫内膜相关疾病[1],特别是由于子宫内膜过薄、生长不良等原因导致的受精卵无法着床或子宫内膜容受性差等原因导致的不孕,为因子宫内膜相关原因不孕患者提供了一种新的治疗方法。虽然国内外研究者[2-3]已探索出多种分离子宫内膜干细胞的方法,然而,目前还未建立标准的体外分离、培养子宫内膜干细胞的方法,也未建立合适的体外培养条件。该研究旨在寻找一种比较简便、实用、高效的体外分离、培养子宫内膜干细胞的方法,为进一步从细胞和分子水平研究子宫内膜干细胞的各种功能及其干预调节奠定基础。
1 材料与方法
1.1 主要试剂 PBS 液(无 Ca2+、Mg2+)、2.5 g/L胰蛋白酶(上海泛柯生物科技有限公司),胶原酶Ⅰ(美国Invitrogen公司),胎牛血清(杭州四季青生物制品公司),DMEM/F12培养基(美国Gibco公司),青链霉素溶液(鲁抗制药厂生产),台盼兰染色液、逆转录试剂盒、PCR试剂盒、DAB显色试剂盒、CD90抗体和CD146抗体(北京中杉金桥生物技术有限公司)。
1.2 标本来源和处理 选取2010年3月至5月于郑州大学第三附属医院,因子宫肌瘤、子宫脱垂、原位宫颈癌等而进行子宫切除手术的患者,年龄31~49岁。术前3个月未使用过任何激素。术后立即取材,在子宫体后壁、距宫底1~2 cm处,无菌剃取子宫内膜组织并包括5 mm的子宫肌层。用PBS缓冲液进行冲洗,直到液体清亮。移入含双抗的DMEM细胞培养液中,转送至超净工作台。在超净工作台内,将所取患者的子宫内膜标本平均分为3份,分别放在3个培养皿中,分别采用不同的方法进行消化分离。
1.3 子宫内膜干细胞的分离和培养
1.3.1 细胞的分离 ①方法A:采用胰蛋白酶对细胞进行消化。把新鲜子宫内膜组织剪碎,置于含2.5 g/L胰蛋白酶中,37 ℃振荡消化20~30 min,加人含体积分数10%胎牛血清的D/F12培养基终止消化,并用Pasteur吸管反复抽吸、吹打,对细胞群进行机械消化。②方法B:采用胶原酶Ⅰ对细胞进行消化。在剪碎的子宫内膜组织中加入胶原酶Ⅰ,使其分离为单细胞悬液,37℃消化50~60 min。将消化好的细胞悬液吸入离心管中,静置以去除未完全消化的大块组织,然后1 200 r/min离心5 min取上清。③方法C:采用混合消化细胞法进行操作。将取出的子宫内膜组织置于冰上,PBS洗涤并剔除血块,剪成小于1 mm3的小块(肉眼呈糊状)后加入2 g/L胶原酶Ⅰ(胶原酶与组织体积比为5∶1),吹打混匀后,置于37℃、含体积分数5%CO2培养箱中消化1 h,30 min时取出吹打1次。然后加入胰蛋白酶,吹打混匀后继续消化20 min。1 000 r/min离心5 min,弃上清,加入D/F12培养基洗涤后,用100目筛网过滤,滤液经1 000 r/min离心5 min,收集沉淀。
1.3.2 细胞的接种和培养 分离得到的细胞洗涤后,用台盼兰染色计数活细胞,按照5×108L-1的细胞密度接种于含体积分数10%胎牛血清、D/F12和青链霉素溶液的25 cm2的培养瓶中,37℃、体积分数5%CO2培养箱孵育。24 h后换液,弃除未贴壁细胞,继续培养,每2~3 d换液1次。严密观察细胞生长情况。细胞生长约14 d左右铺满培养瓶底,即可进行传代,弃去培养瓶中的培养液,用PBS洗2次,加入2.5 g/L胰蛋白酶1 mL消化2~3 min,镜下见细胞收缩变圆,立即加入含有体积分数10%胎牛血清的D/F12培养基,终止消化,并反复用吸管取瓶底液吹打成为细胞悬液后移入15 mL离心管中,1 000 r/min离心5 min,弃上清后再次加入含胎牛血清的D/F12培养液6 mL,按1∶2传代的比例分成2个培养瓶继续培养。
1.4 细胞生长曲线的绘制 取第2代细胞,用2.5 g/L胰蛋白酶消化后,接种于24孔细胞培养板中,每孔接种 1 mL,细胞密度为 1.5 ×1010L-1,将培养板置于CO2恒温细胞培养箱中继续静置密闭培养。每日计数3孔,取平均值,连续计数7 d,绘制细胞生长曲线。
1.5 细胞鉴定
1.5.1 CD90和CD146蛋白检测 采用免疫细胞化学SP法检测。取第2代细胞,2.5 g/L胰蛋白酶消化后按1×109L-1的密度接种于载玻片上,待细胞爬满载玻片后,PBS清洗3次,40 g/L多聚甲醛固定20 min;PBS清洗;体积分数3%H2O2处理10 min,正常血清工作液封闭10 min,加入一抗(按1∶100稀释)于载玻片上(37℃,2 h);PBS清洗后加入二抗(37℃,0.5 h);DAB显色2~6 min;苏木素复染2~6 min;树胶封闭固定;显微镜下观察。以胞核或胞质呈淡黄色至深棕黄色为CD90和CD146阳性细胞,显色强度与背景无明显差别者为阴性。高倍镜(×400)下观察,阳性细胞百分比>90%为培养成功。
1.5.2 CD90和 CD146 mRNA的检测 取第2代细胞,2.5 g/L胰蛋白酶消化后,2 000 r/min离心5 min,弃上清,加入1 mL PBS吹打混成细胞悬液后备用。采用Trizol法提取细胞总RNA,逆转录得cDNA后,进行 PCR反应。CD90引物序列为:上游5’-TAGTGGACCAGAGCCTTCG-3’,下 游 5’-GTTCGG GAGCGGTATGTG-3’,扩 增 片 段 大 小 150bp。CD146引物序列为:上游 5’-ACCAGGGAGGCA GAGGAA-3’,下 游 5’-TGACGCTTCACAAGACA GATT-3’,扩增片段大小500 bp。内参β-actin引物序列为:上游 5’-CTGGGACGACATGGAGAAAA-3’,下游 5’-AAGGAAGGCTGGAAGAGTGC-3’,扩增片段大小564 bp。扩增条件:94℃预变性2 min;94℃变性30 s,55 ℃退火30 s,72℃延伸2 min,共30个循环;72℃总延伸6 min。PCR结果采用EB染色,在紫外线投射仪下观察电泳条带,用大连Jim-X Scientific D-140图像记录分析系统进行分析。
2 结果
2.1 3种分离子宫内膜干细胞的效果比较 消化后的细胞经培养均得到形态一致的细胞,3种方法组织消化时间、活细胞数量、细胞贴壁时间和细胞纯度的比较见表1。可见,方法B分离培养子宫内膜干细胞具有一定的优势,活细胞数量多,细胞贴壁较牢,细胞纯度高,杂质少。
2.2 方法B分离、培养细胞的形态学特点 细胞接种于培养瓶24~48 h后贴壁生长,3 d后大约可见细胞有细小突起自边缘爬出。7~9 d可以长满25 cm2的培养瓶。倒置显微镜下可见到:少量细胞为多角形,有多个短小细胞突出,胞质薄而透明,核圆居中,细胞排列无极性,平铺生长。大多细胞为梭形,具有成纤维细胞形态,胞质丰富,核椭圆(图1)。
2.3 细胞生长曲线的比较 3种方法所得的第2代细胞生长曲线图相似,均为近似的“S”形(图2),有明显的滞留期、对数生长期和平台期。

表1 3种细胞分离方法的比较


2.4 方法B培养第2代细胞CD90和CD146的表达 见图3,CD90和CD146蛋白表达阳性的细胞均>90%。RT-PCR鉴定结果见图4。
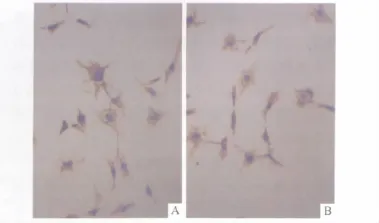
图3 第2代细胞CD90(A)和CD146(B)蛋白的表达 (SP,×400)
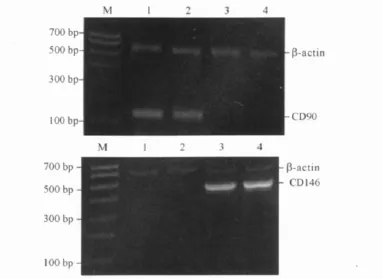
图4 第2代细胞CD90(上)和CD146(下)mRNA的表达
3 讨论
该实验将子宫内膜上皮细胞和基质细胞进行混合培养,可以更好地发挥二者的协同作用,更加真实的模拟体内环境,利于细胞的生长。作者采用3种方法对细胞进行消化培养。方法A用胰蛋白酶对细胞进行消化,优点为消化时间短,但细胞损伤较大,消化后细胞悬液黏度大,细胞不易分离,细胞纯度不高,活细胞数量较低,生长缓慢,贴壁不牢。方法B用胶原酶Ⅰ消化细胞,消化后细胞活率高,细胞的纯度高,细胞易于贴壁,生长状态良好。方法C为混合消化法,消化时间介于前两者之间,细胞经筛网过滤后,纯度较高,但细胞数量丢失较多,筛网反复过滤,增加了操作步骤同时也增加了细胞污染的机会,因此操作要求非常严格。可以看出,用胶原酶Ⅰ法分离培养子宫内膜干细胞具有一定的优势,这可能是因为:胶原酶是从溶组织梭状细胞芽孢杆菌提取制备的,主要水解结缔组织中胶原蛋白成分,可使上皮细胞与胶原成分分离而不受损害。
由于目前尚无特异性标记的抗体用于子宫内膜干细胞的鉴别[4],所以该实验选取造血干细胞的主要标志 CD90[5]和间质干细胞标志物 CD146[6],采用RT-PCR方法和免疫细胞化学方法对培养的细胞进行鉴定,结果表明采用方法B培养的细胞CD90和CD146蛋白及mRNA有表达,具有子宫内膜干细胞的特性。
[1]Meng X,Ichim TE,Zhong J,et al.Endometrial regenerative cells:a novel stem cell population[J].J Transl Med,2007,5:7A
[2]Musina RA,Belyavski AV,Tarusova OV.Endometrial mesenchymal stem cells isolated from the menstrual[J].Blood,2008,45(4):539
[3]Li L,Xie T.Stem cell niche:structure and function[J].Annu Rev Cell Dev Biol,2005,21(3):605
[4]习佳飞,王韫芳,裴雪涛.成体干细胞及其在再生医学中的应用[J].生命科学,2006,8(4):328
[5]Meng X,Ichim TE,Zhong J,et al.Endometrial regenerative cells:a novel stem cell population[J].J Trans Med,2007,15(5):57
[6]Schwab KE,Gargett CE.Co-expression of two perivascular cell markers isolates mesenchymal stem-like cells from human endometrium[J].Hum Reprod,2007,22(11):2903
