依达拉奉对大鼠XRCC1和细胞凋亡的影响
2012-06-18薛荣亮赵红霞
王 智,薛荣亮,赵红霞,高 慧,魏 欣
临床上遇到心跳骤停等危急状况,经过积极抢救后,尽管呼吸心跳恢复,但常遗留不同程度的脑机能障碍,这主要与脑缺血再灌注损伤以及迟发性神经元细胞凋亡有关[1]。神经元细胞凋亡可由多种因素启动,DNA损伤与修复直接关系到细胞结构和功能的恢复。研究发现,DNA修复蛋白表达的逐渐衰减导致细胞凋亡逐渐增多[2]。如能发现对DNA损伤修复及细胞凋亡起保护作用的因素,有可能为临床治疗缺血性脑损伤疾病提供一条新的途径。
近年研究表明,依达拉奉通过清除自由基,抑制脂质过氧化和细胞坏死,从而改善脑缺血及再灌注后的细胞功能,达到脑保护的作用[3]。同时,许多相关研究表明,依达拉奉可以减少自由基对DNA损伤[4-6]。但是其发挥脑保护作用的具体机制尚不清楚,目前鲜有资料报道依达拉奉对全脑缺血/再灌注中DNA损伤与神经元细胞凋亡的影响。本实验建立了全脑缺血/再灌注大鼠模型,拟研究脑缺血敏感区海马CA1区DNA修复蛋白XRCC1表达变化与细胞凋亡的关系及依达拉奉对其的影响,探索依达拉奉脑保护机制,以期为临床治疗脑缺血/再灌注损伤、改善预后提供新的思路和理论依据。
1 材料与方法
1.1 材料 健康雄性SD大鼠108只,鼠龄55~65 d,体质量290~310 g,由西安交通大学医学院动物实验中心提供。术前夜禁食,随意进水。依达拉奉(购自吉林省博大制药有限责任公司),原位末端标记细胞凋亡检测试剂盒(购自美国Promega公司),SABC(兔IgG)-POD试剂盒(购自武汉博士德生物工程有限公司),DAB显色试剂盒、XRCC1兔抗多克隆抗体(均购自北京博奥森生物技术有限公司)。
1.2 方法
1.2.1 实验动物分组 108只大鼠随机分成3组:假手术组(SH组)、缺血/再灌注组(IR组)、依达拉奉干预组(ED组)。每组根据再灌注后处死时间的不同再分为2、6、12、24、48 和 72 h 6 个亚组,每亚组6只大鼠。
1.2.2 模型制备 采用四血管阻塞法[7]建立SD大鼠全脑缺血再灌注损伤模型。IR组和ED组动物予以微动脉夹夹闭颈总动脉5min后,松开动脉夹以恢复脑血流。SH组大鼠仅游离暴露双侧颈总动脉及椎动脉,不予以凝断椎动脉和夹闭双侧颈总动脉处理。SH组和IR组全脑缺血再灌注后,即时分别腹腔注射生理盐水4mL/kg,ED组腹腔注射依达拉奉溶液10 mg/kg。三组大鼠分别于再灌注后2、6、12、24、48、72 h 给予处死。以4%多聚甲醛200mL心脏灌注处死,取出完整大脑,在视交叉后1mm和4mm处各切一刀,取中间小块脑组织(海马头端),将组织块在4%多聚甲醛液中浸泡,4℃保存3 d后制备切片。
1.2.3 原位细胞凋亡检测法(TUNEL) 取海马冠状石蜡切片,常规二甲苯、乙醇脱蜡至水。蛋白酶K(20 mg/L)室温消化,用甲醇配制的30mL/L过氧化氢消除内源性辣根过氧化酶活性,加末端脱氧核糖核酸转移酶(TdT)与生物素标记的核苷混合物(biotin-11-dUTP)混合反应进行孵育,再加链霉抗生物素蛋白辣根过氧化物酶溶液(Streptavidin-HRP溶液)进行孵育,用DAB显色,核呈深棕黄色者为凋亡细胞,最后复染、脱水、透明、封片。400倍光镜下观察每张切片海马CA1区,随机选取5个视野,分别计算凋亡细胞数和总细胞数。定量分析方法:光镜下计算凋亡指数(Apoptosis Index,AI)。凋亡指数计算方法:分别计算凋亡细胞数和总细胞数,AI=凋亡细胞数/总细胞数×100%。
1.2.4 免疫组织化学检测 取海马冠状石蜡切片,采用SABC法行免疫组化法。切片依次脱蜡至水,30mL/L过氧化氢孵育10min,三蒸水冲洗5min。PBS(pH 7.4)浸泡5min,电炉水浴抗原修复,加热至95℃ 15~20min后,自然冷却至室温。滴加正常山羊封闭血清,室温孵育1 h,浸入勿洗。滴加1∶100的XRCC1多抗,放入4℃冰箱过夜。PBS冲洗5min,3次,擦干切片周围水分后,滴加生物素标记的二抗,37℃温箱孵育1 h;PBS冲洗5min,3次,擦干切片周围水分后,滴加SABC复合物,放入37℃温箱孵育20min。三蒸水洗5min,3次,DAB显色,脱水、透明、封片。切片中显示细胞胞浆黄染、有棕黄色颗粒者为XRCC1阳性细胞。定量分析方法:光镜下计算阳性细胞指数。方法:在400倍光镜下观察切片海马CA1区,随机选取5个视野,分别计算阳性细胞数和总细胞数,阳性细胞率 =阳性细胞数/总细胞数×100%。
2 结果
2.1 TUNEL法 SH组凋亡率较低;IR组凋亡率于缺血再灌注后6 h开始明显增多,48 h凋亡率最高,与SH组比较,IR组凋亡率显著增高(P<0.01);ED组在6 h后各时点凋亡率较IR组明显降低(P<0.01)。见表1、图1~图3。

表1 大鼠全脑缺血再灌注后各时点海马CA1区凋亡指数比较

图1 光镜下缺血再灌注48 h SH组海马CA1区细胞凋亡情况(TUNEL染色,×400)

图2 光镜下缺血再灌注48 h IR组海马CA1区细胞凋亡情况(TUNEL染色,×400)

图3 光镜下缺血再灌注48 h ED组海马CA1区细胞凋亡情况(TUNEL染色,×400)
2.2 XRCC1蛋白免疫组化显示,SH组XRCC1蛋白在各时点表达较明显;IR组XRCC1表达在缺血再灌注后2 h开始明显下降,与SH组比较,差异有统计学意义(P<0.01)。ED组XRCC1表达降低没有IR组明显,在各时点与IR组比较,差异均有统计学意义(P<0.01)。见表2、图4~图6。

表2 大鼠全脑缺血再灌注后各时点海马CA1区XRCC1阳性细胞率的比较

图4 光镜下缺血再灌注48 h SH组海马CA1区XRCC1表达(免疫组化,×400)
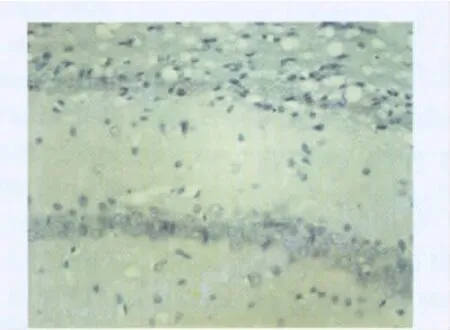
图5 光镜下缺血再灌注48 h IR组海马CA1区XRCC1表达(免疫组化,×400)

图6 光镜下缺血再灌注48 h ED组海马CA1区XRCC1表达(免疫组化,×400)
3 讨论
脑缺血再灌注损伤是一个极为复杂的病理生理过程,其中包括众多环节,如能量代谢障碍、兴奋性氨基酸毒性作用、氧自由基生成、线粒体功能障碍、细胞内钙超载等[9-10]。这些环节互为因果,彼此关联,并相互联系,形成恶性循环,最终造成比缺血更加严重的组织功能损伤。
在对脑缺血再灌注损伤机制的研究中,发现许多因素都可以引起DNA损伤,同时亦会损伤DNA的修复功能[11],DNA损伤与修复直接关系到细胞结构与功能的恢复,是脑缺血再灌注损伤的关键。脑缺血再灌注损伤中,DNA的损伤和修复功能降低可最终导致神经元细胞凋亡[2]。研究发现,脑缺血/再灌注后的细胞凋亡是一个具有时间依赖性的动态演变过程,尚未凋亡的细胞,随着再灌注时间的延长和DNA损伤的逐渐累积而最终导致凋亡[12]。
X线修复交叉互补组1(X-ray repair cross complementing 1,XRCC1)基因是参与哺乳动物DNA修复的重要修复基因之一,其编码翻译的XRCC1蛋白作为碱基切除修复中介,可调节酶的活性。XRCC1蛋白上调DNA连接酶3、脱嘌呤嘧啶核酸内切酶、多核苷酸激酶,抑制PARP-1/2和DNA聚合酶 β 的活性[13]。因此,XRCC1蛋白通过影响所有参与DNA碱基切除修复的关键酶,在细胞对DNA损伤反应中发挥极其重要的作用。缺乏XRCC1蛋白的细胞死亡率增加10倍,DNA单链损伤的修复率为不缺乏XRCC1蛋白细胞的1/5[14]。有研究应用成年CD-1雄鼠局灶脑缺血再灌注模型、免疫组化和 TUNEL双标,表明失去XRCC1免疫活性神经元同时表达TUNEL阳性,表明XRCC1早期降低先于DNA断裂的发生,并导致随后的细胞凋亡[15]。在缺血脑损伤中,导致XRCC1蛋白下降的具体机制还不清楚,如果能早期发现这些DNA修复功能受损但尚未凋亡的细胞,并积极采取措施使之逆转,则有可能为临床治疗缺血性脑损伤疾病提供一条新的途径。
依达拉奉是一种新型自由基清除剂和抗氧化剂,其分子结构上具有亲脂基团,血脑屏障的通透性高[16-17]。其作为自由基捕获剂,能抑制黄嘌呤氧化酶和次黄嘌呤氧化酶的活性,刺激前列环素的生成,减少炎症介质白细胞三烯生成,降低羟自由基浓度,缩小缺血半暗带发展成梗死的体积[18-19]。Yamamoto 等[20]建立脑缺血模型,于再灌注后静注依达拉奉,并在海马内植入微透析探针,发现依达拉奉可抑制再灌注后羟自由基产物-2,3二羟基苯甲酸(2,3-DHBA)浓度的增加,减少海马锥体细胞凋亡,说明依达拉奉可抑制缺血后海马区迟发性神经细胞死亡。但依达拉奉抑制细胞凋亡的具体机制,特别是在全脑缺血再灌注后对DNA损伤修复有哪些影响,鲜有资料报道。
本试验通过建立全脑缺血模型,给予依达拉奉腹腔注射后,发现脑缺血/再灌注6 h时,海马CA1区凋亡率显著增高,一直持续到72 h。这可能与依达拉奉的药物代谢动力学与有关,与依达拉奉的血药浓度曲线一致[21]。
给予依达拉奉腹腔注射后,脑缺血/再灌注后2 h,缺血区XRCC1蛋白的表达比IR组增多,持续至再灌注后72 h。由此推论,在大鼠全脑缺血再灌注损伤过程中,依达拉奉通过调节DNA修复蛋白XRCC1在脑组织的表达,干扰单链损伤,减少细胞凋亡,对脑缺血/再灌注损伤具有治疗意义。
本研究结果一方面再次论证DNA修复蛋白XRCC1在阻止脑缺血/再灌注诱导的细胞凋亡上起作用这一推论,另一方面提示,依达拉奉通过增强脑缺血/再灌注早期DNA修复蛋白XRCC1的表达而发挥其神经保护作用,这或许是依达拉奉治疗缺血性脑血管病的分子机制之一,但依达拉奉对脑缺血/再灌注后脑细胞中XRCC1的表达发挥调节作用的确切机制尚待进一步研究。
总之,大鼠全脑缺血再灌注时应用依达拉奉,可减缓DNA修复蛋白XRCC1表达的下降,促进DNA损伤的修复,从而阻止锥体细胞凋亡,进而起到脑保护作用。
[1]王光胜,耿德勤.脑缺血/再灌注损伤机制研究进展[J].医学综述,2011,17(24):3753-3756.
[2]黄东雅,聂志余,靳令经.小鼠脑缺血后氧化DNA损伤的早期修复与神经保护的相关性研究[J].中风与神经疾病杂志,2007,24(1):16-19.
[3]Wang GH,Jiang ZL,Li YC,et al.Free-radical scavenger edaravone treatment confers neuroprotection against traumatic brain injury in rats[J].J Neurotrauma,2011,28(10):2123-2134.
[4]Takizawa Y,Miyazawa T,Nonoyama S,et al.Edaravone inhibits DNA peroxidation and neuronal cell death in neonatal hypoxic-ischemic encephalopathy model rat[J].Pediatr Res,2009,65(6):636-641.
[5]Shimizu S,Saito M,Kinoshita Y,et al.Acute urinary retention and subsequent catheterization cause lipid peroxidation and oxidative DNA damage in the bladder:preventive effect of edaravone,a free-radical scavenger[J].BJU INT,2009,104(5):713-717.
[6]史楠,龙威,伍旭升.降纤酶联用依达拉奉治疗急性脑梗死[J].中国临床医学,2011,18(5):625-627.
[7]李才.人类疾病动物模型的复制[M].北京:人民卫生出版社,2008:126-127.
[8]颜虹.医学统计学[M].第2版.北京:人民卫生出版社,2010:289-292.
[9]Takahashi T,Steinberg GK,Zhao H.Lithium treatment reduces brain injury induced by focal ischemia with partial reperfusion and the protective mechanisms dispute the importance of akt activity[J].Aging Dis,2012,3(3):226-233.
[10]徐向辉,常业恬,李李,等.依达拉奉预处理对大鼠脑缺血再灌注后血管内皮功能的影响[J].实用医学杂志,2008,24(24):4205-4207.
[11]Stetler RA,Gao YQ,Zukin RS,et al.Apurinic/apyrimidinic endonuclease APE1 is required for PACAP-induced neuroprotection against global cerebral ischemia[J].Proc Natl Acad Sci USA,2010,107(7):3204-3209.
[12]Yang Y,Candelario-Jalil E,Thompson JF,et al.Increased intranuclear matrix metalloproteinase activity in neurons interferes with oxidative DNA repair in focal cerebral ischemia[J].J Neurochem,2010,112(1):134-149.
[13]Xue RL,Chen WC,Wang N,et al.Expression of the DNA-repair protein XRCC1 and DNA-repair enzyme Ku70 mRNA in the rat cerebral cortex following global cerebral ischemia/reperfusion Is this correlated with neuroprotective effects of theanine[J].Neural Regen Res,2010,5(1):41-46.
[14]Thompson LH,Brookman KW,Jones NJ,et al.Molecular cloning of the human XRCC1 gene,which corrects defective DNA strand break repair and sister chromatid exchange[J].Mol Cell Biol,1990,10(2):6160-6171.
[15]Fujimura M,Morita-Fujimura Y,Kawase M,et al.Early decrease of apurinic/apyrimtidinic endonuclease expression after transient focal cerebral ischemia in mice[J].Cereb blood flow Metab,1999,19(5):459-501.
[16]Ahmad A,Khanmm,Javed H,et al.Edaravone ameliorates oxidative stress associated cholinergic dysfunction and limits apoptotic response following focal cerebral ischemia in rat[J].Mol Cell Biochem,2012,367(1-2):215-225.
[17]陈林芳,丁新生,田向阳,等.依达拉奉对急性脑梗死患者血清 NSE、hs-CRP 的影响[J].实用药物与临床,2011,14(5):380-382.
[18]Zhang P,Li W,Li L,et al.Treatment with edaravone attentnuates ischemic brain injury and inhibits neurogenesis in the subventricular zone of adult rats after focal cerebral ischemia and reperfusion injury[J].Neuroscience,2012,201:297-306.
[19]欧阳锦华.依达拉奉治疗急性脑梗死的临床研究[J].中国医药,2010,5(9):833-834.
[20]Yamamoto T,Yuki S,Watanabe T,et al.Delayed neuronal death prevented by inhibition of increased hydroxyl radical format ion in a transient cerebral ischemia[J].Brain Res,1997,762:240-242.
[21]韦敏,肖亿.RP-HPLC法测定人血清中依达拉奉的浓度[J].中国药房,2007,18(8):590-591.
