高糖对小鼠足细胞表型转化的诱导作用及机制探讨
2012-06-14刘青娟张玉军李建英付晓辉吴海江邢玲玲
刘青娟,张玉军,李建英,付晓辉,姚 芳,吴海江,邢玲玲
(1河北医科大学病理教研室,石家庄050017;2石家庄市人民医院;3河北医科大学第二医院)
近年研究显示,糖尿病肾病(DN)时高糖环境、糖基化终产物、血管内皮生长因子、氧自由基、转化生长因子-β、血管紧张素Ⅱ和机械应力的增加都可以损伤足细胞,而足细胞的损伤与蛋白尿的产生关系密切,在DN发生发展中起关键作用[1~4]。有研究[5,6]显示,与肾近端小管上皮细胞类似,足细胞亦可在病理因素刺激下发生表型转化,即上皮向间充质细胞转分化(EMT),从而脱离基底膜,导致肾小球滤过屏障发生障碍引起蛋白尿,但有关足细胞表型转化机制的研究较少。近年来,我们的实验研究结果表明,在糖尿病动物及高糖培养的系膜细胞、肾小管上皮细胞中,JAK/STAT信号通路的活性明显增强,且该通路的激活与肾小管上皮细胞表型转化有关。由此我们推测,高糖诱导的足细胞表型转化或许也与JAK/STAT通路有关。2010年9月~2011年10月,我们应用蛋白质酪氨酸激酶(JAK2)的特异性阻断剂 α-氰-(3,4-二羟基)-N-苄基肉桂酰胺(AG490)干预足细胞,观察足细胞自身标志物人肾病蛋白(Nephrin)和间充质细胞标志物α-平滑肌肌动蛋白(α-SMA)的变化,探讨高糖诱导足细胞表型转化的机制。
1 材料与方法
1.1 材料 小鼠足细胞株购自中国协和医科大学细胞中心;兔抗Nephrin、α-SMA、β-actin多克隆抗体购自北京博奥森公司,兔抗p-JAK2抗体购自Santa Cruz公司;AG490购自美国Calbiochem公司;逆转录—聚合酶链反应(RT-PCR)试剂为Promega公司产品。
1.2 方法
1.2.1 细胞培养与分组 将冻存的足细胞复苏后,置于含 10 U/mL γ-干扰素和 10%胎牛血清的DMEM-F12培养基中,33℃细胞培养箱中培养;传代后转入不含γ-干扰素的培养基中37℃培养10~14 d,使足细胞充分分化后进行后续实验。实验前换无血清培养基孵育12 h,使细胞同步化。将细胞随机分为A、B、C三组,A组常规培养不处理,B组加入终浓度为30 mmol/L的葡萄糖,C组加入终浓度为30 mmol/L的葡萄糖及10 μmol/L的 AG490。
1.2.2 足细胞中Nephrin、α-SMA和p-JAK2蛋白的检测 采用Western blot法。培养48 h后收集细胞,加入蛋白裂解液提取蛋白,用考马斯亮蓝法测定蛋白浓度,-70℃保存。每个样品取50 μg总蛋白,10%SDS-PAGE凝胶电泳后电转移至PVDF膜;5%脱脂奶粉37℃封闭2 h,再分别加入兔抗p-JAK2、α-SMA 多克隆抗体(1∶500稀释),4 ℃过夜。ECL化学发光法显色,以 β-actin作为内参照。Western blot条带信号强度采用Lab Work 45图像分析软件进行定量分析,测定各条带的积分光密度值(IOD),以此表示目标蛋白的表达量。
1.2.3 足细胞中 Nephrin、α-SMA mRNA 的检测采用RT-PCR法。Trizol法提取细胞总RNA,用紫外分光光度仪测定其浓度后,在逆转录酶作用下合成cDNA,以cDNA为模板进行PCR扩增。18 S rRNA的上下游引物分别为5'-ACA CGG ACA GGA TTG ACA GA-3'、5'-GGA CAT CTA AGG GCA TCA CAG-3'(238 bp),α-SMA的上下游引物分别为5'-CTG AAG AGC ATC CGA CAC-3'、5'-GAC TCC ATC CCA ATG AAA G-3'(520 bp),Nephrin的上下游引物分别为 5'-CCC CAA CAT CGA CTT CAC TT-3'、5'-GGC AGG ACA TCC ATG TAG AG-3'(372 bp)。所用引物均由上海捷锐生物公司合成。将PCR产物在2%琼脂糖凝胶中进行电泳,然后置于凝胶图像分析系统(UVP公司,美国)进行吸光度扫描,以18 S rRNA作为内参照校正,用目的基因的吸光度与18 S rRNA吸光度的比值代表目的基因的相对表达量。
1.2.4 统计学方法 采用SPSS13.0统计软件。所得数据以±s表示,多组间比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组足细胞中 Nephrin、α-SMA、p-JAK2 蛋白的表达量比较 见表1。
表1 各组足细胞中Nephrin、α-SMA、p-JAK2蛋白表达量比较(±s)
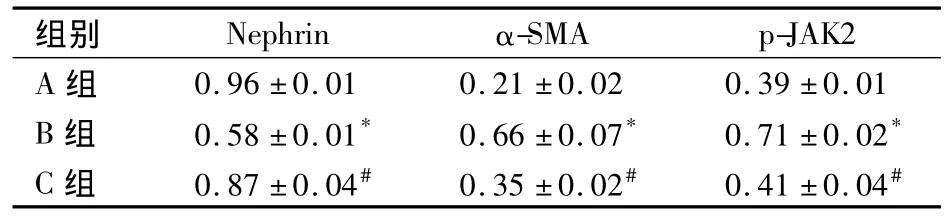
表1 各组足细胞中Nephrin、α-SMA、p-JAK2蛋白表达量比较(±s)
注:与 A组比较,*P <0.05;与 B 组比较,#P <0.05
组别 Nephrin α-SMA p-JAK2 A组0.96±0.01 0.21±0.02 0.39±0.01 B 组 0.58±0.01* 0.66±0.07* 0.71±0.02*C 组 0.87±0.04# 0.35±0.02# 0.41±0.04#
2.2 各组足细胞中Nephrin、α-SMA mRNA的表达量比较 见表2。
表2 各组足细胞中Nephrin、α-SMA mRNA相对表达量比较(±s)

表2 各组足细胞中Nephrin、α-SMA mRNA相对表达量比较(±s)
注:与 A组比较,*P <0.05;与 B 组比较,#P <0.05
组别 Nephrin mRNA α-SMA mRNA A组1.53±0.04 0.57±0.01 B 组 0.82±0.09* 0.89±0.03*C 组 1.30±0.04# 0.78±0.03#
3 讨论
肾脏纤维化是各种慢性肾脏疾病的最终结局,随着糖尿病发病率的上升,DN逐渐成为导致终末期肾病的主要原因之一。肌成纤维细胞是细胞外基质的主要来源,在肾脏纤维化中发挥着至关重要的作用。正常肾组织中几乎无肌成纤维细胞。大量实验研究表明,EMT是肌成纤维细胞的主要来源。以往的研究更关注肾小管上皮细胞的转分化,而足细胞和肾小管上皮细胞均来源于胚胎中胚层的间叶细胞,因此考虑足细胞和小管上皮细胞一样,在病理条件下具有转分化为间叶细胞的可能性[1]。
近年来,越来越多的研究[5~8]表明,在某些病理因素作用下,肾小球足细胞确实也可发生EMT,即丧失其特异性标志物,表现出转分化的特征,从而在肾小球滤过屏障受损、蛋白尿及肾小球硬化过程中发挥重要作用。DN发病过程中伴随有明显的足细胞形态和功能异常,考虑足细胞EMT是其中的关键病理过程[6]。α-SMA是普遍公认的一种提示上皮细胞发生EMT的标志性蛋白之一。在生理条件下,足细胞不表达α-SMA,其在足细胞中的表达可作为足细胞发生EMT的一个有价值的指标。本研究结果显示,与A组相比,B组在高糖刺激下可使足细胞Nephrin的表达减少而α-SMA表达增加,提示高糖可诱导足细胞发生表型转化。
足细胞转分化后可获得分泌功能,使细胞外基质分泌过多,从而导致肾小球硬化并最终发展至纤维化[9]。逆转足细胞功能损伤可延缓或减轻DN的进展[10]。因此,探讨足细胞转化的机制,并进一步阻断该过程至关重要。JAK/STAT信号通路是细胞因子信号转导的重要通路之一。JAKs家族是一种非受体型酪氨酸蛋白激酶,STATs是JAKs激酶的底物,磷酸化的STATs以二聚体的形式存在并转移到核内调控基因表达。以往对肾小管上皮细胞转化的研究[11,12]表明,JAK/STAT 信号通路在高糖、细胞因子等多种刺激因素诱导上皮转化中均发挥重要作用。由此,我们考虑JAK/STAT信号通路可能也参与了高糖诱导的足细胞转分化。为了验证这一观点,我们首先检测了高糖刺激后足细胞中p-JAK2和p-STAT1的表达,证实高糖可以激活足细胞中的JAK/STAT信号通路。之后我们在高糖诱导足细胞转化的同时采用AG490进行干预,结果发现,与单纯高糖刺激相比,同时加入AG490干预后,在抑制JAK/STAT通路的同时,足细胞中α-SMA蛋白及其mRNA表达明显降低。提示AG490可通过阻断JAK/STAT信号通路抑制高糖诱导的足细胞表型转化。本研究结果为DN蛋白尿的防治提供了实验依据。
[1]Li JJ,Kwak SJ,Jung DS,et al.Podocyte biology in diabetic nephropathy[J].Kidney Int,2007,106(Suppl):36-42.
[2]Ziyadeh FN,Wolf G.Pathogenesis of the podocytopathy and proteinuria in diabetic glomerulopathy[J].Curr Diabetes Rev,2008,4(1):39-45.
[3]Wolf G,Ziyadeh FN.Cellular and molecular mechanisms of proteinuria in diabetic nephropathy[J].Nephron Physiol,2007,106(2):26-31.
[4]Jefferson JA,Shankland SJ,Pichler RH.Proteinuria in diabetic kidney disease:a mechanistic viewpoint[J].Kidney Int,2008,74(1):22-36.
[5]Li Y,Kang YS,Dai C,et al.Epethelial-to-mesenchymal transition is a potential pathway leading to podocyte dysfunction and proteinuria[J].Am J Pathol,2008,172(2):299-308.
[6]Yamaquchi Y,Iwano M,Suzuki D,et al.Epethelial mesenchymal transition as a potential explanation for podocyte depletion in diabetic nephropathy[J].Am J Kidney Dis,2009,54(4):653-664.
[7]Wang C,Liu X,Ke Z,et al.Mesangial medium from IgA Nephropathy patientsinducespodocyte epithelial-to-mesenchymal transition through activation of the phosphatidyl inositol-3-kinase/Akt signaling pathway[J].Cell Physiol Biochem,2012,29(5-6):743-752.
[8]Dai HY,Zheng M,Lv LL,et al.The roles of connective tissue growth factor and integrin-linded kinase in high glucose-induced phenotypic alterations of podocytes[J].J Cell Biochem,2012,113(1):293-301.
[9]Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212-222.
[10]Zhang Z,Sun L,Wang Y,et al.Renoprotective role of the vitamin D receptor in diabetic nephropathy[J].Kidney Int,2008,73(2):163-171.
[11]Nightingale J,Patel S,Suzuki N,et al.A cytokine released by activated mononuclear cells,induces epithelial cell-myofibroblast transdifferentiation via Jak/Stat pathway activation[J].J Am Soc Nephrol,2004,15(1):21-32.
[12]赵松,史永红,段惠军.JAK/STAT信号途径参与高糖诱导的肾小管上皮细胞转分化[J].中国病理生理杂志,2008,24(2):325-329.
