食管鳞癌组织中PLK1表达变化及其对食管癌细胞侵袭迁移的影响
2012-06-14范平明郑武平高炳玉
范平明,郑武平,高炳玉
(海南医学院附属医院,海口570102)
Polo样激酶1(PLK1)是一类广泛存在于真核细胞中呈周期依赖性表达的丝/苏氨酸激酶,与肿瘤的发生、发展密切相关。2006年6月~2012年3月,我们观察了食管鳞癌组织中PLK1的表达变化,及其对食管癌细胞侵袭转移能力的影响,并初步探讨了其可能的机制。
1 资料与方法
1.1 临床资料 食管鳞癌80例,男61例,女19例;年龄25~77岁,平均45岁;术前未行放化疗。于2006年6月~2008年6月行食管癌手术,术中留取肿瘤及癌旁正常组织标本,TNM分期T1~T2期56例,T3~T4期24例;临床分期Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期40例;病理分级G0~G1级39例,G2~G3级41例;有淋巴结转移48例,无淋巴结转移32例。术后患者均进行化疗、放疗等规范性治疗,随访至2012年3月31日。
1.2 方法
1.2.1 食管鳞癌组织中PLK1的检测 采用免疫组化SP法。组织标本均经10%甲醛固定,常规石蜡包埋,切片厚4 μm;SP染色,抗原修复采用柠檬酸钠缓冲液微波修复;以已知阳性片作阳性对照,以PBS代替一抗作阴性对照。PLK1阳性细胞为细胞核深褐色染色。高倍镜下选择5个视野,每个视野计数200个肿瘤细胞,计算阳性细胞所占百分比。阳性细胞百分比<10%为阴性,≥10%为阳性。
1.2.2 细胞培养与转染 将人食管癌EC9706细胞培养于含10%胎牛血清的RPMI1640培养液中,置于37℃、5%CO2培养箱中培养。将细胞以6×105/mL接种于6孔板,每孔1 mL;培养16 h后,观察组用PLK1 siRNA(5'-GGGACATAGCCAAGCTGGTCGAGTACTGGACCAGCTT-GGCTATGTCCC-3',由Invitrogen公司合成)经脂质体转染EC9706细胞,对照组细胞转染Scrambled siRNA(与人类基因组序列无同源性,由Invitrogen公司合成);继续培养48 h后,将细胞按1∶10传代,然后加入G418进行筛选;每隔2~3 d换液1次,10~14 d有明显克隆形成。
1.2.3 食管癌细胞侵袭及迁移能力的观察 采用Transwell试验。EC9706细胞转染后48 h后,用无血清RPMI1640培养基饥饿12 h,调整细胞浓度为1×106/mL。每个小室加100 μL细胞悬液,下室加600 μL含10%FBS的RPMI1640培养基。其中侵袭实验在小室接种细胞前一晚,将基质胶(Matrigel)用无血清RPMI1640培养基稀释成浓度为1∶7,每个小室加60 μL,而迁移试验不加Matrigel。37℃、5%CO2培养箱中培养,侵袭试验28 h后再行迁移试验20 h;取出小室用90%乙醇固定,0.1%结晶紫溶液染色,置于显微镜下观察并拍照;在相同的低倍视野(×100)下,分别选取视野中央和上下、左右5个视野进行细胞计数;实验重复3次,计算平均值。
1.2.4 食管癌细胞中 PLK1、MMP-2、MMP-9 的检测采用Western blot法。用蛋白裂解液(Thermo公司)提取两组培养细胞总蛋白,用分光光度计测蛋白浓度。每孔上样20 μg,进行SDS-PAGE电泳 (浓缩胶8%,分离胶12%);蛋白分离后半干转至PVDF膜(30 V,42 min),用5%脱脂奶粉室温封闭1 h,加入兔抗人 PLK1 抗体、MMP-2、MMP-9,以鼠抗人β-actin抗体作为内参。4℃摇床过夜,再加入辣根过氧化物酶标记的山羊抗兔IgG和山羊抗小鼠IgG;室温孵育 2 h,ECL化学发光显色。用 One-Dscan软件检测目的蛋白和内参蛋白电泳条带的灰度值,以目的蛋白与内参蛋白灰度比值表示目的蛋白表达量;实验重复3次,求平均值。
1.2.5 统计学方法 采用 SPSS16.0统计软件。PLK1表达与临床病理参数的关系用χ2检验,采用Kaplan-Meier法进行生存分析;组间计量资料比较用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 食管鳞癌及癌旁组织中PLK1的表达情况食管鳞癌组织中PLK1阳性表达53例(66.3%),高于癌旁组织中的27 例(33.7%),P <0.05。
2.2 PLK1表达与食管鳞癌临床病理参数的关系PLK1表达与食管鳞癌淋巴结转移及临床分期有关(P均 <0.05),与患者的年龄、TNM 分期、肿瘤病理分级无关(P均<0.05)。见表1。
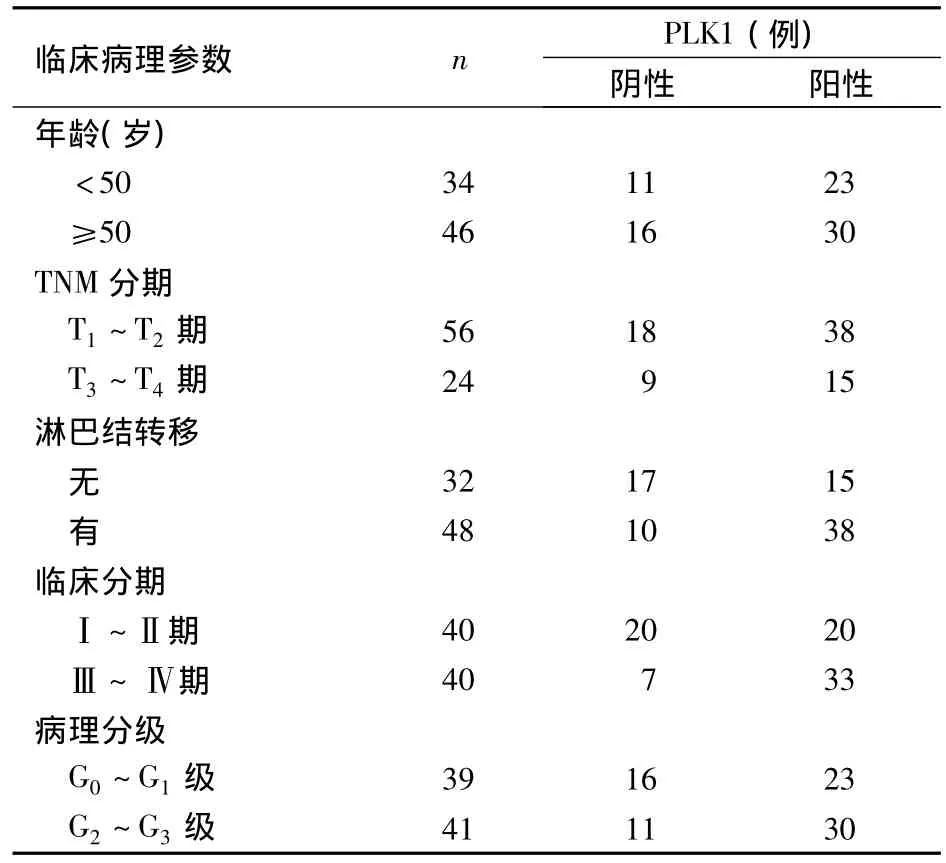
表1 PLK1表达与食管鳞癌临床病理参数的关系
2.3 PLK1表达与食管癌患者预后的关系 PLK1阴性者5年生存率为62%,高于PLK1阳性者的39%,P<0.05。以食管癌临床预后作为因变量,以有关影响因素作为自变量进行多因素Cox回归分析。结果显示,临床分期、淋巴结转移、病理分级、PLK1表达均为食管癌预后的独立危险因素。详见表2。
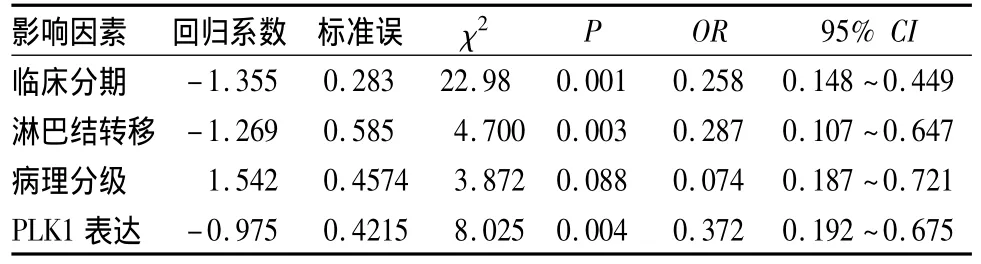
表2 食管鳞癌患者预后影响因素的Cox回归分析
2.3 PLK1表达对食管癌细胞侵袭迁移能力的影响 观察组细胞侵袭迁移个数分别为(120±6)、(269±8)个/HP,对照组分别为(468±11)、(780±12)个/HP;两组比较,P 均 <0.05。
2.4 敲降PLK1表达对相关蛋白表达的影响 观察组PLK1、MMP-2、MMP-9灰度比值分别为0.10±0.03、0.40±0.02、0.87±0.05,对照组分别为 0.96±0.05、0.98± 0.07、0.89± 0.06;两组 PLK1、MMP-2灰度比值比较,P 均 <0.05。
3 讨论
PLK1在细胞有丝分裂中扮演重要角色,与细胞有丝分裂期多个事件密切相关,如中心体复制、纺锤体形成、染色体分离以及胞质分裂等[1]。近年来研究[2~4]发现,PLK1在多种实体肿瘤组织中高表达,提示其与肿瘤发生相关;进一步分析发现,PLK1高表达与一些肿瘤组织分级、恶性程度及肿瘤患者的预后密切相关。本研究发现,PLK1在食管鳞癌组织中的表达水平明显高于癌旁正常组织,其高表达与淋巴结转移和临床分期有关,而与肿瘤分化程度无关。生存分析发现,PLK1高表达者的生存期显著低于低表达者;进一步的多因素分析表明,PLK1表达、临床分期、病理分级和淋巴结转移都是食管癌患者预后的独立影响因素。以上这些结果表明,PLK1在多种肿瘤的发生、发展中可能发挥重要作用。其表达升高可能有助于恶性肿瘤细胞逃脱检测点监控,突变基因得以复制,导致肿瘤形成。
鉴于PLK1表达与食管癌的淋巴结转移和患者的不良预后有关,我们进一步检测了PLK1表达对食管癌细胞侵袭迁移能力的影响。结果发现,敲降PLK1表达,可显著降低食管癌细胞的侵袭迁移能力。肿瘤的侵袭迁移须完成三个过程,即降解细胞外基质(ECM)的蛋白质、黏附ECM生长、离开ECM向其他器官迁移[5]。在此过程中,MMP起关键作用。MMP是一种重要的蛋白水解酶,现已发现26种亚型,MMP既参与ECM的降解,又可促进肿瘤细胞的黏附及运动[6]。其中MMP-2在肿瘤的浸润和转移中发挥关键作用[7]。ECM降解是肿瘤浸润与转移的关键环节,该过程的完成主要依靠蛋白水解酶的降解作用。MMP-2以酶原的形式分泌,被激活之后形成Ⅳ型胶原酶,降解、破坏靠近肿瘤表面的ECM和基底膜,然后肿瘤细胞沿着缺失的基底膜向周围组织浸润,最终导致肿瘤的浸润和迁移[8,9]。MMP-9可降解基底膜中的主要成分Ⅳ型胶原及明胶等,具有调节细胞迁移、促进肿瘤生长和血管生成等重要作用[10,11]。为了进一步研究PLK1影响食管癌细胞侵袭迁移的分子机理,我们观察了PLK1表达对与肿瘤侵袭迁移密切相关的MMP-2、MMP-9表达的影响。结果发现,敲降PLK1表达可抑制MMP-2的表达水平,提示PLK1对食管癌细胞侵袭迁移能力的影响可能是通过影响MMP-2的表达而实现的,但这种作用是直接的还是间接的需要进一步深入研究。
[1]SAndo K,Ozaki T,Yamamoto H,et al.Polo-like kinase 1(Plk1)inhibits p53 function by physical interaction and phosphorylation[J].J Biol Chem,2004,279(24):25549-25561.
[2]Steinhauser I,Langer K,Strebhardt K,et al.Uptake of plasmidloaded nanoparticles in breast cancer cells and effect on Plk1 expression [J].J Drug Target,2009,17(8):627-637.
[3]Kim SA,Kwon SM,Yoon JH,et al.The antitumor effect of PLK1 and HSF1 double knockdown on human oral carcinoma cells[J].Int J Oncol,2010,36(4):867-872.
[4]Takai N,Hamanaka R,Yoshimatsu J,et al.Polo-like kinases(Plks)and cancer[J].Oncogene,2005,24(2):287-291.
[5]曹士德,宋云霄.基质金属蛋白酶家族与肿瘤转移[J].中国当代医药,2011,18(13):15-17.
[6]王璐,张丽红,李玉林,等.基质金属蛋白酶9及其mRNA在胃癌中的表达与血管新生的关系[J].中华医学杂志,2003,83(9):782-785.
[7]Jones JL,Glynn P,Walker RA.Expression of MMP-2 and MMP-9 their inhibitors,and the activator MTI-MMP in primary breast carcinomas[J].J Pathol,2012,189(2):161.
[8]Garzetti G,Giavattini A,Lucarini G,et al.GynecolOncol,Microinvasive cervical carcinoma and cervical intraepithelial neoplasia:biologic significance and clinical implications of 72 kDa metalloproteinase immunostaining[J].Gynecol Oncol,2011,61(1):197.
[9]Li X,Ji Z,Ma Y,et al.Expression of hypoxia-inducible factor-1α,vascular endothelial growth factor and matrix metalloproteinase-2 in sacral chordomas[J].Oncol Lett,2012,3(6):1268-1274.
[10]姚莉,哈敏文.Kiss-1和MMP-7和MMP-9在非小细胞肺癌患者组织中表达状况分析[J].中国实用医药,2012,7(14):77-78.
[11]王繁,王瑛嫦,周洁.MMP-9和Ezrin在子宫内膜癌中的表达及与 ER、PR 的相关性[J].实用肿瘤杂志,2012,27(3):240-244.
