红景天苷联合HGF对脐血间充质干细胞向肝样细胞分化的诱导作用观察
2012-06-14钱海鑫苗宗宁张学光
黄 伟,钱海鑫,苗宗宁,张学光
(1苏州大学附属第一医院,江苏苏州215002;2无锡市第三人民医院;3苏州大学)
间充质干细胞(MSCs)具有多向分化能力,在特定的培养条件下可以分化为骨、脂肪、软骨等多种细胞[1~5]。研究[6,7]发现,在体外脐血 MSCs 可被诱导分化为肝样细胞,并能合成释放谷丙转氨酶(ALT)、白蛋白(ALB)等。实验中常用肝细胞生长因子(HGF)作为诱导剂,但其诱导方向存在多样性及不确定性,诱导分化为肝样细胞的数量较少。红景天苷是中药红景天的提取物,常用于肝病的治疗,对肝细胞再生具有一定作用。2011年12月~2012年5月,我们采用红景天苷联合HGF诱导脐血MSCs向肝样细胞分化,观察二者联合应用的诱导效果。现报告如下。
1 材料与方法
1.1 材料 人脐血 MSCs,DMEM/F12(Gibco公司),多聚甲醛(上海化学试剂厂),胰蛋白酶(Sigma公司),多聚赖氨酸(Nvitrogen公司);红景天苷(中国药品生物制品鉴定所),HGF(Epro Tech公司);肝功能检测试剂盒(上海化学试剂厂),全自动生化分析仪(Olympus公司)。
1.2 方法
1.2.1 细胞培养与分组 取生长状态良好的第5代脐血 MSCs[8],用 0.25% 胰蛋白酶、0.01%EDTA混合液消化;PBS洗涤2遍,离心、收集细胞,用工作液(DMEM/F12)将细胞浓度调整为1×104/mL;以1 mL/孔接种6孔板,培养4 d。取贴壁生长状态良好的细胞,用含5%FBS的DMEM/F12换液。将脐血MSCs随机分成4组,A组不处理,B组分别加入5(B1)、10(B2)、20 μmol/L(B3)的红景天苷 5 μL,C 组分别加入 5(C1)、10(C2)、20 ng/mL(C3)的HGF 5 μL,D 组分别加入 B1+C1(D1)、B2+C2(D2)、B3+C3(D3)的红景天苷和HGF。
1.2.2 细胞形态观察及肝样细胞计数 分别于培养第1、7、14、21天,用倒置相差显微镜观察细胞形态变化;选取3个高倍镜视野,计数肝样细胞(三角形、多角形或类圆形细胞)的数量,取平均值。
1.2.3 细胞上清液中ALT、ALB检测方法 分别于培养第1、7、14、21 天,取细胞悬液;以 1 500 r/min离心15 min,毛细吸管吸取上清液备用。采用全自动生化分析仪检测上清液中的ALT,以溴甲酚绿法检测上清液中的ALB。
1.2.4 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,组间比较采用t检验。P≤0.05为差异具有统计学意义。
2 结果
2.1 各组细胞形态变化及肝样细胞数量比较 A组细胞均呈长梭形,各时点无明显变化;B、C、D组第7天梭形细胞两端逐渐变短,第14、21天细胞由长梭形变为三角形、多角形或类圆形的肝样细胞。A组各时点高倍镜下均未见肝样细胞,B、C、D组在第7、14、21天均可见肝样细胞(P 均 <0.05),并随时间延长而增加(P均<0.05);D组肝样细胞数量高于同时点的B、C组(P均<0.05),并随药物浓度增加而增加。D2、D3与D1比较,P均<0.05,而D3与 D2比较,P >0.05。见表1。
表1 不同时点各组肝样细胞数量比较(个/HP,±s)
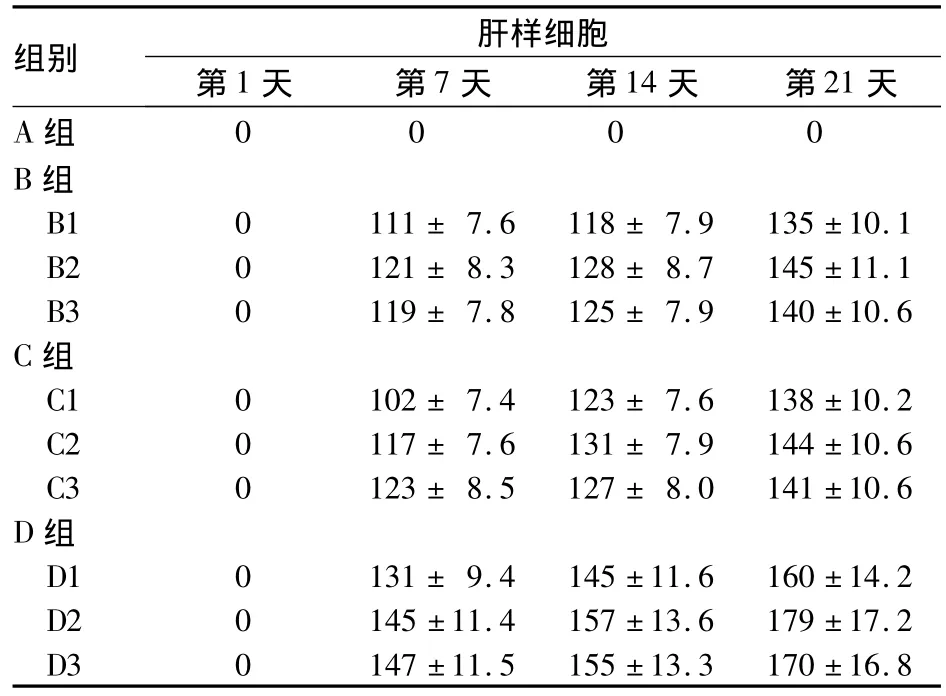
表1 不同时点各组肝样细胞数量比较(个/HP,±s)
组别 肝样细胞第1天 第7天 第14天 第21天A组0000 B组B1 0 111± 7.6 118± 7.9 135±10.1 B2 0 121± 8.3 128± 8.7 145±11.1 B3 0 119± 7.8 125± 7.9 140±10.6 C组C1 0 102± 7.4 123± 7.6 138±10.2 C2 0 117± 7.6 131± 7.9 144±10.6 C3 0 123± 8.5 127± 8.0 141±10.6 D组D1 0 131± 9.4 145±11.6 160±14.2 D2 0 145±11.4 157±13.6 179±17.2 D3 0 147±11.5 155±13.3 170±16.8
2.2 不同时点各组细胞上清液中ALT、ALB水平比较 A组各时点细胞上清液中均未检测到ALT、ALB,B、C、D 组第 14、21 天均检测到 ALT、ALB(P均 <0.05),并随时间延长而升高(P均 <0.05);D组ALT、ALB水平均高于同时点的B、C组(P均<0.05),且随作用药物浓度的增加而升高,D2、D3与D1比较,P 均 <0.05,而 D3 与 D2比较,P >0.05。见表2。
表2 不同时点各组细胞上清液中ALT、ALB水平比较(±s)
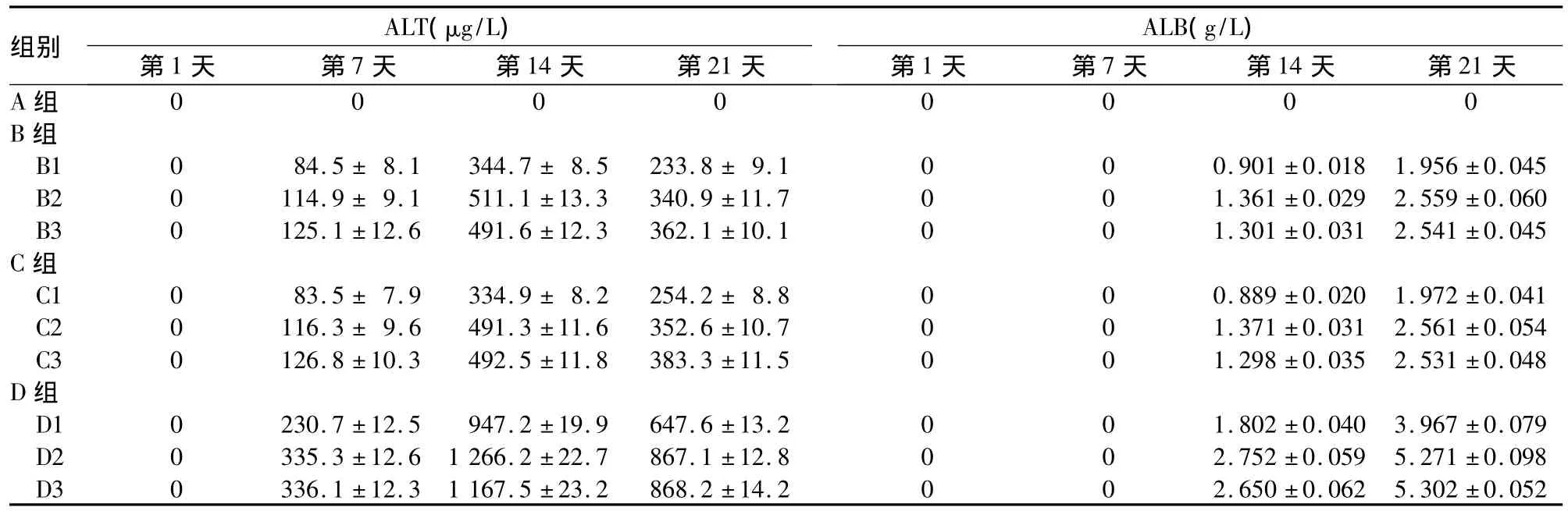
表2 不同时点各组细胞上清液中ALT、ALB水平比较(±s)
组别 ALT(μg/L)ALB(g/L)第1天 第7天 第14天 第21天 第1天 第7天 第14天 第21天A组00000000 B组B1 0 84.5± 8.1 344.7± 8.5 233.8± 9.1 0 0 0.901±0.018 1.956±0.045 B2 0 114.9± 9.1 511.1±13.3 340.9±11.7 0 0 1.361±0.029 2.559±0.060 B3 0 125.1±12.6 491.6±12.3 362.1±10.1 0 0 1.301±0.031 2.541±0.045 C组C1 0 83.5± 7.9 334.9± 8.2 254.2± 8.8 0 0 0.889±0.020 1.972±0.041 C2 0 116.3± 9.6 491.3±11.6 352.6±10.7 0 0 1.371±0.031 2.561±0.054 C3 0 126.8±10.3 492.5±11.8 383.3±11.5 0 0 1.298±0.035 2.531±0.048 D组D1 0 230.7±12.5 947.2±19.9 647.6±13.2 0 0 1.802±0.040 3.967±0.079 D2 0 335.3±12.6 1 266.2±22.7 867.1±12.8 0 0 2.752±0.059 5.271±0.098 D3 0 336.1±12.3 1 167.5±23.2 868.2±14.2 0 0 2.650±0.062 5.302±0.052
3 讨论
肝硬化是一种常见的慢性肝病,尤其是晚期肝硬化,保守治疗效果欠佳,病死率居高不下。原位肝移植是治疗晚期肝硬化比较有效的措施,但因肝源缺乏、费用昂贵、移植排斥反应及长期应用免疫抑制剂引起并发症等,限制了其广泛应用。近年来,对干细胞的应用研究为解决这一问题带来了新的希望,特别是脐血MSCs在体外经诱导可分化成肝样细胞,可代替部分甚至全部的肝脏,为细胞移植治疗晚期肝硬化开辟了新的途径。
在对细胞向肝样细胞进行诱导的研究过程中,常用的诱导剂是HGF。HGF因最初被发现可剌激肝细胞合成DNA而得名,是肝脏发育及肝再生过程中最基本的细胞因子[9,10];同时HGF是很强的促肝细胞增殖因子,不仅能刺激肝细胞的再生,促进肝功能恢复,而且可改善肝纤维化,在损伤因子刺激时保护肝细胞功能[11,12]。HGF是个多效应的生长因子,除了诱导干细胞向肝样细胞分化外,还能诱导干细胞向血管内皮细胞、消化道黏膜细胞、子宫内膜细胞甚至神经胶质瘤细胞等方向分化。HGF作用的多效性相应降低了干细胞肝向分化的专一性,从而使我们所得到的肝样细胞的数量低于预期[13]。
红景天苷是中药红景天的提取物,能清除自由基,抑制氧化应激损伤。其在肝脏损伤的临床治疗中有一定的应用,对肝功能具有广泛而独到的保护作用。本研究结果显示,单独应用红景天苷即可诱导脐血MSCs向肝样细胞分化,并在一定的浓度范围内呈剂量依赖性。其机制可能为:①红景天苷通过阻断干细胞膜上的TGFB-Smad信号传导通路,抑制了干细胞向肝星状细胞的分化与增殖,保证了干细胞在向肝样细胞分化的确定性。②红景天苷可明显上调肝再生增长因子(ALR)的水平。ALR作为特异的生长因子,能明显促进肝细胞的再生而不向其他类型的细胞分化。③有研究报道,在红景天苷诱导MSCs肝向分化的实验中,加入HGFR、胞外信号调节激酶1/2(ERK1/2)、磷脂酰肌醇-3-磷酸激酶(PI3K)3条信号转导通路的阻断剂,结果显示诱导后的细胞对肝细胞标志物的表达明显下降。提示红景天苷诱导MSCs肝向分化是通过以上3条信号通路来实现的[14]。本研究发现,红景天苷联合HGF可增强脐血MSCs诱导分化为肝样细胞的作用,其机制可能为红景天苷抑制了HGF诱导干细胞向其他方向分化的潜能,从而保证了干细胞向肝样细胞分化的方向性[15]。
[1]Iguchi A,Kobayashi R,Sato TZ,et al.Successful report of reduced-intensity stem cell transplantation from unrelated umbilical cord blood in a girl with chronic active epstein-barr virus infection[J].Clin Lab Observ,2006,28(4):254.
[2]Reyes M,Lund T,Lenvik T,et al.Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells[J].Blood,2001,98(12):2615-2625.
[3]Albella B,Segovia JC,Guenechea G,et al.Exvivo expansion of hematopoietic stem cells[J].Methods Mol Biol,2010,45(3):266-278.
[4]Jones EA,Kinsey SE,English A,et al.Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells[J].Arthritis Rheum,2002,46(12):3349-3360.
[5]Sekiya I,Larson BL,Smith JR,et al.Expansion of human adult stem cells from bone marrow stromal:conditions that maximize the yields of early progenitors and evaluate their qullity[J].Stem Cells,2002,20(6):530-541.
[6]Ylöstalo J,Smith JR,Pochampally RR,et al.Use of differentiating adult stem cells(marrow stromal cells)to identify new downstream target genes for transcription factors[J].Stem Cells,2006,24(3):642-652.
[7]Monsonego A,Imitola J,Zota V,et al.Microglia-mediated nitric oxide cytotoxicity of T cells following amyloid beta-peptide presentation to Th1 cells[J].J Immunol,2003,171(5):2216-2224.
[8]Huang W,Miao ZN,Chen L,et al.Brain-derived neurotrophic factor,ciliary neurotrophic factor and their combination for in vitro differentiation of human umbilical blood-derived mesenchymal stem cells into nerve-like cells[J].J Clin Rehab Tis Engin Res,2010,14(19):3606-3609.
[9]Jaenisch R,Young R.Stem cells,the molecular circuitry of pluripotency and nuclear reprogramming[J].Cell,2008,132(4):567-852.
[10]Dejosez M,Zwaka TP.Pluripotency and nuclear reprogramming[J].Annu Rev Biochem,2012,81(11):737-765.
[11]Lemaigre FP.Mechanisms of liver development:concepts for understanding liver disorders and design of novel therapies[J].Gastroenterology,2009,137(1):62-79.
[12]Roelandt P,Pauwelyn KA,Sancho-Bru P,et al.Human embryonic and rat adult stem cells with primitive endoderm-like phenotype can be fated to definitive endoderm,and finally functional hepatocyte-like cells[J].PLoS One,2010,5(8):12101.
[13]Sancho-Bru P,Roelandt P,Narain N,et al.Directed Differentiation of Murine Induced Pluripotent Stem Cells to Functional Hepatocyte-like Cells[J].J Hepatol,2011,54(1):98-107.
[14]Chivu M,Dima SO,Stancu CI,et al.In vit ro hepat ic differentiation of human bone marrow mesen chymal st em cells under differential exposure to liver specific factors[J].Transl Res,2009,154(3):122-132.
[15]Oida T,Weiner HL.Depletion of TGF-b from fetal bovine serum[J].J Immunol Methods,2010,362(1-2):195-198.
