一种源于水生生物的天然类胡萝卜素调脂及抗氧化活性的动物实验研究
2012-06-07李红艳农林玲李丽娅胡春萍庞勇军
李红艳 农林玲 李丽娅 胡春萍 庞勇军
类胡萝卜素是一类天然的脂溶性色素,广泛存在于自然界之中。其属于萜烯类,所有类胡萝卜素都是由一条共轭双键的核心碳链,加上各自不同的末梢基团构成[1,2]。目前为止,自然界中已经确认的类胡萝卜素至少有750多种[3],其中常见于食物中的有50~60种,如β-胡萝卜素、番茄红素、叶黄素、玉米黄质、隐黄质等。流行病学调查显示,蔬菜水果的摄入量与心血管疾病、眼科疾病、胃肠道疾病、神经退行性变以及部分癌症的发生,呈负相关[4]。这一作用可能和蔬菜水果中富含的类胡萝卜素和其他植物营养素有关。虾青素为一种非维生素A原、广泛存在于海产甲壳类动物和鱼类中的天然类胡萝卜素。动物实验表明它有抑制肿瘤发生、增强免疫功能等多方面的生理作用[2,5,6]。本研究通过天然虾青素对高脂鹌鹑模型体内脂代谢的调节及对由高脂诱发的血管和肝脏脂质过氧化损伤的影响及其相关机制,探讨其最佳作用剂量标准,为其用于临床相关疾病的防治提供理论依据和参考价值。
1 材料与方法
1.1 材料 5%天然虾青素粉剂(来源于雨生红球藻),购于陕西森弗生物技术有限公司。胆固醇(食品级),购于安徽科宝生物工程有限公司。高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)测定试剂盒,由上海荣盛生物技术有限公司生产。超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)、丙二醛(MDA)、诱导型一氧化氮合酶(iNOS)测定试剂盒由南京建成生物工程研究所提供。凯西莱(tioproin),河南新谊药业股份有限公司生产。辛伐他汀片(simvastatin),杭州默沙东制药有限公司生产。羧甲基纤维素钠(CMC-Na),上海三浦化工有限公司产品。其他试剂为国产分析纯。
1.2 动物分组及处理 雄性鹌鹑50只,5~6周龄,体重100~120 g,由桂林医学院实验动物中心[动物许可证号:scxk(桂)2007-0001]提供。每笼5只,动物房通风良好,光照12 h,湿度50%~60%,每天上、下午自动排风,自由饮食、饮水。鹌鹑随机分为5组,对照组、高脂模型组、凯西莱与辛伐他汀联用组(凯-辛联用组)、虾青素低剂量组、虾青素高剂量组,每组10只。对照组喂饲基础饲料;高脂模型组、凯-辛联用组、虾青素低、高2剂量组给予高脂饲料(1%胆固醇+14%猪油+6%花生油+79%基础饲料)喂饲;高脂饲料喂养同时每天上午分别灌胃给予相应的药物,虾青素试验前,先用蔗糖脂肪酸酯乳化,再溶于水配制成虾青素乳化液;凯西莱及辛伐他汀用0.5%CMC-Na配置成混悬液;虾青素低、高2剂量组分别按5、10mg/kg标准灌胃;凯-辛联用组按10mg/kg凯西莱、1mg/kg辛伐他汀剂量标准灌胃;高脂模型组及对照组灌等体积蔗糖脂肪酸酯溶液。鹌鹑分笼饲养,自由饮水,实验共7周。
1.3 血液及组织相关指标生物化学分析 5组鹌鹑均于实验开始前及结束时获取血液标本。禁食12 h颈静脉取血4℃下放置1 h,3500 r/min离心15min,取血清按试剂盒方法测定总TC、TG、HDL-C、LDL-C、GSH-Px、SOD、iNOS 活性和 MDA 含量 。实验结束后处死动物,留取肝脏作组织匀浆,测定各组动物肝组织匀浆中SOD、GSH-Px、iNOS活性、MDA及GSH的含量;同时取肝脏左叶部分(100mg)加抽提液(氯仿∶甲醇=1∶1)2ml匀浆,4℃下放置 12 h,3500 r/min,15min,取上清液,按上法测定肝中 TC、TG。
1.4 病理形态学观察 将主动脉用10%甲醛固定,脱水石蜡包埋切片,HE染色,做病理切片检查。
1.5 统计学分析应用SPSS 11.5统计软件,计量资料以表示,2组比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 虾青素对血脂及肝脂含量的影响 建模前5组血脂含量均无明显差异(P >0.05);建模后鹌鹑血清中TG、TC、LDL-C和HDL-C含量较对照组显著升高(P <0.05或 <0.01),肝脏中TG和TC含量也较对照组显著升高(P<0.01)。虾青素或凯西莱与辛伐他汀联用干预后,鹌鹑血清中TG、TC、LDL-C及肝脏中TG和TC含量均较高脂模型组下降(P<0.05或<0.01),而血清中 HDL-C含量均较高脂模型组升高(P<0.01);低、高两剂量虾青素分别与凯-辛联用组干预效果比较,低浓度的虾青素干预效果弱于凯-辛联用组(P<0.05或<0.01),高剂量作用效果更为明显。见表1。
表1 5组血脂和肝脂含量比较 n=10,mmol/L,
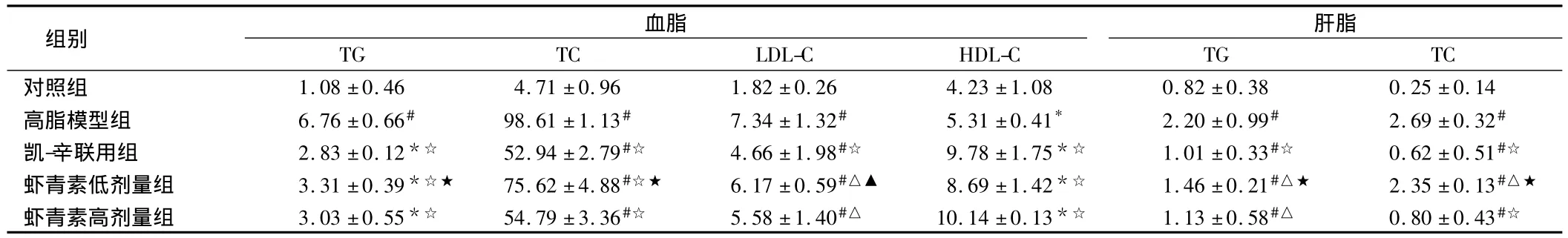
表1 5组血脂和肝脂含量比较 n=10,mmol/L,
注:与对照组比较,*P <0.05,#P <0.01;与高脂模型组比较,△P <0.05,☆P <0.01;与凯-辛联用组比较,▲P <0.05,★P <0.01
血脂肝脂组别TG TC对照组 1.08 ±0.46 4.71 ±0.96 1.82 ±0.26 4.23 ±1.08 0.8 TG TC LDL-C HDL-C 2 ±0.38 0.25 ±0.14高脂模型组 6.76 ±0.66# 98.61 ±1.13# 7.34 ±1.32# 5.31 ±0.41* 2.20 ±0.99# 2.69 ±0.32#凯-辛联用组 2.83 ±0.12*☆ 52.94 ±2.79#☆ 4.66 ±1.98#☆ 9.78 ±1.75*☆ 1.01 ±0.33#☆ 0.62 ±0.51#☆虾青素低剂量组 3.31±0.39*☆★ 75.62±4.88#☆★ 6.17±0.59#△▲ 8.69±1.42*☆ 1.46±0.21#△★ 2.35±0.13#△★虾青素高剂量组 3.03±0.55*☆ 54.79±3.36#☆ 5.58±1.40#△ 10.14±0.13*☆ 1.13±0.58#△ 0.80±0.43#☆
2.2 虾青素对血清SOD、GSH-Px、iNOS活性及MDA含量的影响 高脂喂食后,鹌鹑血清 SOD、GSH-Px活性下降(P<0.01),而iNOS活性与 MDA 含量上升(P <0.01);虾青素或凯西莱与辛伐他汀联用干预后,血清SOD,GSH-Px活性有所上升(P <0.05或 <0.01),iNOS活性与 MDA含量下降(P <0.01);低、高2剂量虾青素分别与凯-辛联用组干预效果比较,低浓度的虾青素干预效果弱于凯-辛联用组(P<0.05或<0.01),高剂量作用效果更为理想。见表2。
表2 5组血清SOD、GSH-Px、iNOS活性及MDA含量比较 n=10,
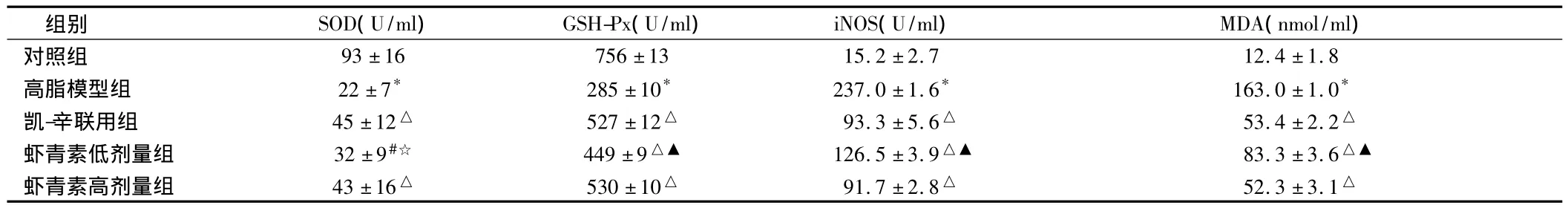
表2 5组血清SOD、GSH-Px、iNOS活性及MDA含量比较 n=10,
注:与对照组比较,*P <0.01;与高脂模型组比较,#P <0.05,△P <0.01;与凯-辛联用组比较,☆P <0.05,▲P <0.01
组别 SOD(U/ml) GSH-Px(U/ml) iNOS(U/ml) MDA(nmol/ml)93 ±16 756 ±13 15.2 ±2.7 12.4 ±1.8高脂模型组 22±7* 285±10* 237.0±1.6* 163.0±1.0*凯-辛联用组 45±12△ 527±12△ 93.3±5.6△ 53.4±2.2△虾青素低剂量组 32±9#☆ 449±9△▲ 126.5±3.9△▲ 83.3±3.6△▲虾青素高剂量组 43±16△ 530±10△ 91.7±2.8△ 52.3±3.1对照组△
2.3 虾青素对肝组织中SOD、GSH-Px、iNOS活性及MDA、GSH含量的影响 高脂喂食后,鹌鹑肝组织中SOD、GSH-Px活性及GSH含量显著降低(P<0.01),而iNOS活性与MDA含量明显上升(P<0.01);虾青素或凯西莱与辛伐他汀联用干预后,肝组织中SOD,GSH-Px活性及 GSH含量上升(P <0.05或 <0.01),iNOS活性与 MDA 含量下降(P <0.05 或 <0.01);低、高2剂量虾青素分别与凯-辛联用组干预效果比较显示,低浓度的虾青素干预效果弱于凯-辛联用组(P <0.05或 <0.01),高剂量作用效果更为理想。见表3。
表3 5组肝组织SOD、GSH-Px、iNOS活性及MDA、GSH含量比较 n=10,

表3 5组肝组织SOD、GSH-Px、iNOS活性及MDA、GSH含量比较 n=10,
注:与对照组比较,*P <0.01;与高脂模型组比较,#P <0.05,△P <0.01;与凯-辛联用组比较,☆P <0.05,▲P <0.01
组别 SOD(U/mgpro) GSH-Px(U/mgpro) iNOS(U/mgpro) GSH(mg/gpro) MDA(nmol/mgpro)17.2 ±6.8 64 ±18 0.38 ±0.11 35 ±8 0.64 ±0.15高脂模型组 4.3±2.5* 16±6* 1.20±0.42* 19±5* 1.51±0.38*凯-辛联用组 12.5±3.2△ 45±10△ 0.62±0.23△ 28±5△ 0.87±0.22△虾青素低剂量组 7.3±2.8#▲ 25±10#▲ 0.88±0.14#☆ 22±6☆ 1.17±0.18#▲虾青素高剂量组 13.6±5.6△ 43±14△ 0.56±0.39△ 27±8# 0.81±0.27对照组△
2.4 主动脉切片HE染色结果 对照组主动脉弓内膜完整无明显变化。高脂模型组主动脉弓内膜见不同程度的斑块隆起,斑块中见大量的泡沫细胞。虾青素低、高2剂量及凯-辛联用组主动脉弓内膜斑块形成均较高脂模型组有明显的改善,且高剂量虾青素改善效果更理想。见图1。
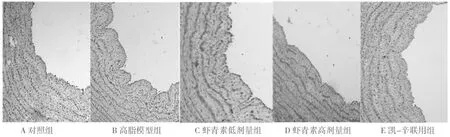
图1 鹌鹑主动脉内膜显微镜照片(HE×100)
3 讨论
心脑血管疾病是严重威胁人类健康的疾病之一,有关病因及其防治措施一直受到人们的关注。动脉粥样硬化(AS)的主要病变特征为动脉某些部位的内膜下脂质沉积,并伴有平滑肌细胞和纤维基质成分的增殖,逐步发展形成AS性斑块。LDL-C在AS的发生发展中起着非常重要的作用,LDL促进AS的发生发展主要通过氧化型低密度脂蛋白(ox-LDL)的作用得以实现。研究表明,ox-LDL诱导血管平滑肌细胞(VSMC)的增生和凋亡[7],VSMC位于血管中膜层,ox-LDL引起平滑肌细胞从血管中膜移行入内膜,并通过诱导巨噬细胞、血管内皮细胞及血小板细胞产生血小板源性生长因子(PDGF)和碱性成纤维细胞生长因子(bFGF),促进平滑肌增生,并分泌基质使血管内膜增厚[8-10]。内皮细胞对自由基和脂质过氧化作用非常敏感。LDL氧化过程中产生的过氧化脂质可以直接损伤内皮细胞。Ox-LDL可使内皮细胞对LDL的通透性增高,胞浆发生空泡变性,浆膜皱缩,甚至可使细胞最终坏死[11,12]。Ox-LDL 能促进细胞色素C从线粒体中释放到细胞质中,损坏了线粒体膜,进而诱导内皮细胞的凋亡[13]。而高脂血症可导致氧自由基及其他活性氧成分释放增多,从而造成大量LDL被氧化,促进血管脂质过氧化损伤的进一步发展。血清中高密度脂蛋白(HDL)与心血管事件危险性呈负相关,被认为是一种保护性脂蛋白。HDL通过参与胆固醇的逆向转运、拮抗LDL氧化、保护内皮功能等机制发挥其抗AS作用。在脂质代谢过程中,肝脏是重要的脏器,维持肝脏功能的正常,对脂质代谢,抑制过氧化损伤都有很重要的意义。本实验用高脂饲料饲喂鹌鹑建立鹌鹑高脂血症模型,与人类因膳食结构改变而形成的高脂血症相似,对人类高脂血症的研究具有指导意义。本研究结果显示,虾青素能有效降低血浆中TG、TC、LDL含量,显著增加血浆中HDL含量;同时均能显著降低肝中内源性TG、TC的合成量。以上结果表明,虾青素具有较强的降脂功效,其对血脂和肝脂含量均有很好的调节作用。
机体内促氧化与抗氧化系统平衡的破坏,是导致各种自由基氧化损伤疾病产生的最重要的原因。动物体内自由基是机体氧化过程中释放的一种活泼的有害物质,它在机体内肆意掠夺其他分子的电子,破坏重要生物大分子(如细胞酶、DNA、RNA、蛋白质等)的结构,使其丧失生理功能,从而导致细胞膜破坏、酶失去活性、基因受损、细胞变异,使体内重要组织脏器功能低下,导致各种疾病的发生。氧化应激过程中产生的超氧阴离子(O-2)、羟自由基(OH-)、过氧化氢(H2O2)直接充当细胞内信号分子或通过充当细胞膜或胞核受体的配体而调节多个类别的基因表达,包括黏附分子及化学趋化因子的表达增加,在As病变早期起着关键作用[14]。氧应激被认为是肝脏脂肪变发展为脂肪性肝炎的催化剂,氧应激与脂质过氧化损伤在脂肪肝的形成和发展过程中起重要作用,是脂肪肝受到第二次打击进一步发展的重要因素。此外,高血脂时体内自由基产生和清除平衡被破坏,许多自由基清除剂(如SOD、CAT)活性降低,产生大量的脂质过氧化物(LPO)。因此,维持机体抗氧化系统的正常工作是防治自由基氧化损伤所致疾病的重要措施。SOD是一种广泛存在于生物体内与细胞氧化代谢密切相关的蛋白质,是活性氧自由基的天然消除剂,是抗氧化酶系中最先与活性氧自由基结合的酶类。SOD能特异性结合体内超氧阴离子,且可与GSH-Px协同作用防止脂质过氧化及其代谢产物对机体的损害[15],还可直接捕捉和清除超氧阴离子等自由基[16],通过氢原子供体的作用阻断或终止自由基连锁反应链,从而阻止和抑制氧自由基反应和脂质过氧化反应的病理性加剧,起到抗氧化作用。GSH-Px能催化过氧化氢的还原反应,对由活性氧和羟自由基诱发的脂质过氧化物及过氧化氢有极强的清除能力,从而保护生物大分子和生物膜结构免受过氧化物损伤[17]。GSH是机体内一种重要的抗氧化小分子,其为一种三肽化合物;在GSH-Px的催化下,GSH可还原细胞内产生的过氧化物,与此同时,GSH被氧化成氧化型谷胱甘肽(GSSG);后者在谷胱甘肽还原酶(GR)催化下,再生成GSH。检测体内GSH的含量可间接反映出GR活性的高低。一氧化氮(NO)是近年来逐渐明确的细胞信息分子,具有维持血管张力、调节血压,抑制血管平滑肌细胞迁移、增生,抑制血小板聚集与白细胞对血管壁的黏附、调节影响心肌收缩与舒张功能的作用[18]。作为决定NO生成的酶,一氧化氮合酶(NOS)在体内广泛分布,其中血管内皮细胞是最集中部位[19]。体内NOS存在3种异构体,根据其首次克隆时所在组织不同,分别命名为:内皮型NOS(eNOS)、神经型NOS(nNOS)、巨噬细胞诱导型NOS(iNOS),其中eNOS和nNOS合称为结构型NOS(cNOS)。研究认为,由cNOS催化产生的NO主要起生理信使作用,而由iNOS产生的NO主要参与免疫炎性反应和细胞毒作用。心血管疾病包括动脉粥样硬化、心肌缺血、缺血再灌注损伤、充血性心衰等都与iNOS表达过量NO紧密相关[20]。在人动脉粥样硬化主动脉的脂质条纹病变和粥样硬化病变部位,iNOS在内皮细胞、平滑肌细胞及巨噬细胞中广泛表达,蛋白修饰明显增多并多存在于iNOS阳性部位。在动脉粥样硬化的早期,斑点中就发现iNOS活化,由iNOS衍生的过量NO诱导的硝化应激又加重了动脉粥样硬化[21]。有研究显示由iNOS活性增加而致高浓度的NO产生,可抑制肝细胞蛋白质的合成、损伤DNA结构,直接抑制线粒体呼吸,使肝细胞内能量代谢障碍而引起肝细胞凋亡和坏死[21];同时,高浓度NO与氧自由基反应生成超氧化亚硝基阴离子(ONOO-),后者是蛋白和非蛋白巯基的强氧化剂,攻击肝星状细胞引发脂质过氧化连锁反应。本实验研究的天然虾青素具有特殊的分子结构,体外实验发现它是单线态氧的强淬灭剂;在雨生红球藻活细胞内,它作为光保护剂和强抗氧化剂,能够淬灭由强光和过度氧化产生的多种活性氧,防止活性氧对细胞的伤害。
本研究结果显示,鹌鹑高脂状态下血清和肝组织中SOD、GSH-Px活性均较对照组有明显的下降,iNOS活性均显著高于对照组;而虾青素能显著增强此两种抗氧化酶的活性,并且强烈抑制iNOS活性,从而有效缓解由高脂诱发的机体脂质过氧化损伤的程度。本研究通过鹌鹑高脂动物模型体内实验观察显示,虾青素具有很好的降脂功效;并对高脂诱发的血管及肝脏脂质过氧化损伤有明显的抑制作用;高剂量虾青素(10mg/kg)作用效果更为理想。
1 赵文恩.类胡萝卜素抗氧化性质的研究.郑州大学学报(工学版),2003,24:38-46.
2 Stahl W,Sies H.Bioactivity and protective effects of natural carotenoids.Biochimica et Biophysica Acta,2005,1740:101-107.
3 Wieslaw IG,Kazimierz S.Carotenoids as modulators of lipid membrane physical properties.Biochimicaet Biophysica Acta,2005,1740:108-115.
4 Van Duyn MA,Pivonka E.Overview of the health benefits of fruit and vegetable consumption for the dietetics professional:selected literature.J Am Diet Assoc,2000,100:1511-1521.
5 Mayne ST.Beta-carotene,carotenoids,and disease prevention in humans.FASEB J,1996,10:690-701.
6 赵文恩,康保珊,焦凤云,等.类胡萝卜素的抗癌作用与基因表达的联系.生物学杂志,2006,23:1-6.
7 Zhao GF,Seng JJ,Zhang H,et al.Effects of oxidized low density lipoprotein on the growth of human artery smooth muscle cells.Chin Med J,2005,118:1973-1978.
8 Vindis C,Escargueil-Blanc I,Uchida K,et al.Lipid oxidation products and oxidized low-density lipoproteins impair platelet-derived growth factor receptor activity in smooth muscle cells:implication in atherosclerosis.Redox Rep,2007,12:96-100.
9 Deng DX,Spin JM,Tsalenko A,et al.Molecular signatures determining coronary artery and saphenous vein smooth muscle cell phenotypes:distinct responses to stimuli.Arterioscler Thromb Vasc Biol,2006,26:1058-1065.
10 Vindis C,Escargueil-Blanc I,Elbaz M,et al.Desensitization of plateletderived growth factor receptor-beta by oxidized lipids in vascular cells andatherosclerotic lesions:prevention by aldehyde scavengers.Circ Res,2006,98:785-792.
11 Hadi HA,Carr CS,Al Suwaidi J.Endothelial dysfunction:cardiovascular risk factors,therapy,and outcome.Vasc Health Risk Manag,2005,1:183-198.
12 Davignon J,Ganz P.Role of endothelial dysfunction in atherosclerosis.Circulation,2004,109:27-32.
13 Vasques E,Almeida AL,Noya V,et al.Impairment of endothelium-dependent aorta relaxation by phospholipid components of oxidized lowdensity lipoprotein.Endothelium,2006,13:1-8.
14 Lubos E,Handy DE,Loscalzo J.Role of oxidative stress and nitric oxide in atherothrombosis.Front Biosci,2008,13:5323-344.
15 Zhang YM,Ji LL.Isoflavones lowers blood lipid of atherosclerotic rat.Chin Prev Med,2005,6:124.
16 Alul RH,Wood M,Longoj,et al.Vitamin C protects low density lipoprotein from homocysteine mediated oxidation.Free Radic Biol Med,2003,34:881-889.
17 Sairam RK,Singh DV,Srivaatava GC.Changes in activities of antioxidant enzymes in sunflower leaves of different age.Biol Plant,2003,47:61-66.
18 Mayhan WG,Arrick DM,Sharpe GM,et al.Nitric oxide synthase-dependent responses of the basilar artery during acute infusion of nicotin.Nicotine Tob Res,2009,11:270-277.
19 Sabrane K,Kruse MN,Gazinski A.Chronic endothelium-dependent regulation of arterial blood pressure by atrial natriuretic peptide(ANP):role of nitric oxide and endothelin-1.Endocrinology,2009,150:2382-2387.
20 Cook S.Coronary artery disease,nitric oxide and oxidative stress:the“Yin-Yang”effecta Chinese concept for a worldwide pandemic.Swiss Med Wkly,2006,136:103-113.
21 李隽,曹治宸.NO在CCl4致大鼠肝纤维化中的氧化应激作用.解放军医学杂志,2006,31:234-236.
