孕产妇感染侵袭性肺曲霉病1例并文献复习
2012-06-02李卓朱龙有
李卓 朱龙有
1 临床资料
患者女,27岁,孕产妇,因咳嗽、咳痰、呼吸困难伴发热半个月于2011年4月18日入院。该患于半个月前(临产前1 d)无明显诱因突发咳嗽、咳痰、呼吸困难伴高热,呼吸困难较重,夜间尤甚,平卧困难。痰量较多,呈黄色粘稠痰。在当地医院给予抗炎(去甲万古霉素、哌拉西林他唑巴坦,头孢米诺、头孢比肟、左氧氟沙星等)、平喘(甲强龙、安赛玛等)治疗后病情无明显好转,喘息明显加重而紧急转入我院。既往:身体健康,一年前行卵巢囊肿手术。无发热患者接触史,无外出史。追问病史,发病前半个月曾嗅及冰箱内高度发霉的柚子。入院时查体:一般状态差,推入病房,呼吸急促,双肺呼吸音粗,可闻及散在干、湿啰音,心率120次/min,节律欠规整,可闻及频发早搏,约10次/min。多功能监护示:血压127/71 mm Hg,心率120次/min,血氧饱和度95%(吸氧状态下)。实验室检查:血常规示WBC 23.58×109/L,RBC 2.91×1012/L,HGB 91 g/L,HCT 0.263,NEUT(%)94%。肾功尿素氮 4.5 mmol/L,肌酐 47 μmol/L,尿酸 120 μmol/L,二氧化碳 20 mmol/L。血离子示钙2.01 mmol/L。空腹血糖3.40 mmol/L。血浆D-二聚体大致正常。血气分析:pH 7.391,PCO234 mm Hg,PO233 mm Hg,SO263.8%(未吸氧状态下),HCO-320.6 mmol/L。尿常规示尿胆原(+)、胆红素(+)、酮体(±+)、亚硝酸盐阳性、白细胞7/HP。肝功示总胆红素28.8 μmol/L、直接胆红素 17.8 μmol/L、间接胆红素 11 μmol/L。总蛋白56.4 g/L、白蛋白28.4 g/L、前白蛋白0.068 g/L、胆碱酯酶3202U/L。免疫球蛋白IgA、IgG、IgM及补体C3、C4接近正常低值。CD3+、CD4+、CD4+/CD8+接近正常低值,CD8+增高。肾功、血糖、血离子、抗“O”、类风湿因子大致正常。5次痰均分离出烟曲霉菌。纤支镜刷检物培养出烟曲霉菌。双肺CT示两肺可见多个透光灶,形态不规则,壁较厚,边缘模糊,左上叶心影旁见条片样较淡磨玻璃影。入院后给予伏立康唑、伊曲康唑、两性霉素B、卡泊芬净治疗4个月,症状好转,复查影像病灶明显吸收。
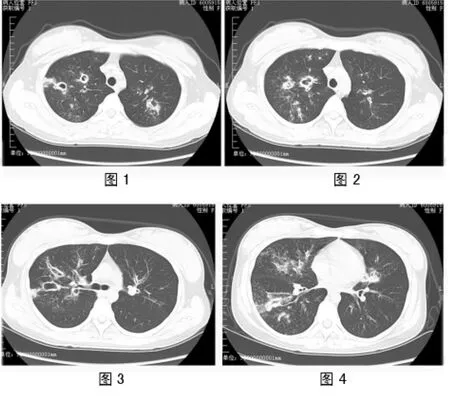
图1-4 为2011年4月18日肺CT扫描,两肺可见多个透光灶,形态不规则,壁较厚,边缘模糊,左上叶心影旁见条片样较淡磨玻璃影

图5-8 2011年8月12日肺CT扫描,病灶较前明显吸收,可见少量纤维硬结影
2 讨论
曲霉菌(aspergillus.Asp)属子囊菌纲真正子囊菌亚纲,是一类广泛存在于潮湿阴暗且缺乏通风的环境中的霉菌。在诸多曲霉菌属中,导致肺曲霉病(pulmonary aspergillosis,PA)95%以上是烟曲霉菌,其次为黄曲霉菌[1]。曲霉菌是条件致病菌,正常人对曲霉有极强的免疫力,吸入曲霉孢子不一定致病。但当肺部有感染性疾病,或机体免疫功能因长期使用抗生素、抗结核药、抗癌药或激素等免疫抑制剂而下降时,或大量吸入曲霉菌时可引起曲霉病,肺和鼻窦最易受累。大多数形式的肺曲菌病感染病情较严重,被称为潜在致死性机会感染,预后极差,病死率约50% ~100%[2]。本病例中患者为年青孕产妇,妊娠从免疫学上讲,类似于器官移植,母体免疫系统产生的是保护性免疫应答。同时有研究结果显示,孕妇CD3+、CD4+、NK、CD4+/CD8+比例低于正常对照组,而CD8+明显增高,表明细胞免疫功能明显受抑制。孕妇IgA、IgG、IgM、C3、C4低于正常对照组,表明体液免疫功能也受抑制。本例患者免疫功能低下,在此基础上因大量吸入曲霉孢子而引发了肺曲霉菌病。
临床表现:呈非特异性,主要有咳嗽、咯痰、咯血、胸痛等呼吸系统症状和发热、乏力、盗汗等全身症状。这些症状与肺结核、细菌性肺炎、肺癌以及其他呼吸系统疾病表现相似,临床极易误诊、漏诊,误诊率达74.6%。
影像学特点:侵袭性肺曲霉病影像学具有多形性、多变性特点。有资料显示多种形式的不同类型结节是IPA的常见表现形式,占42.3%左右。在病变的早期即最初的CT图像上,结节或实变周围常伴发晕征,且出现的几率较高,约占77.3%。有资料显示,约30 d后的复查影像中,晕征消失,而后肺实变区液化、坏死,出现空腔阴影或新月征。因此,在坏死物质与周围结构之间出现半月形或近似于环形的透亮环。影像上空气半月征和空洞的出现强烈提示IPA的可能,是肺曲霉病的特征性改变。EORTC/MSG标准中,将晕征、空气“新月”征和实变空洞影列为诊断IPA的临床影像学证据。因此,早期反复CT检查对早期诊断治疗及改善预后有积极的作用。
其他相关检查:曲霉菌感染的诊断方法除影像学以外,还包括镜检、培养、组织病理学、血清学和分子生物学检查。①组织培养及组织病理学检查是曲霉菌诊断的金标准。但检查具有创伤性,这对于全血细胞减少、病情危重的患者而言创伤性操作可能性不大,而且耗时长、敏感性低,故对于IPA这种进展迅速的疾病有明显的滞后性,极易贻误最佳治疗时机。②由于痰标本容易采集,气道分泌物真菌培养已成为诊断侵袭性肺部真菌感染最常用的方法,且已被列入造血干细胞移植及血液系统恶性肿瘤患者真菌感染的重要微生物学标准[3],近几年发展起来的纤维支气管镜技术在肺曲霉菌的诊断上起了重要作用,通过纤维支气管镜刷片、灌洗液培养、活检可大大提高曲霉菌的阳性率,敏感性43%,特异度100%[4]。③由于血液中极少能分离出曲霉菌,故血培养对IPA的诊断价值有限。④BALF抗原检测意义较大,比临床症状及影像学异常早出现1周,故研究最多也最有发展前景[5]。现所知Asp抗原包括:半乳甘露聚糖(GM)、1,3-B-D葡聚糖(BDG)、(1,3),(1,4)葡聚糖、甲壳素等,用于临床诊断的抗原主要为BDG,GM[6]。BDG检测(G试验):这种诊断方法可以诊断多种真菌的系统感染,但是不能区分感染真菌的种类。该方法具有良好的敏感性和特异性,敏感性为55%,特异性为93%。GM检测:GM是Asp细胞壁的特异组成成分。现在临床最常使用的样本为血清,敏感性波动较大(44%~100%),特异性波动于87% ~100%。GM比BDG在早期诊断上有优势[7]。但血清GM抗原的ELISA检查假阳性和假阴性率较高,一般来说,其假阳性率为1% ~18%,假阴性率为8%~10%,应具体分析。⑤外周血嗜酸粒细胞及IgE增高,可辅助诊断。
诊断:目前新的关于肺曲霉病的诊断根据宿主因素、临床特征、微生物学及组织病理学等方面的资料将其分为拟诊、临床诊断和确诊;四者全具备方可确诊肺曲霉病,具备前三项为临床诊断,只具备前两项为拟诊[8]。
治疗:对于IPA患者的早期诊断非常关键,其预后与是否及时采用大剂量的抗真菌治疗密切相关[9-10]。侵袭性肺曲霉病以抗真菌药物治疗为主,主要有两性霉素B及其脂质体、伊曲康唑、伏立康唑、卡泊芬净等,初始治疗中两性霉素B脂质体和伏立康唑是最常选用的抗真菌药物。与美国感染病协会(IDSA)的推荐一致[11]。其中两性霉素B效果最为肯定,但不良反应较大[12]。抗真菌药物治疗,两药序贯用药比例较大,主要为患者应用两性霉素B达到抗菌效果后,为减少其不良反应继续予以伊曲康唑治疗,同时药物用量要足。危重患者必要时可联合2种不同类型的抗真菌药物治疗[13]。曲霉菌体外实验证实,棘白霉素类和两性霉素B或三唑类药物合用时具有协同作用。两性霉素B+5-氟胞嘧啶具有协同作用,可减少毒性。伊曲康唑+两性霉素B,无拮抗疗效好。棘白霉素类+三唑类具有协同作用,可降低死亡率,减少组织中的真菌负荷,减轻真菌介导的肺损伤。卡泊芬净+安浮特克的有效率42%,安全性好。但是药物联用缺乏大规模临床研究证据。肺曲霉病的其他治疗包括免疫增强剂、营养支持和治疗基础疾病等。该患者入院后即先后应用伏立康唑、两性霉素B(因患者难以耐受副作用而停掉)及卡泊芬净静脉滴注,而后续惯伊曲康唑口服液口服,复查双肺CT病灶明显吸收而出院。可见,对于侵袭性肺曲霉病的危重患者,早期足量的抗真菌药物的应用可降低死亡率。
[1] Wan QL,Hal W,Yuehong C,et al.The first case of obstructingbronchial aspergillosis caused by Aspergillus sydowi.Int J Infect Dis,2004,8:132-133.
[2] Segal BH,Walsh TJ.Current approaches to diagnosis and treatment of invasive aspergillosis.Am J Respir Crit Care Med,2006,173:707-717.
[3] 卫生部医政司医院内感染监控协调小组.医院感染的诊断标准.中华医院管理杂志,1990,6:306-307.
[4] 周新.肺曲霉病的分类与实验室诊断.中国感染与化疗杂志,2007,7:425-427.
[5] Ben E,Pauw MD,Peter D.Prophylaxis and Aspergillosis-Has the Principle Been Proven.Nejmofg,2007,1:409-411.
[6] Rovira M,Jimenez M,Bellacasa JP,et al.Detection of Asporgillus galactomannan by enzyme immunoabsorbent assay in recipients of allogeneic hematopoietie stem cell transplantation:a prospective study.Transplantation,2004,77(8):1260-1264.
[7] Pazos C,Ponton J and Palacio A.Contribution of(1-3)-beta-D glucarl chromogenie assay to diagnosis and therapeutic monitoring of invasive asperigillosis in neutropenic adult patients:a comparison with serial screening for circulating galactomannan.J Clin Miembiol,2005,43:299-305.
[8] 中华内科杂志编辑委员会.侵袭性肺部真菌感染的诊断标准与治疗原则(草案).中华内科杂志,2006,45:697-699.
[9] Kuhlman JE,Fishman EK,Burch PA,et al.Invasive pulmonary Aspergillosis in acute leukemia:the contribution of CT to early Diagnosis and aggressive management.Chest,1987,92(1):95-99.
[10] Horger M,Einsele H,Schumaeher U,et al.Invasive pulmonary aspergiIlosis:frequency and meaning of the“hypodense sign”on unenhanced CT.Br J Radiol,2005,78(932):697-703.
[11] walsh TJ,ArIaissie EJ,Dennjng DW,et al.Treatment of aspergillosis:clinical Practice guidelines of the infectious diseases society of America.Clin Infect Dis,2008,46:327-360.
[12] 陈灏珠.实用内科学.第12版.北京:人民卫生出版社,2005:1687.
[13] 中华内科杂志编辑委员会.血液病/恶性肿瘤患者侵袭性真菌感染的诊断标准与治疗原则(草案).中华内科杂志,2005,44:554-556.
