慢性应激抑郁大鼠海马CA1神经元突触可塑性研究☆
2012-05-25潘苗,张三强,裴丽粉等
海马在学习记忆[1-3]、应激调控中起关键作用[4-7]。有研究认为海马可能参与情绪的控制和反应,其结构损伤可能是抑郁症患者情绪低落和学习记忆能力下降的基础[8,9]。目前国内外相关研究多集中在神经系统功能可塑性方面,对神经结构可塑性的研究较少[10-14],且多处于神经元形态结构水平,尚未见到针对神经信息传递最为关键的突触结构的研究[12,16]。本研究采用电镜及图像分析技术对CUMS大鼠海马CA1区神经元突触界面结构参数进行研究,力求从神经元突触角度为抑郁症的神经结构可塑性发病机制提供形态学依据。
1 材料与方法
1.1 材料 实验对象为30只健康雄性Sprague-Dawley(SD)大鼠,月龄 2~3个月,体重 180 g~220 g,首先用open-field实验进行行为学评分,从中选择评分相近的20只,将其置于安静舒适实验环境单笼饲养,自然昼夜节律光照,平均室温(22±1)℃,空气湿度50%~60%,并可自由进食进水。适应饲养1周,每日触摸使其适应实验人员的操作。1周后进行随机分组:对照组(即CON组,n=10只)、抑郁症组(即 CUMS组,n=10只)。
1.2 慢性轻度不可预见应激(ch ronic unpredictable mild stress,CUMS)抑郁模型的建立 本研究选用的应激因子尽可能满足慢性、轻度、不可预见性条件。实验大鼠持续28 d接受不同的应激因子,包括群居饲养(5 只/笼)、通宵照明、40°鼠笼倾斜、潮湿垫料(300 mL纯水浸湿垫料)、禁水后空瓶放置、频闪光照(300flashes/min)及白噪音(80 db),实验过程中每天随机给予一种刺激,使大鼠不能预料刺激的发生。
1.3 糖水实验 CUMS实验前、应激第28 d在同等条件下进行糖水实验和体重测量,时间均安排在早上8时进行。记录大鼠体重(g)、总液体消耗量(mL)、糖水消耗量(mL)、纯水消耗量(mL),并计算糖水相对消耗量(mL/kg)、纯水相对消耗量(mL/kg)及糖水偏好程度[糖水偏好程度=糖水消耗量/总液体消耗量×100%]。糖水偏好用于评价快感缺乏程度,用糖水消耗量的下降来评定大鼠的抑郁程度。
1.4 open-field 实验 CUMS应激前及应激第28 d进行。本实验用于评定大鼠的探究活动与情绪反应。观察的行为学指标如下:①5 min内运动总格子数目:包括中间格子数与周边格子数,即四爪均进入的方格方可计数;②5 min内运动的周边格子数目;③5 min内运动的中间格子数目;④后肢直立次数:即两前肢离地1 cm或攀爬内壁即为站立1次;⑤第1分钟内运动格子的总数目;⑥修饰次数:即清洁理毛、洗脸、舔舐次数;⑦大便粒数。
1.5 处死时点 应激前及应激第28 d进行行为测评后,每组各处死10只大鼠。
1.6 灌注、定位与取材 在选定的时间点,随机确定将要处死的SD大鼠。麻醉后,经心先用生理盐水150 mL快速灌注,后用含戊二醛4%多聚甲醛250 mL先快后慢灌注固定。迅速取脑,先分离左右脑,并进而分离出各侧脑的研究脑区。分别对左右侧的研究脑区置于2.5%戊二醛固定液中,待制备超薄电镜切片。
1.7 电镜标本制作 多次漂洗组织块,依次经1%四氧化锇后固定(2 h)、PBS漂洗3次、丙酮逐级脱水(50%、70%、90%、100%)、Epon812环氧树脂包埋,修块定位,UC6超薄切片机(R型)切片,片厚60 nm,捞片,用胶体金标记技术(一抗为DA抗体)处理后,醋酸铀、硝酸铅双重染色。
1.8 突触界面结构参数测量 在日本日立公司电子显微镜(H7500)下放大20000倍并随机摄片,用德国徕卡DM1000图像分析软件测量标记阳性神经元突触的突触界面曲率(参照Jones等的方法)[17]、突触活性区长度与突触后致密物厚度(参考 Guldner方法)[18]、突触间隙宽度(用多点平均法测定)。测量示意图见图1及图2。1.9 统计分析 数据用SPSS 13.0进行分析,糖水实验采用重复测量方差分析(a repeated measurement ANOVA),组间比较使用单因素方差分析。open-field实验使用non-parametric Friedman ANOVA进行统计分析,两组之间检验使用Student’s ttest。P<0.05被认为有统计学意义。

图1 突触界面曲率测量示意图(引自Jones)A.正向弯曲型突触(即突触后膜向前膜嵌人)B.平直型突触C.负向弯曲型突触(即突触前膜向后膜嵌人)
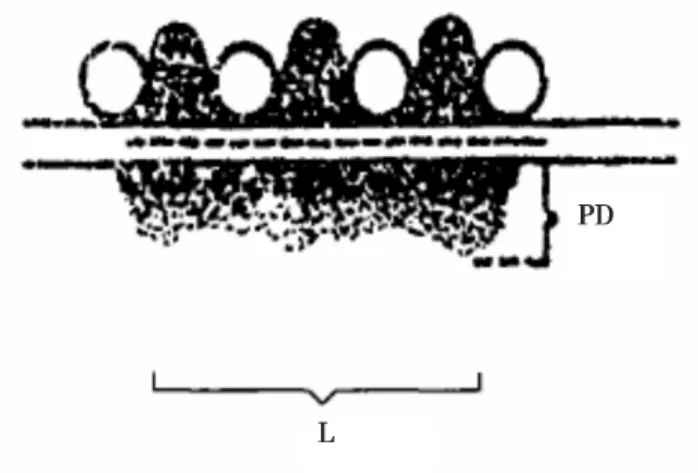
图2 突触活性区长度及突触后致密物厚度测量示意图(引自Guldner)PD=突触后致密物厚度(PSD)L=突触活性区长度
2 结果
2.1 慢性轻度不可预见性的应激对大鼠液体消耗量的影响 应激前两组大鼠总液体消耗、糖水消耗、纯水消耗的差异均无统计学意义(P>0.05)。CUMS组大鼠应激 28 d 后总液体消耗、糖水消耗均低于正常对照组,差异有显著性(F=40.29,P<0.05;F =42.11,P<0.05)。纯水消耗两组之间比较未见显著差异(F =0.882,P>0.05),见表1。
2.2 慢性轻度不可预见性应激对大鼠行为的影响
应激28 d时,CUMS组大鼠5 min内运动总格子数目及5 min内运动的周边格子数目与CON组大鼠相比无显著性差异,但是CUMS组第一分钟内运动格子的总数目显著多于CON组(χ2=7.6,P<0.05),CUMS组大鼠5 min内运动的中间格子数目及后肢直立次数比 CON组大鼠减少(χ2=9.1,P<0.05;χ2=5.9,P<0.05),修饰次数及大便粒数明显增多(χ2=7.3,P<0.05;χ2=5.9,P<0.05)。CUMS大鼠应激前与应激28 d时,在5 min内运动的中间格子数目、第1 min内运动格子的数目、后肢直立次数、修饰次数、大便粒数均有差异(均P<0.05)。

表1 慢性应激对大鼠液体消耗的影响

表2 慢性应激对大鼠行为的影响
2.2 慢性轻度不可预见性应激对大鼠海马CA1区神经元突触界面结构的影响 电镜观察显示,CON组突触数目较多,突触小泡较多,突触后致密物密度高,活性区较长。CUMS组突触相对数目较少,突触小泡量少,突触后致密物密度低,活性区长度短。见图1及图2。
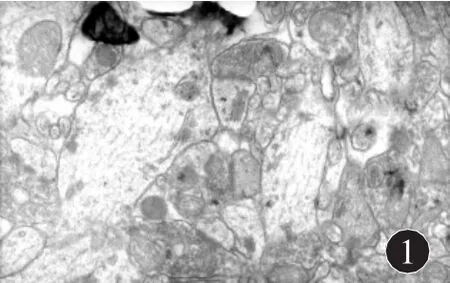
图1 CON组大鼠海马突触超微结构(×20000)

图2 CUMS组大鼠海马突触超微结构(×20000)
两组大鼠海马CAI区神经元突触界面结构参数测量结果显示,CUMS组大鼠海马CA1区神经元突触活性区长度及PSD厚度显著小于CON组(t=5.85,P<0.05;t=3.79,P<0.05),突触界面曲率和突触间隙宽度与对照组之间的差异无显著性(P>0.05)。见表 3。
3 讨论
神经可塑性指神经系统功能与结构的可塑性,宏观上表现为脑功能、行为表现及精神活动改变,微观上表现为神经元突触、神经环路的微细胞结构与功能的变化。抑郁模型建立成功与否是本研究的关键,本研究选用目前国际上得到广泛认可的CUMS建模方法,通过模拟人类中慢性低水平应激促发大鼠抑郁发生,CUMS中应激因子的多变性、不可预见性是建模成功的关键。本研究严格控制实验质量,在建模后28 d对CUMS大鼠进行行为学观察,发现CUMS组大鼠较正常对照组大鼠,糖水相对消耗量减少、糖水偏好程度显著降低(P<0.05),呈现出抑郁症核心症状 “快感缺乏”,在open-field实验中运动、修饰、排便等多项行为学上的变化提示CUMS组大鼠具有运动、探索能力、社交活动、攻击行为的减少,以及对陌生环境兴奋性减低、焦虑、恐惧等抑郁伴随症状[19,20],这均符合抑郁症动物模型建立的表面效度[21]。行为学测评显示本模型动物表现出的抑郁状态与抑郁症患者的临床表现有较高程度的相似性,抑郁症大鼠模型建立较为理想。

表3 两组大鼠海马CA1区突触结构参数的测量结果及比较
突触是神经元之间的连结,是神经信息传递的关键结构,是神经可塑性变化的敏感部位。突触可塑性(synaptieplastieity)是指突触在形态(突触形态的改变以及新的突触联系的形成和传递功能的建立)和功能上(突触的反复活动引致突触传递效率的改变)的改变[22-24]。突触界面结构参数是反映突触可塑性改变的敏感指标,目前常用的为突触界面曲率、突触活性区长度、突触间隙宽度及突触后致密物厚度等。突触界面结构与突触功能状态及神经信息传递有重要联系[26,27]。突触界面曲率、活性区长度、PSD增厚减小及突触间隙变宽可能是突触传递功能降低的结构基础[24-26]。本研究显示,CUMS抑郁大鼠应激28d后,海马CA1区神经元突触活性区长度及PSD厚度显著小于对照组,这提示在CUMS造模过程中大鼠海马CA1脑区的神经元突触结构产生了可塑性改变,而根据突触结构与神经信息传递的重要联系分析,这种突触结构可塑性的改变可能会导致神经信息传递功能的下降,从而引起认知、情感等多方面的抑制,导致患者表现出抑郁症的各种临床症状。综上所述,本研究显示CUMS抑郁大鼠海马CA1脑区的神经元突触结构产生了可塑性改变,这种可塑性改变可能是抑郁症发生的重要形态学基础,可能在抑郁症的发病机制中起重要作用。
本研究旨在从突触角度验证抑郁症的神经可塑性假说,为以海马神经元再生为靶点的新型抗抑郁药物的开发[27]提供理论依据。本研究作为系列研究的第一步,只评价了突触结构的改变,未对突触结构改变和特征性行为改变之间进行相关性研究,有待在后续研究中完善,另外本研究只是单一时点研究(应激开始后28 d),多时点(建模前后的 7个时间点建模前、建模后 7 d、14 d、21 d、28 d、42 d、56 d),多脑区(杏仁核、海马各区等)与中枢神经递质及药物治疗的相关性研究正在进行中。
[1]Bliss TV,Collingridge GL.A synaptic model of memory: longterm potentiation in the hippocampus[J].Nature,1993,361(6407):31-39.
[2]Eichenbaum H.A cortical-hippocampal system for declarative memory[J].Nat Rev Neurosci,2000,1(1):41-50.
[3]Martin SJ,Grimwood PD,Morris RG.Synaptic plasticity and memory: an evaluation of the hypothesis[J].Annu Rev Neurosci,2000,23:649-711.
[4]Xu L,Holscher C,Anwyl R,et al.Glucocorticoid receptor and protein/RNA synthesis-dependent mechanisms underlie the control of synaptic plasticity by stress[J].Proc Natl Acad Sci U S A,1998,95(8):3204-3208.
[5]Xu L,Anwyl R,Rowan MJ.Behavioural stress facilitates the induction of long-term depression in the hippocampus[J].Nature,1997,387(6632):497-500.
[6]Kim JJ,Diamond DM.The stressed hippocampus,synaptic plasticity and lostmemories[J].Nat Rev Neurosci,2002,3(6):453-462.
[7]Kim JJ,Foy MR,Thompson RF.Behavioral stress modi-fies hippocampal plasticity through N-methyl-D-aspartate re-ceptor activation[J].Proc Natl Acad Sci USA,1996,93(10):4750-4753.
[8]Sheline YI,Wang PW,Gado MH,et al.Hippocampal atrophy in recurrent major depression[J].Proc Natl Acad Sci U S A,1996,93(9):3908-3913.
[9]吴鹤鸣,李静,郭国祯,等.慢性应激抑郁大鼠学习记忆及海马非对称性超微结构的改变[J].现代生物医学进展,2007,7(1):9-11.
[10]Nestler EJ,Barrot M,DiLeone RJ,et al.Neurobiology of depression[J].Neuron,2002,34(1):13-25.
[11]Manji HK,Drevets WC,Charney DS.The cellular neurobiology of depression[J].NatMed,2001,7(5):541-547.
[12]Charney DS.Psychobiological mechanisms of resilience and vulnerability:implications for successful adaptation to extreme stress[J].Am J Psychiatry,2004,161(2):195-216.
[13]Gillespie CF,Nemeroff CB.Hypercortisolemia and depression[J].Psychosom Med,2005,67(Suppl 1):S26-S28.
[14]徐林.抑郁症的神经可塑性机制[J].中南大学学报,2008,33(4):326-330.
[15]Olie JP,Silva CE,Macher JP.Neuroplasticity-A New Approach to the Pathophysiology of Depression[J].Current Medicine Group,2005.
[16]Lampe IK,Janssen J,Schnack HG,et al.Association of Depression Duration with Reduction of Global Cerebral Gray Matter Volume in Female Patients with Recurrent Major Depressive Disorder[J].Am J Psychiatry,2003,160:2052-2054.
[17]Jones DG,Devon RM.An ultra-structural study into the effects of pentobarbital on synaptic organization[J].Brain Res,1978,147:47-63.
[18]Guldner FH,Ingham CA.Increase in post-synaptic density material in optic target neuron of the rat suprachismatic nucleus after bilateral enucleation[J].Neurosci Lett,1980,17(1-2):27-31.
[19]Gorman JM,Kent JM,Sullivan GM,et al.Neuroanatomical hyPothesis of panic Disorder,revised[J].Foeus 2004,2:426.
[20]Kinn AM,Grnli J,Fiske E,et al.A double exposure to social defeat induces sub-chronic effec ts on sleep and open field behaviour in rats[J].Physiology & Behavior,2008,95:553-561.
[21]Gronli J,Murison R,Bjorvatn B,et al.Chroniec mild stress affects sucrose intake and sleep in rats[J].Behav Brain Res,2004,150:139-147.
[22]韩太真,昊馥梅.学习的神经生物学[M].北京:北京医科大学,中国协和医科大学联合出版社,1998,201-219.
[23]许绍芬.神经生物学[M].第二版.上海:上海医科大学出版社,1999,389-400.
[24]张瑞岭,郝伟,刘克菊,等.慢性吗啡处理大鼠伏隔核、海马CAI神经元突触可塑性研究[J].中国民康医学杂志,2004,16(3):132-134.
[25]章子贵,陆汉新,李振武,等.小鼠记忆保持能力与海马CA3区突触界面结构的相关性[J].神经科学,1995,2(3):136-140.
[26]吴馥梅,杜红燕,章子贵.突触界面曲率及其生理意义[J].神经解剖学杂志,1994,10(1):89-92.
[27]王真真,张有志,宫泽辉,等.抑郁症治疗的新靶点和新策略[J].中国药理学与毒理学杂志,2010,24(5):264-270.
