靶向Xklp2靶蛋白和极光蛋白在脑胶质瘤中的表达及其临床意义
2012-05-25申海龙,梁朝辉,耿少梅
细胞有丝分裂受多种蛋白调控,其中,靶向Xklp2靶蛋白(targeting protein for Xenopus kinesinlike protein 2,TPX2)是一个受细胞周期严格调控的核增殖蛋白,参与细胞有丝分裂过程中纺锤体微管的组装和调控[1-4]。极光蛋白(serine/threonineprotein kinase 6,Aurora-A)作为与中心体相关的原癌基因,主要参与细胞有丝分裂的调控,TPX2是Aurora-A靶向到纺锤体装置所必需的。有证据表明[3]TPX2、Aurora-A 的过表达能够促进肿瘤细胞恶性增殖。然而,TPX2和Aurora-A在胶质瘤发生发展过程中的变化及其与临床病理特征的关系尚不明确,本研究拟采用免疫组织化学方法对50例手术切除的胶质瘤组织及10例正常脑组织标本中TPX2和Aurora-A蛋白表达情况进行检测,探讨TPX2和Aurora-A在胶质瘤发生发展中的作用及其意义。
1 资料与方法
1.1 研究对象 河北医科大学第二医院神经外科2010年5月至2011年5月手术切除的50例脑胶质瘤标本,10例对照脑组织取自因颅脑损伤行内减压术者。标本常规石蜡包埋切片,HE染色。所有标本经病理科确诊,术前均未行过放化疗,有完整的临床病理资料和随访资料。50例胶质瘤患者中,男28例,女22例;年龄15~68岁,平均(34±4)岁。按WHO(2007年)分级标准分级:Ⅱ级25例,Ⅲ级12例,Ⅳ级13例,其中Ⅱ级为低级别,Ⅲ-Ⅳ级为高级别。试剂:TPX2兔抗人单克隆抗体,于Bioworld technology公司购买。Aurora-A单克隆抗体购于Epitomics公司,SP免疫组织化学试剂盒购于北京中山生物技术有限公司。
1.2 Aurora-A和TPX2免疫组织化学染色方法
将术中所取胶质瘤和正常脑组织标本进行脱水、包埋、切片、脱蜡、修复、分别加入一抗、二抗、三抗,DAB显色,苏木精复染,封片,在显微镜下观察。其中TPX2与Aurora-A抗体稀释倍数分别为1∶100和1∶100,二者修复条件均为枸橼酸热修复。用已知TPX2和Aurora-A阳性的宫颈癌做阳性对照,用PBS代替一抗作阴性对照。
1.3 结果判定 对二者的结果分析采用半定量分析方法,具体内容参照文献[5]对阳性染色结果进行评分,即在高倍视野(400×)随机选择五个区域,每个区域计数100个细胞,以胞核及胞浆出现黄色或棕黄色着色为阳性表达。着色评价如下:0分代表无染色;1分代表弱着色;2分代表轻度着色;3分代表重度着色。细胞评价如下:0分代表没有肿瘤细胞;1分代表肿瘤细胞占0%~10%;2分代表肿瘤细胞占11%~50%;3分代表肿瘤细胞占50%以上。两种得分相加介于0~1分为“-”;介于 2~3分为“+”;4~5分为“++”;6~9分为“+++”。
1.4 统计学分析 应用SPSS 17.0处理数据,采用Spearman相关分析和卡方检验,检测水准α=0.05。
2 结果
2.1 Aurora-A在胶质瘤组织中的表达 Aurora-A
在正常脑组织中未见表达(图1A),在胶质瘤组织中随级别增高表达增高,阳性物质主要位于肿瘤细胞的胞质及胞核,呈棕黄色(图 1B,C,D)。Aurora-A在胶质瘤组织中的阳性表达率为56.0%(28/50),在高级别胶质瘤中( Ⅲ-Ⅳ级)的表达水平(10/25)显著高于低级别组(Ⅱ级,18/25)(χ2=5.195,P =0.023)。
2.2 TPX2在胶质瘤组织中的表达 TPX2在正常脑组织中未见表达(图2A),在胶质瘤组织中随级别增高表达增高,阳性物质主要位于肿瘤细胞的胞质及胞核,呈棕黄色(图 2B,C,D)。TPX2在胶质瘤组织中的阳性表达率为 62.0%(31/50),在高级别胶质瘤中(Ⅲ-Ⅳ级)的表达水平(11/25)显著高于低级别组(Ⅱ级,20/25)(χ2=6.876,P =0.009)。
2.3 Aurora-A和 TPX2表达的相关性 表 1显示,在胶质瘤组织中TPX2、Aurora-A蛋白表达呈正相关(r=0.521,P<0.01)。
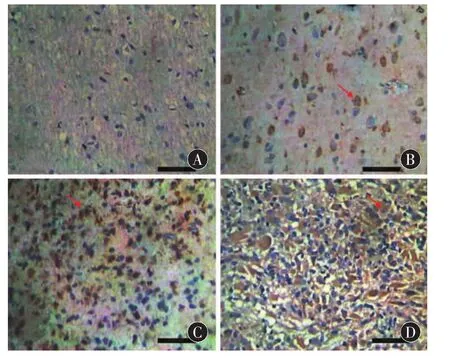
图1 Aurora-a在脑胶质瘤组织和正常脑组织中的表达(SP×100;比例尺 20 μm)。A:正常脑组织中 Aurora-a表达;B:星形细胞瘤Ⅱ级中Aurora-a表达; C:星形细胞瘤Ⅲ级中Aurora-a表达;D:多形性胶质母细胞瘤Ⅳ级中Aurora-a表达

图2 TPX2在脑胶质瘤组织和正常脑组织中的表达(SP×100;比例尺20 μm)。A:正常脑组织中 TPX2表达;B:星形细胞瘤Ⅱ级中TPX2表达;C:星形细胞瘤Ⅲ级中TPX2表达;D:多形性胶质母细胞瘤Ⅳ级中TPX2表达

表1 Aurora-A和Tpx2在胶质瘤和正常脑组织中的表达
3 讨论
脑胶质瘤是颅内最常见的恶性肿瘤,由于胶质瘤呈侵袭性生长,胶质瘤术后高复发率及其对放化疗抵抗,给胶质瘤的治疗带来极大挑战。脑胶质瘤原核细胞通过有丝分裂进行增殖,组织纺锤体和中心体在细胞周期进程中起着重要作用,它们作为细胞微管骨架,对细胞分裂为两个子细胞具有重要意义。蛋白激酶如Aurora-A、Polo和Neks激发并调控纺锤体和中心体复制、成熟和分裂[1-4]。Aurora-A作为Aurora激酶一种,与肿瘤的关系较为密切,有研究证实Aurora-A可以激发细胞分裂G2期的扳机点,使细胞更容易进入分裂期,并参与中心体的合成及调控[6]。近年来,越来越多的研究表明,Aurora-A 在乳腺癌[7],卵巢癌[8],食管癌[9]等肿瘤中存在过表达。探讨其促进肿瘤增殖及发生的原因除了与Aurora抑制抑癌基因P53因素外,还与Aurora-A和原癌基因c-Myc具有协同作用有关。因此,以Aurora-A为靶点的抑制肿瘤细胞增殖作为抗肿瘤治疗的新思路,引起了研究者的关注。
TPX2是一种核增殖相关蛋白,是微管组装、纺锤体形成的关键蛋白,参与有丝分裂期间纺锤体的形成并保持中心体完整。研究表明,TPX2具有高度的恶性生物学行为和促使细胞周期失调的功能,在多种恶性肿瘤如肺鳞状细胞癌,唾液腺癌,卵巢癌中呈高表达[10-12]。TPX2 在纺锤体装配调控中的功能需要Aurora-A共同参与发挥作用,TPX2、Aurora-A高表达与异倍体和基因组的不稳定密切相关[13-14],有证据表明 TPX2、Aurora-A 与食管鳞癌的发生发展有密切关系,而且二者间存在正相关[15-16]。
我们通过免疫组织化学的方法对胶质瘤组织和正常脑组织中TPX2、Aurora-A表达进行检测发现,Aurora-A在胶质瘤组织中存在高表达,而正常脑组织中则检测不到Aurora-A表达,尤其在高级别胶质瘤中更显著,推测该基因有可能是恶性胶质瘤的一个新的标志物,或可作为分子治疗的靶点;TPX2蛋白表达水平在肿瘤组织中明显高于正常组织,而且随着胶质瘤分级的增高,TPX2的表达水平越高,提示该蛋白与脑胶质瘤的恶性增殖有关。经统计学分析得出,在脑胶质瘤组织中Aurora-A、TPX2的表达存在正相关关系,结合针对二者对体部肿瘤具有生长增殖作用的上述报道[7-12],我们推测在胶质瘤细胞增殖过程中,TPX2对于胶质瘤细胞的有丝分裂期间纺锤体的形成并保持中心体完整性具有重要作用,而Aurora-A对TPX2复合体的形成具有促进作用,二者在胶质瘤的发生、发展及侵袭性生长过程中可能起协同作用。
本研究通过免疫组化方法证实胶质瘤组织中存在二者高表达这一现象,从而需要进一步开展动物实验及细胞功能试验明确两者在胶质瘤细胞增殖中的作用。随着对肿瘤基因治疗的探索,在体部肿瘤中已经开始应用基因敲除的方法实现肿瘤细胞增殖抑制的实验报道,已经取得阶段性成功 [17-19]。
[1]Bibby RA,Tang C,Faisal A,et al.A cancer-associated aurora A mutant is mislocalized and misregulated due to loss of interaction with TPX2[J].J Biol Chem,2009,284(48):33177-33184.
[2]Gruss OJ,Vemos I.The mechanism of spindle assembly:functions of Ran and its target TPX2[J].J Cell Biol,2004,66(7):949-955.
[3]Wittmann T,Hyman A,Desai A.The spindle:a dynamic assembly of microtubules and motors[J].Nat Cell Biol,2001,3(1):E28-34.
[4]Tong T,Zhong R,Kong J,et al.Overexpression of Aurora-A contributes to malignant development of human esophageal squamous cell carcinoma[J].Clin Cancer Res,2004,10(21):7304-7310.
[5]Klein M,Vignaud JM,Hennequin V,et al.Increased expression of the vascular endothelial growth factor is a pejorative prognosis marker in papillary thyroid carcinoma[J].J Clin Endocrinol Metab,2001,86(2):656-658.
[6]Marumoto T,Hirota T,Morisaki T,et al.Roles of aurara-A kinase in mitotic entry and G2 checkpoint in ammalian cells[J].Genes Cells,2002,7(11):1173-1182.
[7]Nadler Y,Camp RL,Giltnane JM,et al.Expression patterns and prognostic value of Bag-1 and Bcl-2 in breast cancer[J].Breast Cancer Res,2008,10(2):R35.
[8]Landen CN Jr,Lin YG,Immaneni A,et al.Overexpression of the centrosomal protein Aurora-A kinase is associated with poor prognosis in epithelial ovarian cancer patients[J].Clin Cancer Res,2007,13(14):4098-4104.
[9]Yang SB,Zhou XB,Zhu HX,et al.Amplification and overexpression of Aurora-A in esophageal squamous cell carcinoma[J].Oncol Rep,2007,17(5):1083-1088.
[10]Lin DM,Ma Y,Xiao T,et al.TPX2 expression and its significance in squamous cell carcinoma of lung [J]. Zhonghua Bing Li Xue Za Zhi,2006,35(9):540-544.
[11]Shigeishi H,Ohta K,Hiraoka M,et al.Expression of TPX2 in salivary gland carcinomas[J].Oncol Rep,2009,21(2):341-344.
[12]Scharer CD,Laycock N,Osunkoya AO,et al.Aurora kinase inhibitors synergize with paclitaxel to induce apoptosis in ovarian cancer cells[J].J Transl Med,2008,11(6):79.
[13]Tong T,Zhong R,Kong J,et al.Overexpression of Aurora-A contributes to malignant development of human esophagealsquamous cell carcinoma [J]. Clin Cancer Res,2004,10(21):7304-7310.
[14]Littlepage LE,Wu H,Andresson T,et al.Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proc Natl Acad Sci U S A,2002,99(24):15440-15445.
[15]钟亚莉,唐芙爱,童彤,等.Aurora-A对人食管癌细胞生物学性状影响.医药论坛杂志,2010,31(7):42-44.
[16]刘红春,刘玉含,李晟磊,等.TPX2和Aurora A在食管鳞癌中的蛋白表达及其临床病理意义[J].肿瘤防治研究,2009,36(11):932-935.
[17]Boss DS,Beijnen JH,Schellens JH.Clinicalexperiencewith aurora kinase inhibitors:a review [J]. Oncologist,2009,14(8):780-793.
[18]李宾,黄新,陈鑫,等.人脑胶质瘤中TPX2的表达及其病理相关性分析[J].中国微侵袭神经外科杂志,2011,16(1):35-37.
[19]Guchhait P,Shrimpton CN,Honke K,et al.Effectof an antisulfatide single-chain antibody probe on plateletfunction.Thromb Haemost,2008,99(3):552-557.
