人类大鼠肉瘤蛋白同源蛋白和高迁移率族蛋白A1在垂体腺瘤中的表达与侵袭性的关系☆
2012-05-25祝瑞,霍钢,崔敏
垂体腺瘤属颅内常见良性肿瘤,但约1/3的肿瘤呈侵袭性发展,可侵犯海绵窦、蝶窦、下丘脑等周围组织结构,使得手术全切除困难,患者术后常需放射治疗、药物治疗等综合治疗。尽管如此,侵袭性垂体腺瘤患者仍有较高的复发率。因此,探寻侵袭性垂体腺瘤的发病机制一直是研究的热点。近年来,在研究肿瘤侵袭性行为相关的靶点中发现:HRAS和HMGA1在细胞内信号传递和细胞增殖过程中起着关键和核心作用,与肿瘤发生密切相关,同时可作为判断肿瘤侵袭性程度的可靠生物学指标[1,2]。因此本研究将以 HRAS 和 HMGA1为研究靶点,检测二者分别在侵袭性、非侵袭性垂体腺瘤中的表达情况,并探讨二者与垂体腺瘤侵袭性行为发生的关系。
1 材料与方法
1.1 临床资料 收集2011年8月至2012年5月重庆医科大学附属第一医院神经外科60例垂体腺瘤患者的术后组织标本(经患者知情同意后进行相关实验),其中男25例,女35例,年龄16~72岁,平均年龄45.2岁。侵袭性垂体腺瘤的判断标准:①本研究采用Wilson改良的Hardy分类法[3]将Ⅲ~Ⅳ级或C、D、E期的肿瘤归为侵袭性腺瘤;②术前影像学改变,CT及MRI可见海绵窦、鞍旁及下丘脑等邻近结构的破坏;③术中所取鞍底骨质或邻近硬脑膜经病理学证实有肿瘤细胞侵犯;④术中见鞍底骨质及硬脑膜被侵袭破坏,肿瘤突入蝶窦腔或侵入鞍旁的血管神经。符合其中之一者即可确定为侵袭性垂体腺瘤。60例标本中,侵袭性垂体腺瘤病例标本28例,非侵袭性垂体腺瘤病例标本32例。所有病例术前有完善的影像学及内分泌检查资料,术后经病理诊断确诊。手术时取所需组织用生理盐水洗净积血,一部分置入4%多聚甲醛溶液内固定,一部分直接放入冻存管中,剩余一部分放入经焦碳酸二乙酯(DEPC)水处理过的冻存管中,后两者置入液氮备用。
1.2 逆转录-聚合酶链反应(RT-PCR)检测HRAS和HMGA1 mRNA表达 按Trizol试剂(购于大连宝生物工程公司)说明书步骤提取总RNA,-80℃冰箱保存备用。提取的RNA含量通过752型紫外分光光度计测定260 nm吸收值,按每OD260相当 40 μg RNA 计算 RNA 的产率,OD260在1.8~2.0视为抽提的RNA纯度很高。PCR引物由大连宝生物工程公司设计并合成。HRAS上游引物序列5-GCGATGACGGAATATAAGG-3,下游引物序列 5-ACTGGTGGATGTCCTCAA-3,产物长度 289 bp;HMGA1上游引物序列5-TCTCTGCTCCTTCACTGT-3,下游引物序列5-CTCCTGCCTTCCTGTAAC-3,产物长度 277 bp;β-actin上游引物序列5-GACCCAGATCATGTTTGAGACC-3,下游引物序列5-ATCTCCTTCTGCATCCTGTCG-3,产物长度594 bp;β-actin上游引物序列 5-TGCGTGACATTAAGGAGAA-3,下游引物序列5-AAGGAAGGCT GGAAGAGT-3,产物长度172 bp。RT扩增条件:37℃15 min,85℃5 s;PCR扩增条件: 94℃30 s,54℃ 30 s,72℃ 20 s,循环 35次,72℃延伸 5 min。产物经2%琼脂糖凝胶电泳分离;紫外灯下拍照,采用Quantity-one图像分析软件比较电泳条带光密度值,获得HRAS和HMGA1的相对表达量。
1.3 免疫组织化学 SABC法检测 HRAS和HMGA1蛋白表达 标本经4%甲醛固定,常规石蜡包埋连续切片,HE染色和免疫组化染色。微波炉加热修复,以3%H2O2溶液封闭内源性过氧化物酶,参照SP试剂盒(购置于北京中杉公司)产品说明书依次进行山羊血清封闭,以PBS代替一抗作阴性对照,一抗(HRAS和HMGA1单克隆抗体购置于美国ABCAM公司),4℃过夜,山羊抗兔二抗孵育,链霉素亲生物素蛋白-过氧化酶孵育等处理。DAB(购置于北京中杉公司)显色后,经苏木素复染、盐酸酒精分化,碳酸锂返蓝,酒精脱水、透明、中性树胶封片后于显微镜下进行观察。
根据IRS(immunoreactive score)半定量法计分:①染色深度,无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;②阳性细胞比例:在高倍(400×)镜下随机观察5个视野,每个视野计数200个细胞,计算各视野中阳性细胞数的平均百分比,作为该切片的阳性细胞百分比。5%以下为0分,5%~25%为 1分,26% ~50%为2分,51%~75%为3分,75%以上为4分。两项计分结果相加,0分计为(-),1~ 2分计为(+),3~ 6分计为(++),6 分以上计为(+++)。
1.4 Western Blot法检测 HRAS和 HMGA1蛋白表达 提取侵袭性及非侵袭性垂体腺瘤组织标本中的蛋白成分;BCA法测定蛋白浓度,加入样品缓冲液,置于沸水浴中加热5 min;制备15%的分离胶和5%浓缩胶;加样电泳(浓缩胶80 V,30 min;分离胶 120 V,90 min);电泳后湿转至硝酸纤维素膜上(110 mA,150 min);5%脱脂牛奶室温封闭 2 h;5%脱脂牛奶稀释一抗(1∶500~1∶1000),室温孵育2~4 h或4℃过夜;5%脱脂牛奶稀释二抗(1∶2000~ 4000),室温孵育 1~2 h;TBST 洗膜 3次;显影、定影。采用Image J分析软件比较免疫印迹条带灰度值。
1.5 统计学方法 采用PASW Statistics 18行两独立样本 t检验、χ2检验,检测水准 α =0.05。
2 结果
2.1 RT-PCR结果 HRAS在侵袭性垂体腺瘤中的 mRNA 表达(0.96±0.16),明显高于其在非侵袭性垂体腺瘤中的表达(0.54±0.15),差别具有统计学意义(t=10.437,P<0.05),见图 1;HMGA1在侵袭性垂体腺瘤中的mRNA表达(1.12±0.20),明显高于其在非侵袭性垂体腺瘤中的表达(0.52±0.19),差别具有统计学意义(t=11.742,P<0.05),见图 2。
2.2 免疫组织化学结果 HRAS阳性表达为垂体腺瘤细胞质内棕黄色颗粒,分布于淡蓝色细胞核周围。在侵袭性和非侵袭性垂体腺瘤组织中HRAS的阳性表达率分别为22/28和15/32,两组比较差异具有统计学意义(χ2=6.35,P<0.05)。HMGA1阳性表达可见细胞核内棕黄色颗粒,阴性表达者细胞核呈淡蓝色。在侵袭性和非侵袭性垂体腺瘤组织中 HMGA1的阳性表达率分别为 20/28和14/32,两组比较差异具有统计学意义(χ2=4.66,P<0.05),见图 3。
2.3 Western Blot结果 HRAS在侵袭性、非侵袭性垂体腺瘤组织中免疫印迹条带灰度值分别是(1.25±0.16)、(0.76±0.10)(t=14.848,P <0.05);HMGA1在侵袭性、非侵袭性垂体腺瘤组织中免疫印迹条带灰度值分别是(0.98±0.12)、(0.66±0.09)(t=11.852,P<0.05),见图 4。
3 讨论

图1 RT-PCR检测HRAS在侵袭性和非侵袭性垂体腺瘤组织中的表达。M:marker;1、2:侵袭性垂体腺瘤;3、4:非侵袭性垂体腺瘤
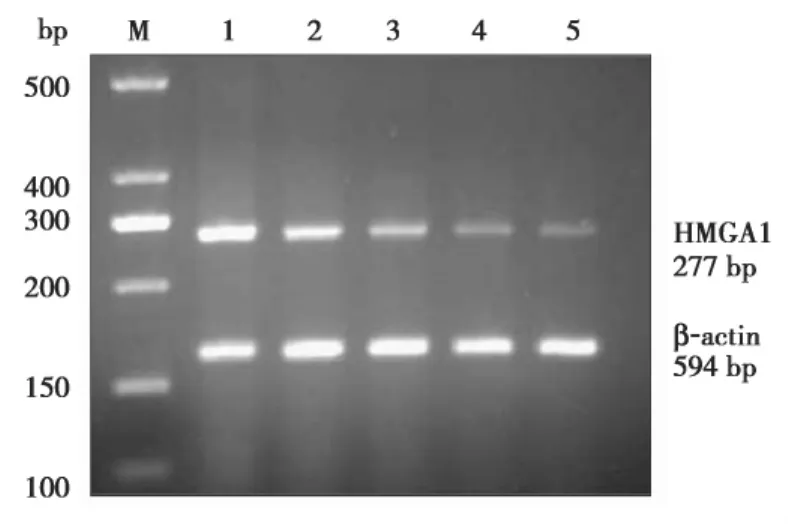
图2 RT-PCR检测HMGA1在侵袭性和非侵袭性垂体腺瘤组织中的表达。M:marker,1、2:侵袭性垂体腺瘤,3、4、5:非侵袭性垂体腺瘤
HRAS是RAS家族主要成员之一,它在细胞增殖、分化、凋亡等基本生理功能中起着重要作用。作为一个常见的癌基因,它参与了众多肿瘤的发生。Yong[1]等对HRAS的分子结构功能进行研究发现,由166位至189位的氨基酸组成的高变区(HRV区),是引起人乳腺细胞侵袭性生长与发生迁移的结构基础。而位于HRV区C-端的第173位和174位脯氨酸残基,则是促成HRAS激活及促进人乳腺细胞侵袭性生长的关键。HRAS磷酸化激活下游信号分子也是导致肿瘤发生的常见机制。在HRAS诱导老鼠皮肤癌的模型中发现,凋亡相关基因PI3K的催化亚基p110α(由PIK3CA编码)是RAS发挥关键作用的一个效应子[4]。HRAS诱导肿瘤细胞的侵袭性生长还与激活基质金属蛋白酶家族中MMP-2和MMP-9成员有关[5-6]。基质金属蛋白酶可通过降解基质胶原等结构蛋白成分,溶解破坏基底膜和细胞外基质,使肿瘤细胞向周围组织浸润。在本课题组前期的研究中发现MMP-2和MMP-9是促进侵袭性垂体腺瘤发生的重要原因[7-8]。在本研究中,HRAS在侵袭性、非侵袭性垂体腺瘤中的mRNA表达分别是(0.96±0.16)、(0.54±0.15)(P<0.05),在组织中阳性表达率分别为22/28和15/32(P<0.05),免疫印迹条带灰度值分别是(1.25±0.16)、(0.76±0.10)(P<0.05)。这些结果充分说明HRAS在侵袭性垂体腺瘤组织中的表达量显著高于非侵袭垂体腺瘤组织。根据目前的研究,我们推测,HRAS表达升高可能引起基质金属蛋白酶的分泌,从而使垂体腺瘤细胞外基质降解,参与其侵袭性行为的发生。我们先前的研究还发现自噬基因Beclin-1表达水平降低与垂体腺瘤侵袭性行为的发生密切相关,而HRAS能通过直接抑制自噬相关基因Beclin-1的表达,抑制自噬溶酶体的形成,引起细胞自噬性死亡水平降低,导致肿瘤恶性增殖[9-10]。

图3 免疫组化检测HRAS和HMGA1在侵袭性和非侵袭性垂体腺瘤组织中的表达。A:垂体腺瘤组织HE染色(400×);B:垂体腺瘤组织阴性表达(400×);C:侵袭性垂体腺瘤中HRAS阳性表达(400×);D:非侵袭性垂体腺瘤 HRAS阳性表达(400×);E:侵袭性垂体腺瘤中HMGA1阳性表达(400×);非侵袭性垂体腺瘤HMGA1阳性表达(400×)

图4 Western Blot检测HRAS和HMGA1在侵袭性和非侵袭性垂体腺瘤组织中的表达。1、2为侵袭性垂体腺瘤;3、4为非侵袭性垂体腺瘤
高迁移率蛋白家族(HMG)是结构性转录因子,作为细胞核内非组蛋白,通过腺嘌呤-胸腺嘧啶结合元件同富含腺嘌呤-胸腺嘧啶的DNA链小沟结合。HMGA1是HMG家族成员之一,可调控多种基因转录进而参与肿瘤的形成和转移[2]。研究发现,HMGA1抑制可维持上皮的极性和完整性并限制细胞增殖的E-钙粘蛋白表达,E-钙粘蛋白表达减少将导致肿瘤细胞间粘附力丧失,从而引起肿瘤发生侵袭及转移。稳定转染HMGA1基因的NIH3T3细胞克隆,细胞生长增殖速度加快,可诱导正常NIH3T3细胞恶性转化[11]。在来源于低分化、转移性的结肠癌细胞中,敲除HMGA1可明显抑制肿瘤细胞的增殖、迁移、侵袭、肿瘤细胞的移植瘤形成及体内转移[12]。同时,HMGA1是原癌基因HRAS的下游信号分子。Cleynent等[13]将原癌基因Ha-RASLeu61表达载体稳定转染人胚胎肾HEK293细胞株后,qRT-PCR及Western Blot检测到二者的表达均明显升高。应用荧光素酶报告基因分析发现,在HMGA1启动子区域有三个与HRAS致癌作用相关的调节区域,包括两个近端区域(PRR1;-78/-24 bp),(PRR2;+222/+335 bp)及一个远端区域(DRR;-1745/-1161 bp),而将含这些区域的 pIC(-1745/+265)载体及 HRAS 共转染到HEK293细胞后,HMGA1启动子活性增加了15~20倍。在本实验中,HMGA1在侵袭性、非侵袭性垂体腺瘤中的mRNA 表达分别是 1.12±0.20,0.52± 0.19(P<0.05),在组织中阳性表达率分别为20/28和14/32(P<0.05),免疫印迹条带灰度值分别是 0.98±0.12,0.66±0.09(P<0.05)。这些结果提示HMGA1在侵袭性组织中的表达量高于非侵袭性组织。另有研究发现,高水平表达的HMGA1与低水平表达的microRNA-296与前列腺癌的分级分期呈正相关,microRNA-296可促进HMGA1的降解及抑制其转录。给以外源性的microRNA-296可减少其表达水平,从而抑制前列腺癌的增殖及侵袭[14]。在我们前期基因芯片筛选侵袭性及非侵袭性垂体腺瘤差异表达的microRNA基础上[15],应用microRNA靶基因预测软件Tartget Scan预测可调控 HMGA1的 microRNA,发现 microRNA-138不仅与垂体腺瘤侵袭性密切相关而且其机制可能与对HMGA1的负调控作用相关,但仍需后续实验进一步证实。
综上所述,本实验研究结果提示HRAS、HMGA1的高表达与垂体腺瘤的侵袭性生长密切相关。本课题组前期已检测到一些与垂体腺瘤侵袭性行为相关的靶基因,同时应用基因芯片完成了对侵袭性垂体腺瘤及非侵袭性垂体腺瘤中microRNA表达差异谱的筛选。在后期的实验中,我们将从分子水平更深入研究microRNA对前期研究的靶基因的调控与垂体腺瘤侵袭性的关系,以期探讨促进侵袭性垂体腺瘤发生的分子信号的相互作用机制,期待为垂体腺瘤找到有效的干预治疗靶点。
[1]Yong HY,Hwang JS,Son H,et al.Identification of H-Rasspecific motif for the activation of invasive signaling program in human breast epithelial cells[J].Neoplasia,2011,13(2):98-107.
[2]Erasca E,Rnstighi A,Malngnamera R,et al.HMGA1 inhibits the function of p53 family members in thyroid cancer cells[J].Cancer Res,2006,66(6):2980-2989.
[3]Wilson CB.A decade of pituitary microsurgery: The Herbert o-Livercrona lecture[J].Neurosurgery,1984,61(5):814-833.
[4]Gupta S,Ramjaun AR,Haiko P,et al.Binding of RAS to phosph-oinositide 3-kinase p110alpha is required for RAS-driven tumorigenesis in mice[J].Cell,2007,129(5):957-968.
[5]Kim IY,Jeong SJ,Kim ES,et al.Type I collagen-induced pro-MMP-2 activation is differentially regulated by H-RAS and N-RAS in human breast epithelial cells[J]. J Biochemi Mol Biol,2007,40(5):825-831.
[6]Lee KW,Kim MS,Kang NJ,et al.H-RAS selectively upregulates MMP-9 and COX-2 through activation of ERK1/2 and NF-KB:An implication for invasive phenotype in rat liver epithelial cells[J].International Journal of Cancer,2006,119(8):1767-1775.
[7]霍钢,田加坤,唐文渊,等.MMP-2及 CD147在侵袭性垂体腺瘤中的表达及其相互关系的研究[J].中国神经精神疾病杂志,2005,31(3):168-171.
[8]李九州,霍钢,郑履平,等.MMP-9、HPA及CD34在侵袭性垂体腺瘤中表达的研究[J].中国神经精神疾病杂志,2007,33(7):404-407.
[9]冯清林,霍钢,唐茂源,等.侵袭性垂体腺瘤中自噬相关基因Beclin1和MAPLC3的表达[J].中国神经精神疾病杂志,2010,36(8):476-479.
[10]Yoo BH,Wu X,Li Y,et al.Oncogenic RAS-induced downregulation of autophagy mediator beclin-1 is required for malignant transformation of intestinal epithelial cells[J].J Biol Chem,2010,285(8):5438-5449.
[11]张鑫,朱明光,袁红艳,等.HMGA1基因转染诱导NIH3T3细胞恶性转化实验研究[J].中国免疫学杂志,2008,24(5):390-393.
[12]Belton A,Gabrovsky A,Bae YK,et al.HMGA1 induces intestinal polyposis in transgenic mice and drives tumor progression and stem cell propertiesin colon cancer cells[J].PLoS ONE,2012,7(1):e30034.
[13]Cleynen I,Huysmans C,Sasazuki T,et al.Transcriptional control of the human high mobility group A1 gene:basal and oncogenic RAS-regulated expression[J].Cancer Res,2007,67(10):4620-4629.
[14]Wei JJ,Wu XY,Peng Y,et al.Regulation of HMGA1 expression by microRNA-296 affects prostate cancer growth and invasion [J].Clin Cancer Res,2011,17(6):1297-1305.
[15]吴留洋,霍钢,杜安东,等.miRNA在侵袭性垂体腺瘤中表达的初步研究[J].中国神经精神疾病杂志,2011,37(12):752-755.
