GuttaFlow根管充填材料对人牙周膜成纤维细胞的毒性
2012-05-18马忠雄雷丽珊王燕煌
马忠雄,雷丽珊,王燕煌,钟 声
(福建医科大学附属口腔医院,福建 福州 350002)
根管治疗术的目的是严密封闭根管系统,并获得损伤根尖周组织的生物性愈合,因此充填方法和充填材料的选择至关重要。GuttaFlow系统是一种新型的常温流动牙胶根管充填系统,所含纳米级颗粒使其具有良好的流动性和加压触变性,并使根管充填简捷、高效。但良好的流动性势必增加超填风险,超填材料与根尖周组织直接接触,因此材料的生物相容性将直接影响根管治疗术的最终效果[1-2]。本研究采用体外细胞培养技术和四甲基偶氮唑盐(MTT)比色法测定GuttaFlow系统和临床常用的两种根管封闭剂的浸提液对人牙周膜成纤维细胞(periodontal ligament fibroblasts,PDLFs)增殖情况的影响,评估该系统的细胞毒性,以期对其生物安全性进行评价。
1 材料和方法
1.1 材料和仪器
GuttaFlow常温流动牙胶根管充填材料 (Cohene/Whaledent公司,瑞士),AH-Plus根管封闭剂(Densply公司,德国),Endomethasone根管封闭剂(Septodont公司,法国),DMEM 培养液(Gibco公司,美国),胎牛血清(Hyclone公司,美国),CO2培养箱(Heraeus公司,德国),倒置相差显微镜(广州光学仪器厂),生物安全柜(上海力申科学仪器有限公司),酶标仪(Human公司,德国),MTT(Sigma公司,美国)。
1.2 方法
1.2.1 人牙周膜成纤维细胞(PDLFs)体外培养
选择因正畸需要而完整拔除的健康恒牙,拔出后立即置于含抗生素(青霉素100 U/mL,链霉素100 g/mL)的DMEM培养液,超净工作台内刮取根中1/3牙周膜,采用组织块法,在饱和湿度、50 mL/L CO2、950 mL/L空气、37℃标准环境下孵育。倒置显微镜下严密观察细胞生长状况,待细胞从组织块周围游出并铺满培养板底70%后,胰酶消化,传代,取第4代细胞用于实验。
1.2.2 材料浸提液的制备
取GuttaFlow常温流动牙胶、AH-plus根管封闭剂、Endomethasone根管封闭剂3种实验料,分别按操作说明书调制后,充填于直径5 mm、厚3 mm圆柱状孔模具中,待其充分固化(72 h)后形成统一规格的材料块。然后,分别将各材料块浸入含100 mL/L胎牛血清的DMEM培养液中(材料块的表面积/培养液体积=0.6 cm2/mL),标准环境下浸泡72 h,取各材料浸提液原液滤膜过滤除菌备用。
1.2.3 分组和细胞毒性实验
取对数生长期第4代HPDLFs以3×103密度接种于96孔板,于标准环境下同步化培养24 h后吸弃原培养液,根据不同充填材料将细胞随机分为3大组,每一大组再随机分为6个亚组(4个实验组、1个标准对照组和1个空白对照组)。4个实验组分别加入含相应材料浸提液终末浓度分别为100%、50%、25%和12.5%的 DMEM;标准对照组加入不含材料浸提液的DMEM;空白对照组加入不含细胞的DMEM,置于CO2培养箱中标准环境下继续培养。分别于培养后1、3、5、7 d取出各组细胞(每组复5孔),每孔加入MTT 20 μL孵育4 h,弃孔内液体,加入二甲基亚枫液150 μL孵育10 min,微振荡10 min使结晶充分溶解后,在酶标仪上于492 nm波长下测每孔OD值。按公式计算各组细胞相对增殖率(Relative Growth Rate,RGR)。

1.2.4 毒性评级[3]
采用5级制进行材料细胞毒性分级(Cytoxicity Scale,CTS)(表1)。

表1 材料细胞毒性分级评价标准
1.3 统计学分析
2 结果
2.1 正常牙周膜成纤维细胞形态学观察
倒置显微镜下观察,原代培养约3~7 d细胞从组织块周围游出,放射状生长(图1a)。细胞为典型成纤维样细胞,呈长梭形,胞浆突2~4个,胞体丰满,胞浆均匀,胞核圆形,核仁清晰。约20 d左右PDLFs铺满瓶底70% ~80%,细胞生长旺盛,呈漩涡状、栅栏状排列(图1b)。
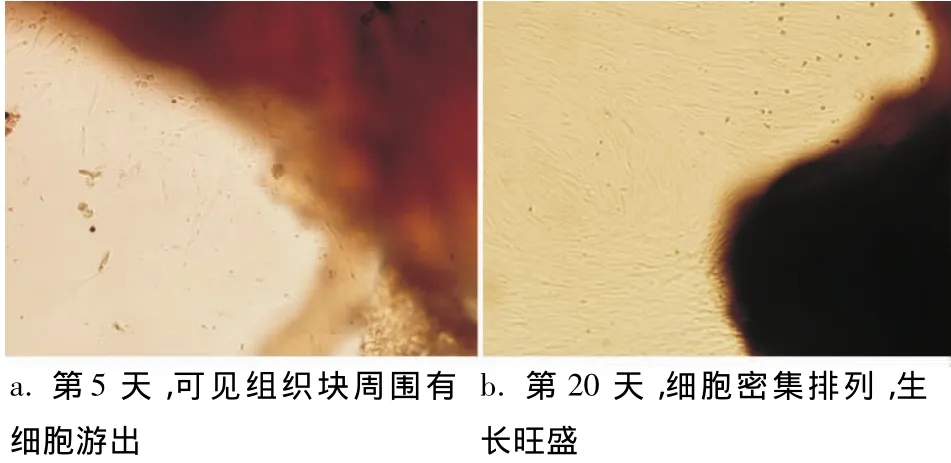
图1 原代培养的人PDLFs(×100)
2.2 细胞毒性实验
2.2.1 各组细胞增殖情况及毒性评级
细胞在100%浓度的浸提液中培养时,对照组、AH-Plus和GuttaFlow组的OD值均随时间延长而不断升高,3组各时间点均无统计学差异(P>0.05)(图2a);而Endomethasone的OD值自第3天开始呈持续下降趋势,与其他3组相比,各时间点差异均有统计学意义(P<0.05)。细胞在50%、25%和12.5%浓度的浸提液中培养时,5 d前各组OD值均呈不断上升趋势,且各组间差异均无统计学意义(P>0.05);此后,对照组、AH-Plus和 GuttaFlow 组OD值仍不断升高,且3组间无统计学差异(P>0.05),而Endomethasone则出现显著下降,与其他3组相比差异均有统计学意义(P<0.05)(图2b~d)。
AH-Plus组和GuttaFlow组在各浓度组各时点的RGR分别为77.1% ~141%和79.8% ~115.9%,毒性评级均为0~Ⅰ级,评价结果为无细胞毒性,且细胞毒性未随时间延长而增强。Endomethasone组在100%浓度浸提液中培养时,第1天RGR为109.2%,毒性评级为0级,评价结果为无细胞毒性;而后随时间延长RGR降至13.6%,毒性评级随之增至Ⅲ~Ⅳ级,评价结果为中度细胞毒性;在50%浓度时,第1天RGR为104.3%,毒性评级为0级,评价结果为无细胞毒性;而后随时间延长RGR降至43.5%,毒性评级增至Ⅲ级,评价结果为中度细胞毒性;在低浓度(25%和12.5%)时的RGR为60.7% ~112.0%,毒性评级随时间由0级增至Ⅱ级,评价结果无细胞毒性至轻度细胞毒性(表2)。
2.2.2 各组细胞形态变化
倒置显微镜下观察,GuttaFlow和AH-Plus组细胞形态未见明显异常;Endomethasone组,当OD值明显降低时,细胞显示出不同的形态学变化。以100%浓度组为例(图3)。
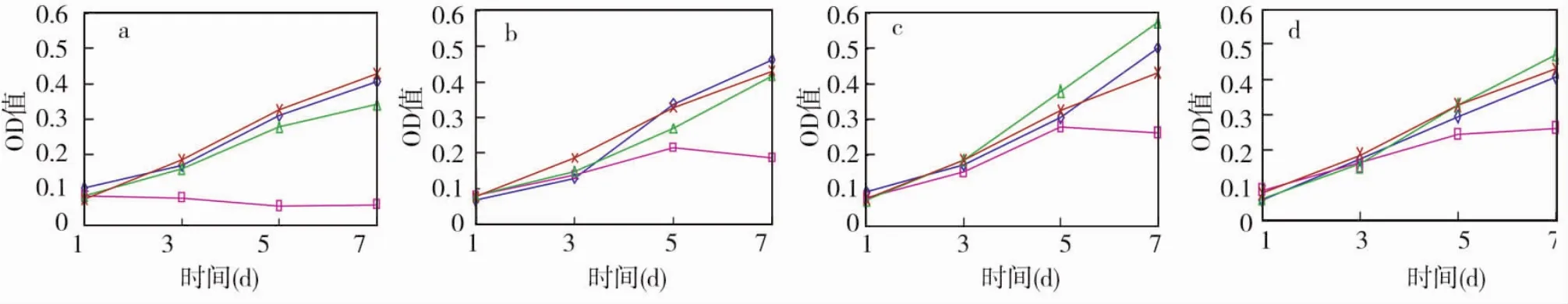
图2 三种材料在不同浓度时的增殖曲线
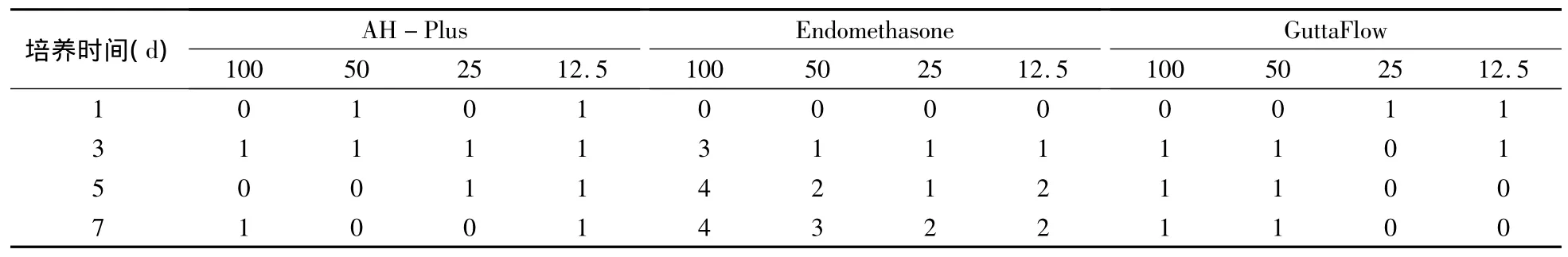
表2 各时间点3种材料不同浓度的毒性评级 (%)

图3 100%浓度时各组细胞形态(×100)
3 讨论
在齿科材料的细胞毒性实验中,细胞对材料的敏感性直接决定了实验结果,越敏感的细胞越能反映材料毒性。目前细胞毒性实验可选用已建株的细胞系或原代培养细胞,原代培养细胞多为正常二倍体细胞,它与转化了的细胞系存在差异,主要表现为有丝分裂速度、密度依赖性生长调节、衰老速度、培养基选择、线粒体功能、可接受的生长物质及热敏感性等方面。由于这些不同,原代培养的正常二倍体细胞对毒性物质的敏感性与转化细胞系存在差异[4],将其用作材料毒性的靶细胞时更接近临床实际,结果也更能反映材料的临床使用效果。
兴起于21世纪初的充填整体化(monoblock)代表着根管治疗术发展的新趋势,其强调改进根管充填的封闭能力,增强牙根抗力的理念已经引起广泛关注[5]。充填整体化指根管充填材料就位固化后与根管形成封闭性能良好、机械性能均一的整体结构。目前常用的冷牙胶侧压充填术和热牙胶充填术均存在一定缺陷,冷牙胶只能发生少量的压缩变形,与根管壁的适合性差,不具流动性,需侧向加压;热牙胶易致高温损伤,冷却收缩易引起微渗漏,需垂直加压等。GuttaFlow常温流动牙胶根管充填系统将含聚二甲基硅氧烷基质的封闭剂与直径<30 μm的牙胶颗粒在体外合二为一,形成在常温下具有流动性的充填材料。当输入根管后通常只需插入一根牙胶尖充填,因此又被称为单核充填技术(single cone obtruation technique)[6]。由于其成分与牙胶尖类似,固化后可与牙胶尖成为一个整体;而聚二甲基硅氧烷特有的触变(thixotropy)特性使其在压力作用下粘性下降,流动性增强,易于进入根管系统的各分支;此外其固化不受温度和湿度的影响,固化后体积不收缩反而有轻微膨胀(0.2%),均有利于达到严密封闭的效果[7-8];同时较少使用侧压,不会对牙根的抗力产生影响[9];又因该系统操作简便、耗时短、技术敏感性低,因此适应了充填整体化的理念,应用前景广阔。但良好的流动性也增加了超填风险,超填材料与根尖周组织直接接触,因此有必要对其生物相容性进行全面、充分的评价。
本实验选用临床上常用的根管封闭剂AHPlus和Endomethasone与Gutta Flow进行细胞毒性比较。AH-Plus为环氧树脂类根管封闭剂,其前身为AH26,目前在冷侧压和热牙胶充填中均得到广泛应用。虽然有研究表明[10-11]新鲜调制的AHPlus显示出对培养细胞的毒性,并指出这可能是由于封闭剂中的少量甲醛、胺和环氧树脂成分的释放所致,但随时间的延长和可滤取成分的减少,这种影响在24 h后基本消退[12],因此通常认为完全固化后的 AH-Plus细胞毒性较小。本结果显示,AH-Plus浸提液对细胞增殖并无明显影响,各浓度组的毒性评级均为0~Ⅰ级,评价结果为无细胞毒性。Endomethasone为氧化锌丁香油类根管封闭剂,其术后病人疼痛反应较小,常用于冷侧压充填中,目前认为其对细胞的刺激性较大。本结果亦显示,较高浓度的Endomethasone浸提液对细胞增殖有抑制作用,具一定的细胞毒性。
本实验中细胞在高浓度GuttaFlow浸提液中的增殖较低浓度组稍差,但差异并无统计学意义。这可能与GuttaFlow中所含纳米银及其浓度有关[13]。纳米银是GuttaFlow系统中的无机抗菌成分,可在根管内持续发挥防腐、杀菌作用。Sjögren等的研究[14]显示,以纳米银为基础的无机抗菌成分会对鼠成纤维细胞L929产生细胞毒性,且随浓度不同细胞毒性也会发生变化。本结果显示,较高浓度GuttaFlow虽对细胞增殖具有一定副作用,但这种作用很小,尚不足以对细胞的增殖产生明显影响,因此细胞在各浓度GuttaFlow浸提液中的增殖均与对照组无明显差异。结合细胞形态的观察,认为完全固化的GuttaFlow对人牙周膜成纤维细胞无细胞毒性,与AH-Plus相当。
在本研究中,较高浓度的Endomethasone浸提液对细胞增殖显示出抑制作用,且随着时间延长,抑制作用愈加显著,甚至可致大多数细胞死亡。这可能与其中含有盐酸氢化可的松和丁香油酚有关。盐酸氢化可的松虽具有抗炎等作用[9],但其对成纤维细胞增殖具有抑制作用,且成明显的剂量依赖性[15];丁香酚的存在有助于增强封闭剂对粪肠球菌等的抗菌作用[16],但丁香酚与细胞黏附力增强的另一结果,就是会进一步影响细胞增殖。因此在高浓度组Endomethasone的毒性评级可达Ⅲ~Ⅳ级。但由于口内实际情况和体外实验存在差异,因此体外实验一般以25%浓度为标准来评价材料的毒性情况。本实验中25%浓度组Endomethasone毒性评级为Ⅰ~Ⅱ级,仅有轻度细胞毒性。
虽然本结果显示,GuttaFlow作为一种新型的常温流动牙胶根管充填系统,对人牙周膜成纤维细胞无细胞毒性,与临床常用的根管封闭剂AH-Plus相当,但体外细胞毒性实验只是检测材料生物相容性的一个方面,对该材料的全面评价还有赖于进一步长期综合评价。
[1]Zielinski TM,Baumgartner JC,Marshall JG.An evaluation of Gutta Flow and gutta-percha in the filling of lateral grooves and depressions[J].J Endod,2008,34(3):295 ~298.
[2]Elayouti A,Achleithner C,Löst C,et al.Homogeneity and adaptation of a new gutta-percha paste to root canal walls[J].J Endod,2005,31(9):687 ~690.
[3]邹兆伟,史福军,黄宗海,等.纳米载银磷酸锆抗菌聚氨酯的细胞毒性检测[J].中国组织工程研究与临床康复,2011,15(38):7149~7152.
[4]郝建军,史俊南.牙科材料的细胞毒性试验[J].牙体牙髓牙周病学杂志,1997,7(2):135 ~137.
[5]彭萌,陈建洪.根管充填新趋势:充填整体化[J].中华口腔医学研究杂志(电子版),2011,5(1):100~105.
[6]李金华,张雄,马长柏,等.车针转速对GuttaFlow根管充填后微渗漏的影响[J].口腔医学,2010,30(7):410~412.
[7]Eldeniz AU,Ørstavik D.A laboratory assessment of coronal bacterial leakage in root canal filled with new and conventional sealers[J].Int Endod J,2009,42(4):303 ~312.
[8]周海燕,宋光泰.常温流动牙胶根管充填系统Gutta-Flow[J].口腔医学研究,2008,24(6):703 ~704.
[9]李艳,赵今.GuttaFlow常温流动牙胶根管充填系统的研究进展[J].牙体牙髓牙周病学杂志,2009,19(2):115 ~117.
[10]王津,姬爱平.常温流动牙胶根管充填效果的临床评价[J].上海口腔医学,2009,18(4):380 ~382.
[11]Mileti'c I,Ani'c I,Karlovi'c Z,et al.Cytotoxic effect of four root filling materials[J].Endod Dent Traumatol,2000,16(6):287-290.
[12]Mileti'c I,Devci'c N,Ani'c I,et al.The cytotoxicty of RoekoSeal and AH plus compared during differentsetting periods[J].J Endod,2005,31(4):307 ~309.
[13]Lodiene G,Morisbak E,Bruzell E,et al.Toxicity evaluation of root canal sealers in vitro[J].Int Endod J,2008,41(1):72 ~77.
[14]Eldeniz AU,Mustafa K,Ørstavik D,et al.Cytotoxicity of new resin,calcium hydroxide and silicone-based root canal sealers on fibroblasts derived from human gingiva and L929 cell lines[J].Int Endod J,2007,40(5):329 ~337.
[15]Sjögren U,Sundqvist G,Nair PN.Tissue reaction to gutta-percha particles of various size when implanted subcutaneously in guinea pigs[J].Eur J Oral Sci,1995,103(5):313 ~321.
[16]卫俊霞,冯光珍,孙红,等.氢化可的松对体外培养的皮肤成纤维细胞增殖及胶原合成的影响[J].第四军医大学学报,2004,25(19):1785 ~1787.
[17]Bodrumlu E,Semiz M.Antibacterial activity of a new endodontic sealer against Enterococcus faecalis[J].J Can Dent Assoc,2006,72(7):637(a~c).
