IL-1β对人牙周膜成纤维细胞OPG、RANKL mRNA表达的影响
2012-05-18孙琳琳宋健玲
张 兰,孙琳琳,丁 岩,宋健玲
(1.西安交通大学口腔医院,陕西 西安 710004;2.市口腔医院,陕西 宝鸡 721001;3.市精神卫生中心口腔科,江苏 无锡 214000)
牙周病的牙周组织病损主要以牙槽骨吸收为特点,骨保护素(osteoprotgerin,OPG)以及核因子κB受体活化剂配体(receptor activator of NF-κB ligand,RANKL)是破骨细胞形成的必要条件,是骨代谢的最终效应因子,在调节骨质吸收中发挥着重要作用[1]。机体通过调节OPG和RANKL合成的比例来调节破骨细胞的形成和活化,以达到骨吸收的动态平衡,决定骨代谢的方向[2]。
人牙周膜成纤维细胞(human periodontal ligament fibroblasts,HPDLF)是牙周组织最重要的细胞成分,在牙槽骨的改建过程中有重要的作用,很长一段时间人们只注意到成骨细胞、破骨细胞对牙周组织中牙槽骨改建的影响,而忽视了HPDLF的作用。目前认为OPG和RANKL能在HPDLF表达,众多因素正是通过改变 HPDLF中 OPG和RANKL的合成,从而间接调节破骨细胞的分化和成熟[3]。
牙周病时机体释放多种细胞因子通过影响OPG和RANKL的表达来影响骨的吸收,研究证实白细胞介素 -1β(interleukin-1β,IL-1β)是介导牙周炎症的主要细胞因子,在牙周病的发生、发展中发挥重要的作用[4]。本研究通过模拟生理及病理条件下不同的IL-1β浓度,采用半定量反转录聚合酶链反应(reverse transcription polymerase china reaction,RT-PCR)检测IL-1β干预HPDLF后,OPG、RANKL mRNA表达量的变化,进一步探讨牙周病时IL-1β是如何通过调节OPG、RANKL的变化来导致牙槽骨吸收的机制,为OPG在临床上有效治疗牙周病造成的骨质吸收提供理论指导。
1 材料和方法
1.1 主要材料和试剂
rhIL-1β(Peprotech公司,美国);胰蛋白酶、氨卞青霉素、硫酸链霉素 (Sigama公司,美国);胎牛血清(天津灏阳公司);RT-PCR试剂盒、Biozol、Bio Marker I(杭州博日公司);低糖DMEM干粉(Gibco公司,美国);SP免疫组化试剂盒、DAB显色试剂盒、波形蛋白单克隆抗体、角蛋白单克隆抗体(武汉博士德公司)。
1.2 HPDLF的原代培养及鉴定
采用组织块法进行 HPDLF的原代培养[5]。选择12~18岁志愿者因正畸治疗需要新鲜拔除的健康前磨牙,立即用无菌D-Hanks液(氨卞青霉素200 μg/mL,硫酸链霉素200 μg/mL)反复冲洗牙冠和牙根表面后,移入含DMEM培养液(不含FBS)的培养皿中,用无菌手术刀片刮取牙根中1/3的牙周膜组织并用眼科剪剪碎,然后将含有组织块的DMEM培养液移入15 mL离心管,1 200 r/min离心5 min,弃去上清液,加入适量含200mL/L FBS的DMEM培养液,吹打混匀后,再移入预先铺有一层半干 FBS的培养瓶中,倒置于 CO2培养箱(50 mL/L CO2、37℃、饱和湿度)中培养。4 h后,向培养瓶中补加2 mL含200 mL/L FBS的DMEM培养液,小心轻轻翻转培养瓶(勿让组织块漂起)继续培养。每2~3 d更换一次含200 mL/L FBS的DMEM培养液,待细胞贴壁生长并铺满瓶底约60%~80%时进行传代。取生长良好的第5代HPDLF,以104/mL的细胞密度接种于12孔培养板中的盖玻片上,待细胞融合达60% ~70%时,取出盖玻片,HE染色观察细胞形态;免疫组化SP法波形丝蛋白、角蛋白染色鉴定细胞来源。
1.3 IL-1β 对 HPDLF OPG、RANKLmRNA 表达的影响
1.3.1 实验分组和干预处理
取生长良好的第5代HPDLF,以5.0×105/mL的密度接种于6只25 mL玻璃培养瓶中,加入含100 mL/L FBS的DMEM培养液,置CO2培养箱中培养。待细胞充分贴壁并生长达80%汇合时,换用无血清的DMEM继续培养24 h使细胞同步化后,弃原培养液,将细胞随机分为6组,分别加入含IL-1β 终末浓度为0 ng/mL(对照组)、0.01 ng/mL(1 组)、0.1 ng/mL(2 组)、1 ng/mL(3 组)、10 ng/mL(4组)、100 ng/mL(5组)的DMEM培养液,继续培养24 h。
1.3.2 RT-PCR 检测
1.3.2.1 HPDLF 总 RNA 的提取和鉴定
选用BIOZOL常规提取HPDLF的总RNA,在15 g/L琼脂糖凝胶中电泳(恒压80 V,电泳缓冲液为1×TAE)30 min后,用凝胶成像系统观察电泳结果。然后取溶解后的总RNA5 μL RNA+95 μL RNase free H2O,在紫外分光光度计上分别读取260 nm、280 nm的吸光度(OD)值。OD(260)/OD(280)≈2,说明所提取的HPDLF总RNA质量较好,纯度较高。
1.3.2.2 引物的设计与合成
用Premier 5.0引物设计软件设计人 OPG、RANKL、β-actin的引物,经GeneBank检索引物序列及位点,并分析核实后,由北京三博远志生物技术有限责任公司合成(表1)。

表1 引物序列
1.3.2.3 反转录合成 cDNA
操作在冰浴(4℃)下进行,在PCR管中分别加5 ×RT Buffer 2.0 μL、dNTP Mixture(10 mmol/L)1.0μL、Random Hexamer Primer 0.5 μL、RNase inhibitor(40 U/μL)0.5 μL、AMV Reverse Transcriptase0.5 μL、实验样品 RNA 2.5 μL、RNase free H2O 3.0 μL 组成总体积 10 μL 体系,瞬时离心数秒,置于PCR扩增仪上进行反转录合成cDNA。反应条件:25℃ 10 min、50℃ 45 min(逆转录反应)、95℃ 5 min(灭活逆转录酶)、4℃ 5 min。
1.3.2.4 PCR 反应
配制PCR反应液:10×PCR Buffer(含Mg2+)2.5 μL、dNTP Mixture(10 mmol/L)0.5 μL、上游特异性引物(5 μmol/L)0.5 μL、下游特异性引物(5 μmol/L)0.5 μL、Taq mix DNA polymerase 0.5 μL、RT 产物 2.5 μL、dd H2O 18 μL,总体积 25 μL。进行PCR反应:94℃预变性3 min后开始循环,94℃变性30 s→55℃或58℃退火30 s→72℃延长1 min,扩增35个循环,最后72℃延伸5 min。退火温度:OPG 55℃;RANKL 58℃;β-actin 55℃。
1.3.2.5 琼脂糖凝胶电泳
向PCR产物(25 μL)中加入6×Loadding Buffer 5 μL,振荡器上混匀。按照顺序加入Bio Maker Ι和PCR产物各5 μL于凝胶孔中,电压80 V条件下电泳50 min后,置于紫外透射仪下,采用Dolphin-1D凝胶成像分析系统扫描、分析各条带光密度值。以各组样本OPG、RANKL目的基因条带与β-actin参照基因条带像素值之比作为OPG、RANKLmRNA表达的相对含量。
1.4 统计学分析
2 结果
2.1 HPDLF 的鉴定
2.1.1 形态学观察
细胞爬片HE染色后光镜观察可见细胞呈长梭形、有长短不一的数个突起;胞体丰满、胞浆呈粉红色着色;单核居中,呈圆形或椭圆形、蓝紫色着色、有2~3个核仁;细胞排列呈栅栏状、旋涡状、放射状(图1)。
2.1.2 免疫组化SP法染色
细胞爬片免疫组化SP法进行波形蛋白、角蛋白染色后光镜下可见,细胞波形蛋白染色阳性,细胞胞浆呈棕黄色(图2);角蛋白染色阴性,细胞胞浆未呈现棕黄色(图3),结合取材部位及细胞形态观察,证实所培养的细胞为HPDLF。

图1 HE染色(×200)

图2 波形丝蛋白染色阳性(×200)

图3 角蛋白染色阴性(×200)
2.2 HPDLF总RNA的检测
所提取的HPDLF总RNA在15 g/L琼脂糖凝胶中电泳后,凝胶成像系统观察可见有两条完整清晰的RNA电泳条带,即28 S和18 S,且28 S条带的亮度和宽度约为18 S条带的两倍,表明所提取的总RNA完整性很好(图4)。
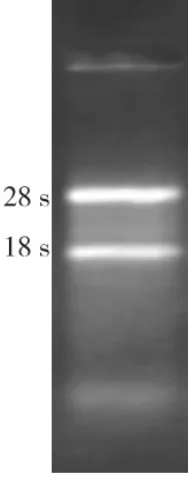
图4 总RNA电泳图
2.3 IL-1β 对 HPDLF、OPG、RANKL mRNA 表达的影响
OPG、RANKL、β-actin的扩增产物分别为342 bp、442 bp、179 bp(图5)。

图5 IL-1β干预HPDLF后各组β-actin、OPG、RANKL的电泳图
2.3.1 不同浓度 IL-1β 对 HPDLF中 OPG mRNA的表达的影响
IL-1β在0.01~10 ng/mL浓度范围内均能明显上调HPDLF中OPG mRNA的表达,各浓度组与对照组相比均有显著差异(P<0.05),其中0.1 ng/mL组上调作用最强,除与1 ng/mL组相比无统计学差异(P>0.05)外,与其他各组相比差异均有统计学意义(P <0.05)。此后,随着IL-1β浓度的增加,OPG mRNA的表达量逐渐减少,100 ng/mL时与对照组已无统计学差异(P>0.05)(表2)。
2.3.2 不同浓度IL-1β 对HPDLF中RANKL mRNA的表达的影响
IL-1β在0.01~100 ng/mL浓度范围内均能明显上调HPDLF中RANKL mRNA的表达,各浓度组与对照组相比差异均有统计学意义(P<0.05),而且上调作用呈浓度依赖性,即随着IL-1β浓度的增加,RANKL mRNA的表达量也逐渐增加。各浓度组两两比较除10 ng/mL与100 ng/mL相比无显著性差异(P>0.05)外,其余各组间差异均有统计学意义(P <0.05)(表2)。
2.3.3 不同浓度 IL-1β 对 HPDLF中 RANKL/OPG mRNA比值的影响
除0.01 ng/mL IL-1β 组RANKL/OPG mRNA的比值与对照组(0 ng/mL)无统计学差异(P>0.05),0.1~100 ng/mL浓度范围内均能明显上调RANKL/OPG mRNA比值,各组与对照组相比均有显著差异(P<0.05),而且上调作用呈浓度依赖性,即随着IL-1β浓度升高,RANKL/OPG mRNA比值也逐渐增加。各浓度组两两比较,除10 ng/mL与100 ng/mL相比无统计学差异(P>0.05)外,其余各组间差异均有统计学意义(P <0.05)(表2)。
表2 各组OPG、RANKL mRNA表达量及RANKL/OPG mRNA比值的比较()

表2 各组OPG、RANKL mRNA表达量及RANKL/OPG mRNA比值的比较()
不同字母组间P<0.05
OPG RANKL RANKL/OPG对照组(0 ng/mL) 0.799 ±0.050A 0.467 ±0.031A 0.590 ±0.032组别A 1 组(0.01 ng/mL) 0.888 ±0.054BC 0.576 ±0.040B 0.642 ± 0.043B 2 组(0.1 ng/mL) 0.968 ±0.025D 0.738 ±0.033C 0.782 ± 0.038C 3 组(1 ng/mL) 0.925 ±0.047BD 0.862 ±0.039D 0.928 ±0.028D 4 组(10 ng/mL) 0.882 ±0.053BE 0.959 ±0.025E 1.128 ±0.033E 5 组(100 ng/mL) 0.835 ±0.046ACE 1.014 ±0.093E 1.182 ±0.026E
3 讨论
OPG的主要功能是抑制破骨细胞的分化,抑制成熟破骨细胞的骨吸收活性并诱导其凋亡。OPG基因缺陷的小鼠中,由于破骨细胞的动员和激活亢进而引起骨吸收增加,造成严重的骨密度减低,骨质表现出严重的多孔性、脆性和易骨折性,似人类的骨质疏松症[6]。核因子-κB受体活化剂配体(RANKL)是骨吸收的关键因子,除能直接诱导破骨细胞分化和发育并参与破骨细胞功能调节外,还可通过增强破骨细胞的运动能力,以及抑制破骨细胞的凋亡来间接促进其骨吸收功能。RANKL基因敲除的小鼠会表现出严重的骨硬化、牙齿萌出异常和破骨细胞缺失[7]。机体可通过调节RANKL和OPG合成的比例来调节破骨细胞的形成和活化,使骨吸收处于动态的平衡。
牙周组织表达OPG、RANKL,并受体内外多种因素的调控,可通过增加或减少OPG、RANKL的表达来调控口腔局部骨组织的代谢[8]。HPDLF是牙周组织中最重要的细胞成分,在维持牙周组织的完整性、保持牙周组织改建平衡中发挥着重要作用。研究表明,在生理状态下,HPDLF中OPG的表达明显高于RANKL的表达,不利于破骨细胞的生成和活化,以维持牙周内环境的稳定;而在牙周病时,OPG、RANKL表达的相对水平发生改变,RANKL表达的相对水平较OPG升高,从而诱导破骨细胞的分化和成熟,导致牙周组织的破坏[9]。OPG、RANKL表达量的变化与破骨细胞性骨吸收密切相关,对生理性和病理性牙周组织的改变起着非常重要的作用。HPDLF可通过调节OPG和RANKL的表达影响破骨细胞的生成和活化,大多数细胞因子通过改变HPDLF中OPG和RANKL的合成,从而间接调节破骨细胞的分化和成熟。
IL-1β是破骨细胞性骨吸收强有力的细胞因子,也是作用强大的炎性介质,其多种生物学效应与牙周组织的破坏直接相关,在牙周病的发生、发展中具有重要作用。体外研究表明,在牙周病的病变过程中,菌斑细菌及代谢产物与宿主之间相互作用,导致牙周组织局部IL-1β过量表达,造成牙周组织破坏[4]。牙周病病人龈沟液(gingival crevicular fluid,GCF)和牙周组织中IL-1β的含量也明显高于健康对照组,且与病变程度呈正相关[10]。
Sakata等研究表明,IL-1β(0~3 ng/mL)呈剂量依赖性上调HPDLF中OPG的表达,0.01 ng/mL的IL-1β可影响OPG的合成,并在0.1 ng/mL时OPG的合成达到最大水平[11]。Hormdee等研究发现,IL-1(10 ng/mL)能够显著增加 HPDLF中RANKL mRNA的表达,同时也能增加OPG mRNA的表达,但IL-1对RANKL mRNA的作用更强[12]。本实验表明,IL-1β能上调HPDLF中OPG mRNA的表达,但这种作用不呈剂量依赖性。在0.1 ng/mL时上调作用达到最大,此后,随着IL-1β浓度的增加OPG mRNA表达量逐渐减少,100 ng/mL时与对照组无显著性差异。另一方面,IL-1β呈剂量依赖性上调HPDLF中RANKL mRNA的表达,0.01 ng/mL的 IL-1β可上调 RANKL mRNA的表达,在100 ng/mL时达到最大。提示,在牙周炎早期HPDLF中OPG的表达增加,可抑制骨吸收,但随着炎症加重既IL-1β量的升高,OPG的量逐渐减少,RANKL的量逐渐增加,造成牙槽骨的快速吸收,牙周病变加重。其原因可能是:当 IL-1β作用于HPDLF时,与HPDLF表面的IL-1受体相结合从而活化蛋白激酶A和蛋白激酶C途径,激活的蛋白激酶A促进RANKL表达,蛋白激酶C则促进OPG的表达;与此同时IL-1β还使HPDLF合成前列腺素 E2(prostaglandin E2,PGE2)增加,PGE2间接促进HPDLF中RANKL的表达,抑制OPG的表达。IL-1β通过两种相反的机制调节HPDLF中OPG的表达:IL-1β直接在转录和翻译前水平增加OPG的表达;与此同时,又通过从头合成 PGE2抑制OPG mRNA的表达,促进RANKL的表达,IL-1β可同时增加PGE2和OPG的合成,但是对PGE2的作用更有效[11]。故在本实验浓度范围内低浓度的IL-1β可以促进OPG mRNA的表达,而高浓度时反而抑制OPG mRNA的表达。且与OPG的表达相比,IL-1β对HPDLF中RANKL的作用更强。IL-1β正是通过改变HPDLF中OPG和RANKL的合成,使RANKL/OPG比率失调,从而间接调节破骨细胞的分化和成熟,使骨吸收大于骨形成,牙槽骨发生破坏。
本结果还提示,牙周病时随着炎症的加重和IL-1β含量相应增加,OPG逐渐下降,RNAKL逐渐上升,而造成牙槽骨的持续破坏,如果能提高牙槽骨局部的OPG浓度,可有效减少牙槽骨的吸收,防止牙周病的进一步加重。有动物实验表明,补充OPG,可预防卵巢切除术后大鼠骨质疏松的发生;给患有关节炎的小鼠局部注射OPG后,虽然炎症仍存在,但能完全阻止骨量的减少[13]。Bekker等在临床上首次使用OPG治疗绝经后的骨质疏松病人,证实OPG可有效地抑制骨转化[14]。Mahamed等发现OPG可显著减少在糖尿病小鼠中局部接种伴放线放线杆菌而引起的牙槽骨丧失,并使RANKL的表达显著降低[15]。由此证明OPG对骨质的吸收有一定的治疗意义。
[1]Katagiri T,Takahashi N.Regulatory mechanisms of osteoblast and osteoclast differentiation [J].Oral Dis,2002,8(3):147-159.
[2]Lee SK,Lorenzo JA.Parathyroid hormone stimulates TRANCE and inhibits osteoprotegerin messenger ribonucleic acid expression in murine bone marrow cultures:correlation with osteoclastlike cell formation[J].Endocrino,1999,140(8):3552-3561.
[3]Hasegawa T,Yoshimura Y,Kikuiri T,et al.Expression of receptor activator of NF-kappa B ligand and osteoprotegerin in culture of human periodontal ligament cells[J].J Periodontal Res,2002,37(6):405-411.
[4]Graves DT,Coehrna D.The contribution of inierlekuin-1 and tumor necrosis factor to periodontal tissue destruction[J].J Periodontol,2003,74(3):391-401.
[5]司徒镇强,吴军正.细胞培养[M].北京:世界图书出版公司北京公司,2004:58-100.
[6]Bucay N,Sarosi I,Dunstan CR,et al.OPG-deficientmice develop early onset osteoporosis and arterial calcification [J].Genes Dev,1998,12(9):1260-1268.
[7]Dougall WC,Glaccum M,Charrier K,et al.RANK is essential for osteoclast and lymph node development[J].Genes Dev,1999,13(18):2412-2424.
[8]Nakao K,Goto T,Gunjigake KK,et al.Intermittent force induces high RANKL expression in human periodontal ligament cells[J].J Dent Res,2007,86(7):623-628.
[9]Crotti T,Smith MD,Hirsch R,et al.Receptor activator NF-κB ligand(RANKL)and osteoprotegerin(OPG)protein expression in periodontitis[J].J Periodontal Res,2003,38(4):380-387.
[10]DeLaurier A,Allen S,DeFlnadre C,et al.Cytokine expression in resorptive feline osteoclastic lesions [J].J Comp Pathol,2002,127(2-3):169-177.
[11]Sakata M,Shiba H,Komatsuzawa H,et al.Osteoprotegerin levels increased by interleukin-1 beta in human periodontal ligament cells are suppressed through prostaglandin E-2 synthesized de novo[J].Cytokine,2002,18(3):133-139.
[12]Hormdee D,Nagasawa T,Kiji M,et al.Protein kinase-A-dependent osteoprotegerin production on interleukin-1 stimulation in human gingival fibroblasts is distinct from periodontal ligament fibroblasts[J].Clin and Exp Immunol,2005,142(3):490-497.
[13]Bolon B,Carter C,Daris M,et al.Adenoviral delivery of osteoprotegerin ameliorates bone resorption in a mouse ovariectomy model of osteoporosis[J].Mol Ther,2001,3(2):197-205.
[14]Bekker PJ,Holloway D,Nakanishi A,et al.The effect of a single dose of osteoprotegerin in postmenopausal woman[J].J Bone Miner Res,2001,16(2):348-360.
[15]Mahamed DA,Marleau A,Alnaeeli M,et al.G(-)anaerobes-reactive CD4(+)T-cells trigger RANKL-mediated enhanced alveolar bone loss in diabetic NOD mice[J].Diabetes,2005,54(5):1477-1486.
