血小板裂解液对人根尖牙乳头干细胞和牙周膜干细胞体内外增殖、矿化能力的影响
2012-05-18王捍国穆云静刘向辉
白 玉,陈 博,,王捍国,穆云静,孔 辉,刘向辉,余 擎
(1.第四军医大学口腔医学院,陕西 西安 710032;2.解放军八一医院口腔科,江苏 南京 210001;3.解放军309医院旃坛寺门诊部,北京 100034)
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新、多向分化能力的干细胞,其作为组织工程和组织再生领域极具应用前景的种子细胞来源,受到了越来越广泛的关注。在口腔医学领域,诸如骨髓间充质干细胞(BMMSCs)、脂肪干细胞(ADSCs)、脐血干细胞(UCBSCs)以及牙源性干细胞[1]等多种间充质干细胞已经被有效分离、培养,并应用于牙齿组织工程相关研究,其中牙源性干细胞最具优势。牙源性干细胞主要包括牙髓干细胞(DPSCs)、脱落乳牙干细胞(SHED)、牙周膜干细胞(PDLSCs)[2]和近期分离自未发育完成恒牙根尖乳头的根尖牙乳头干细胞(Stem cells from the apical papilla,SCAP)[3]。研究发现 SCAP是牙根部成牙本质细胞和根部牙髓细胞的重要来源,对根部牙本质形成和发育起关键作用[4],而PDLSCs则已被证明对牙根骨质、牙周膜和牙槽骨等牙周组织的生长发育起重要作用,这两种细胞植入免疫缺陷鼠体内可分别形成牙本质牙髓样复合体和牙骨质 -牙周膜样结构[2-3],预示着其在牙根、牙周组织工程和组织再生领域的应用前景。干细胞的迁移、增殖、分化等过程需要多种生长因子参与调控,此前已有诸多使用血小板裂解液(platelet lysate,PL)培养间充质干细胞 MSCs的报道[5-8],近期的研究更证实富血小板血浆(platelet rich plasma,PRP)[9]或 PL[10]能够促进 DPSCs 或PDLSCs等牙源性干细胞的增殖和分化。本研究分离培养同一组个体来源的SCAP和PDLSCs,通过比较一定浓度的PL对在不同生长模式下干细胞增殖、矿化能力等生物学的影响,以期找到PL应用于牙根组织工程种子细胞的适宜方式,为日后的基础研究和临床应用提供参考依据。
1 材料和方法
1.1 主要材料和仪器
改良型α-MEM培养基和胎牛血清(FBS,HYCLONE,美国);胰蛋白酶(Gbico,美国);HA-TCP(四川大学生物工程材料研究中心);抗坏血酸、地塞米松、β-甘油磷酸钠、Alizarin Red S、Oil Red O(Sigma,美国);肝素钠 (Roche,瑞士);SABC试剂盒(北京中杉金桥);鼠抗人Vimentin(武汉博士德);CD24多克隆抗体、FITC二抗(R&D,美国);鼠抗人 STRO-1-APC、CD29-PE、CD34-PE、CD44-FITC、CD45-PE、CD90-PE、CD105-FITC、CD146-PE(BIOLEGEND,美国);自动CO2培养箱(HERA cell,德国);倒置显微镜(LEICA,德国);流式细胞仪(BD,美国);扫描电镜(HITACHI S3400N,日本)。
1.2 SCAP和PDLSCs两种干细胞的分离、培养、纯化和鉴定
收集15~20岁志愿者(知情同意)因正畸需要而完整拔除的未发育完全的新鲜健康第三磨牙,用含双抗的无血清α-MEM培养基反复冲洗后,无菌条件下先后分离根尖牙乳头,刮取根中1/3部位的牙周膜组织,采用组织块法分离获得原代细胞,以含200 mL/L胎牛血清、50 μg/mL抗坏血酸、2 mmol/L谷胺酰胺、100 U/mL 青霉素、100 μg/mL链霉素的α-MEM培养基培养于37℃、50 mL/L CO2孵箱中。每2~3 d更换1次培养液,待细胞生长汇合后以胰蛋白酶(2 g/L胰蛋白酶加0.2 g/L EDTA)消化收集细胞,按1∶3传代。取对数生长期的P1代细胞以有限稀释法获得单细胞克隆,待克隆长至96孔板孔底80%后,取多个克隆培养的细胞胰酶消化混合,扩大培养。收集P3代相同个体来源的SCAP和PDLSCs,经免疫细胞化学染色和流式细胞仪检测 Vimentin、STRO-1、CD24、CD29、CD34、CD44、CD45、CD90、CD105、CD146 等特定抗原的表达;同时对细胞成脂、矿化诱导后,分别行Oil Red O染色及Alizarin Red S染色,鉴定细胞多向分化能力。
1.3 血小板裂解液的制备
第四军医大学西京医院输血科选取新鲜采集的ACD-A抗凝血小板10人份,参考并改进文献[10-11]的方法,将血小板混匀后以生理盐水重悬,去除血浆等杂质,使血小板浓度达1×109/mL;将所获样本经-80℃与37℃反复冻融3次(每次间隔12 h),使血小板内生长因子充分释放。冻融裂解产物900 g离心30 min取上清即为血小板裂解液,用0.22 μm滤器过滤后分装于无菌EP管内,-80℃冻存备用,使用前37℃水浴融解,以不同体积比加入培养基中。
1.4 PL对SCAP和PDLSCs在体内、外增殖和矿化能力的影响
1.4.1 细胞培养体系
以矿化诱导液(含100 mL/L胎牛血清、50 μg/mL抗坏血酸,10-6mol/L地塞米松、10 mmol/L β-磷酸甘油钠、2 mmol/L谷胺酰胺、100 U/mL青霉素、100 μg/mL链霉素的α-MEM培养基)为基础培养基,按表1以相应体积比加入1.3中所得的PL制成条件培养基,并在培养基中加入2 IU/mL的肝素以防止PL中的凝血因子与培养基中的组分反应生成凝胶[11](表1)。
1.4.2 PL对SCAP和PDLSCs在体外三维培养模式下增殖的影响
取直径5 mm,厚1.5 mm,孔径50 ~300 μm,孔隙率为52%的HA-TCP支架材料,经高温高压灭菌后浸泡于FBS内置4℃冰箱过夜,取出后于超净台内室温干燥备用。参考文献报道方法[12],收集P4至P5代相同个体来源的SCAP和PDLSCs,分别制成3×106/mL的细胞悬液后分装于离心管内,并于每1.5 mL细胞悬液内浸入10片HA-TCP支架材料,置摇床上在37℃、50 mL/L CO2环境内以70 r/min振荡摇晃2 h,待细胞均匀接种粘附后,小心取出支架材料置24孔板内,每孔一片,随机分为3组,分别按表1所示加入相应的培养体系,连续培养28 d,每2 d换液1次,分别于培养的第1、7、14、21、28 天取出各组样本,0.01 mol PBS洗3遍,25 mL/L戊二醛固定,乙醇梯度脱水,临界点干燥,喷金,扫描电镜观察。
1.4.3 PL对SCAP和PDLSCs体内移植模式下增殖、分化的影响
参考并改进文献报道方法[13-14],收集 P4至P5代相同个体来源的SCAP和 PDLSCs,分别以5×105/皿的密度接种于6 cm直径培养皿内,待细胞贴壁并生长至融合后,随机分为3组,分别按表1所示加入相应的培养体系,于37℃、50 mL/L CO2孵箱中培养,每2 d换液1次,连续培养14 d后分别将各组所形成的SCAP和PDLSCs细胞膜片完整刮下并移入另一培养皿,再重复该步骤两次以获得3张细胞膜片,小心重叠后包裹于经FBS预湿的HA-TCP支架材料表面。然后取6~8周龄雌性裸鼠,在腹腔注射麻醉下,将上述经细胞膜片包裹的HA-TCP支架材料植入裸鼠背部皮下。常规饲养8周后取材,40 g/L多聚甲醛固定,EDTA脱钙2周,环氧树脂包埋后切片,行Van Gieson染色,光学显微镜下观察。
2 结果
2.1 SCAP和PDLSCs的分离、纯化和鉴定
原代SCAP和PDLSCs细胞在1~3 d内爬出组织块,细胞体积较小,多数为成纤维样细胞,其中SCAP呈梭形或多角形(图1a);PDLSCs呈均一的细长梭形(图1b)。克隆化培养并传至第3代的SCAP和PDLSCs经流式细胞仪检测(图2)和免疫细胞化学染色(图3a,d,e)显示所获得细胞在细胞表型上符合SCAP或PDLSCs的特征。成脂诱导5周,倒置相差显微镜观察,可见细胞Oil Red O脂滴染色阳性(图3b,f);矿化诱导4周,茜素红染色后,镜下可见矿化结节形成(图3c,g)。
2.2 PL对SCAP和PDLSCs复合HA-TCP支架材料体外三维培养模式下增殖的影响
扫描电镜低倍视野(图4Ⅰ,Ⅱ)可见在整个培养周期内,除了对照组的PDLSCs外,其余各处理组细胞均能随培养时间的延长逐渐在HA-TCP支架材料表面和孔隙间形成较为连续完整的细胞膜片样结构。SCAP各处理组间(图4Ⅰ),在培养初期(1~7 d),细胞膜片的面积和完整度呈现50 mL/L PL组>10 mL/L PL组>对照组的规律,提示50 mL/L PL组细胞生长情况优于10 mL/L PL组和对照组;在培养中后期(14~28 d),因各组样本表面均为细胞膜片完全覆盖,故未观察到明显差异。PDLSCs各处理组间(图4Ⅱ),在整个培养周期的各时间点,细胞膜片的面积和完整度均显示50 mL/L PL组>10 mL/L PL组>对照组,提示PL对PDLSCs的促增殖效应更具浓度相关性。
高倍视野(图4Ⅲ,Ⅳ)下可见:各处理组SCAP和PDLSCs均能良好的粘附于HA-TCP支架材料表面,伸展充分(图4Ⅲ A~C;Ⅳ A~C)。SCAP各处理组(图4Ⅲ)从7 d开始细胞均生长密集至融合,进入复层生长状态,50 mL/L PL组和10 mL/L PL组均观察到有明显的矿化细胞外基质形成,随着培养时间的延长,对照组从21 d开始也观察到形成矿化细胞外基质,但是少于同时期的50 mL/L PL组及10 mL/L PL组,提示了 PL对SCAP的促进矿化作用。PDLSCs各处理组(图4Ⅳ)在7 d时细胞仍围绕孔隙或跨孔隙交错生长,未进入复层生长状态,但50 mL/L PL组及10 mL/L PL组已可观察到有明显的矿化细胞外基质形成;直至14 d时50 mL/L PL组及10 mL/L PL组细胞方进入复层生长状态,而同期的对照组细胞仍保持培养初期的生长状态;在培养中后期(14~28 d),相对于对照组,50 mL/L PL组及10 mL/L PL组样本能够观察到更多的矿化细胞外基质,提示了 PL对PDLSCs同样具有促进矿化的效应。
2.3 PL对SCAP和PDLSCs体内移植模式下异位生成硬组织能力的影响
组织学观察显示(图5),裸鼠体内移植8周后,经50 mL/L PL及10 mL/L PL体系预刺激的SCAP样本(图5A~B)在HA-TCP支架材料表面和孔隙间形成了牙本质牙髓复合体样结构,可观察到牙本质样基质(d)、成牙本质细胞样细胞(od)和牙髓样组织(Pulp),而且50 mL/L PL组形成的牙本质样基质的连续性和矿化程度均高于10 mL/L PL组;而在对照组(图5C),HA-TCP支架材料表面和孔隙内可观察到成骨细胞(ob)及矿化程度较高的新生骨组织(b)。经50 mL/L PL体系预刺激的PDLSCs样本(图5D)可观察到新生的牙骨质样基质(C)、成牙骨质细胞样细胞(CB)和牙周膜样组织(PDL);而10 mL/L PL组(图5E)观察到的是成骨细胞(ob)及矿化程度较高的新生骨组织(b);在对照组(图5F)除了观察到条索状的纤维结缔样组织外,未发现明显的新生硬组织。提示在体外预刺激后体内移植的模式下,PL对于SCAP和PDLSCs的干预效应具有特定的浓度相关性。
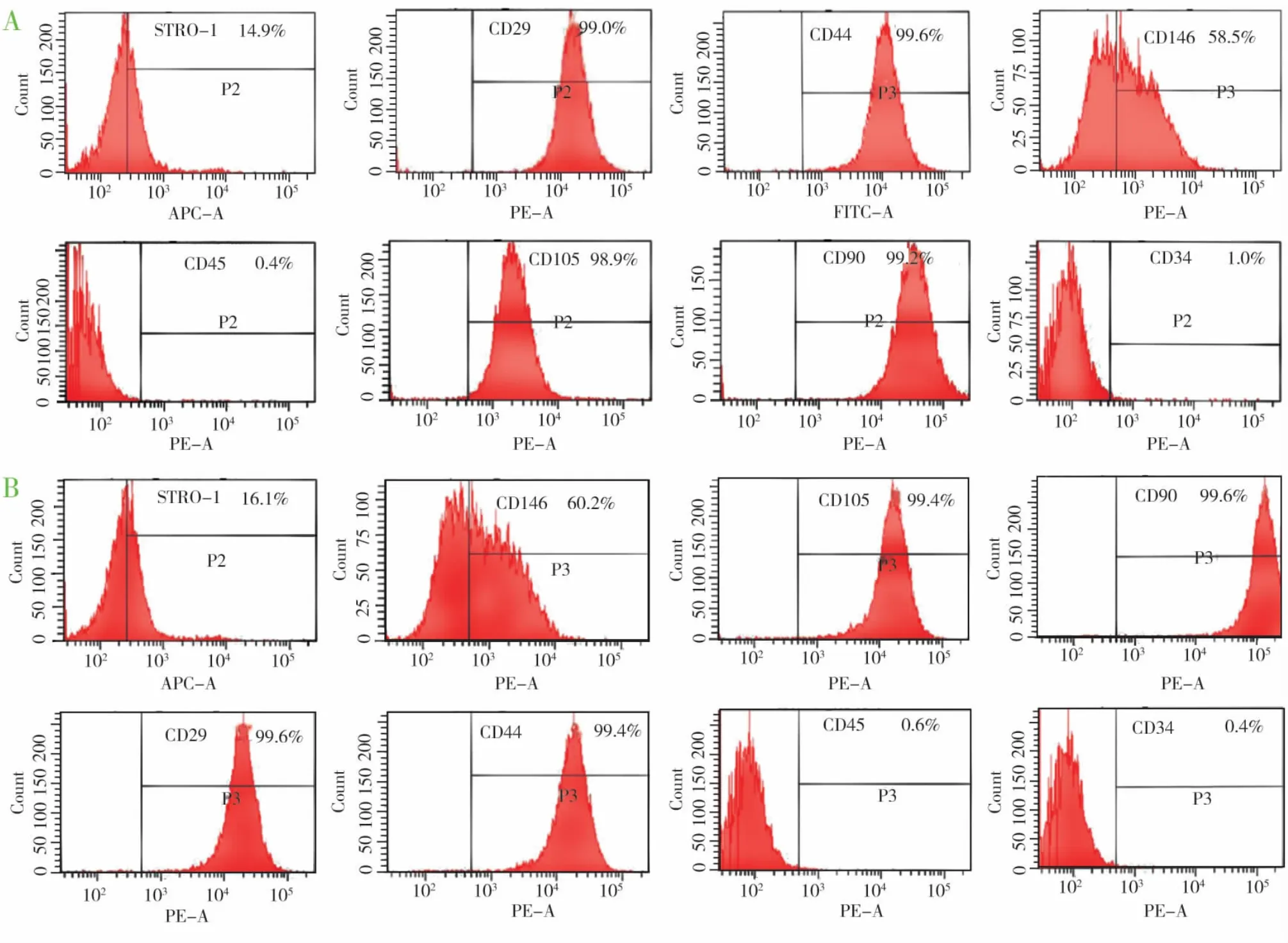
图2 流式细胞仪分析细胞的表面抗原特征表型,P2,P3表示抗原阳性区域(A为SCAP;B为PDLSCs)

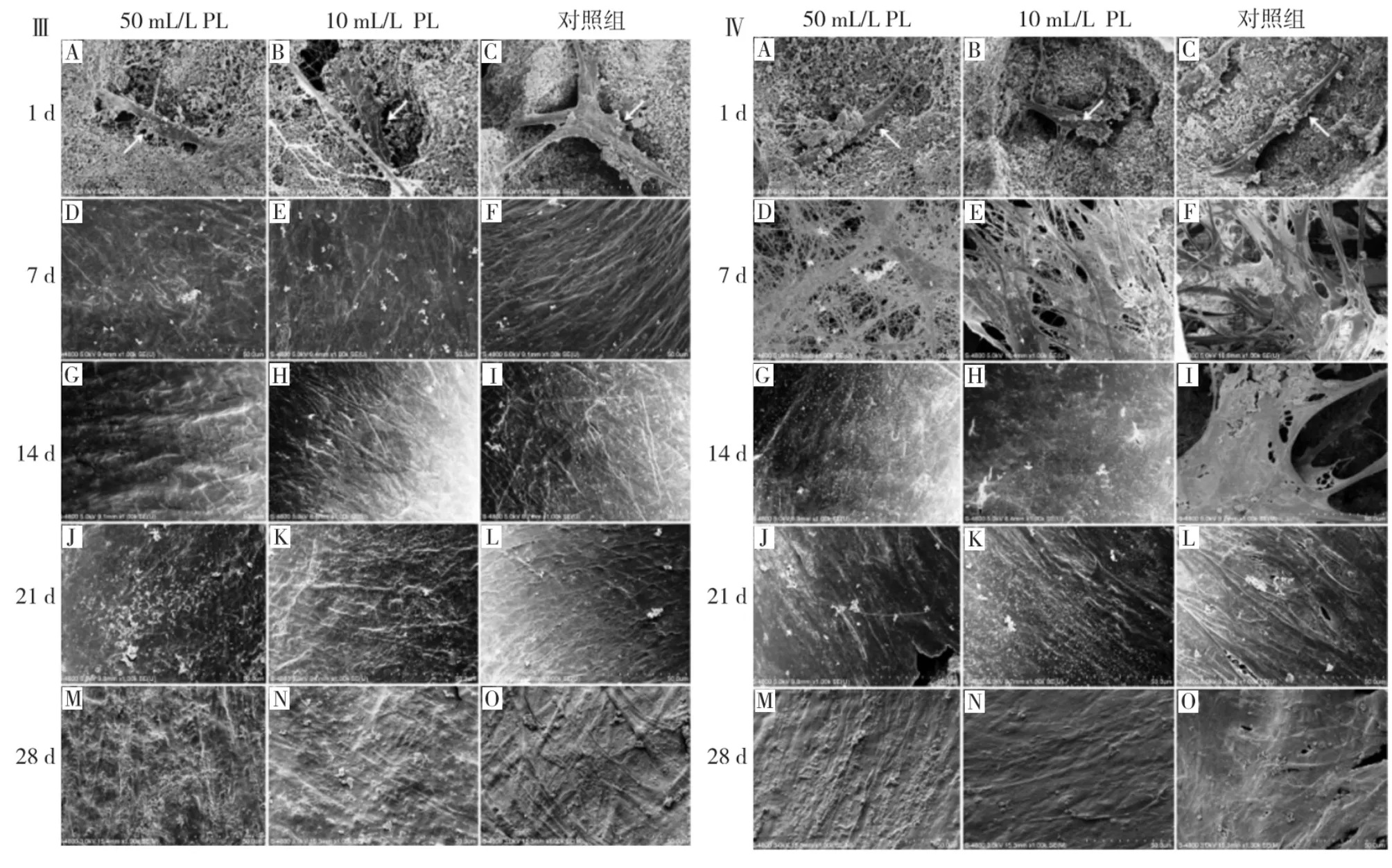
图4 扫描电镜观察SCAP及PDLSCs生长于HA-TCP支架材料上第1、7、14、21、28天的情况

图5 组织学观察各组样本植入裸鼠背部皮下8周后的情况(Van Gieson染色,×100)
3 讨论
自我更新和多向分化能力是干细胞的重要特征及突出优势,但干细胞的这些能力并不是无限的。由于受目前研究技术水平所限,在体外分离、长期大规模培养和应用干细胞的过程中尚不能复制出与体内完全一致的微环境,有可能对干细胞造成各种不利影响,从而使其自我更新及分化能力发生变化甚至逐渐丧失。同时,由于干细胞分化的多向性及其调控机制的复杂性,即使能够为其营造出定向分化的环境,比如矿化诱导培养体系,可是一旦细胞脱离该环境比如移植进入体内后,就无法很好地对其施加持续的、多因素联动的分化调控,从而无法保证干细胞一定会向目标细胞分化。虽然目前针对以上问题已进行了诸多研究并取得了一定的进展,但是这些技术手段在实际应用中存在着诸如花费昂贵,操作不便等缺点。因此,考虑建立一种在大规模扩增的同时,亦能维持干细胞特性的培养条件就显得非常必要。
血小板富集物应用于干细胞培养或临床治疗的尝试目前已获得了生物学理论和大量基础研究成果的支持[9,15]。但仅通过评价血小板富集物在干细胞增殖及促进组织愈合再生方面的作用,尚不能确定其所有的相关机制[19,15-18]。加之目前已报道的各种血小板富集物提取方法差别较大,无法形成规范化的标准流程,所采用的动物模型标准也不一致,更增加了我们从中归纳出较可靠结论的难度。但可以确定的是:研究过程中生长因子的种类、剂量和干预方式起着至关重要的作用[19]。牙源性干细胞分化由诸多与成骨相关的因素调控,包括TGF-β家族成员和其他多种生长因子[20-22]。PL是血小板富集物经细胞裂解后的产物,其去除了残余细胞结构,降低了免疫原性,保留了其中的多种液态生长因子如 PDGF、TGF-β、FGF、EGF 和正常 T 细胞表达和分泌增强调节因子等,而这些生长因子均被证实能促进骨的再生修复[23-24]。
牙的生长发育也受参与其中的干细胞种类和分化能力的调控,分离自未发育完成恒牙根尖乳头的根尖牙乳头干细胞(SCAP)和牙周韧带组织的牙周膜干细胞(PDLSCs)同为间充质来源干细胞,被认为与牙根相关组织生长发育和再生密切相关。目前已有诸多分别针对这两种细胞的研究,但是将SCAP和PDLSCs置于同一研究模型内进行比较尚属探索阶段。有鉴于仅仅应用血小板富集物尚无法启动牙源性干细胞的矿化[9],本研究立足矿化诱导的微环境,利用体外接种HA-TCP支架材料三维培养和动物体内移植的实验模型,通过引入PL作为生长因子来源,以期促进SCAP及PDLSCs体内外增殖和成骨-成牙本质定向分化,达到增强组织再生和修复能力的目标。本研究发现:在连续4周的体外三维培养模式下,PL能促进SCAP和PDLSCs的增殖、矿化细胞外基质形成,并有助于在支架材料上形成完整细胞膜片(cell sheet)样结构。这提示在体外矿化诱导的微环境内,PL的参与更能保持三维生长条件下SCAP和PDLSCs持续自我更新特性,同时增强其矿化能力。利用体外先期持续刺激后再植入体内的模式,观察到经50 mL/L PL、10 mL/L PL培养体系干预的SCAP能形成了包含成牙本质细胞样细胞、牙本质样基质和牙髓组织的牙髓牙本质复合体样结构;相较对照组仅形成矿化骨样基质,经PL处理组显然更符合牙体组织再生的应用目标。同样,PDLSCs经50 mL/L PL先期刺激后植入体内可分化为成牙骨质细胞样细胞,并生成牙骨质样基质和牙周膜样组织,从而更贴近牙周组织再生要求。以上结果提示,一定体积浓度比的 PL在 SCAP和PDLSCs体内外增殖、定向分化中可能起到促进作用,在牙组织工程领域具有良好的应用前景。
[1]Huang GTJ,Gronthos S,Shi S.Mesenchymal stem cells derived from dental tissues vs.those from other sources:their biology and role in regenerative medicine [J].J Dent Res,2009,88(9):792-806.
[2]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[3]Sonoyama W,Liu Y,Yamaza T,et al.Characterization of the apical papilla and its residing stem cells from human immature permanent teeth:a pilot study [J].J Endodont,2008,34(2):166-171.
[4]Banchs F,Trope M.Revascularization of immature permanent teeth with apical periodontitis:new treatment protocol?[J]J Endod,2004,30(4):196-200.
[5]Doucet C,Ernou I,Zhang Y,et al.Platelet lysates promote mesenchymal stem cell expansion:a safety substitute for animal serum in cell-based therapy applications [J].J Cell Physiol,2005,205(2):228-236.
[6]Schallmoser K,Bartmann C,Rohde E,et al.Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells [J].Transfusion,2007,47(8):1436-1446.
[7]Bieback K,Hecker A,Kocaömer A,et al.Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow [J].Stem Cells,2009,27(9):2331-2341.
[8]Capelli C,Gotti E,Morigi M,et al.Minimally manipulated whole human umbilical cord is a rich source of clinical-grade human mesenchymal stromal cells expanded in human platelet lysate[J].Cytotherapy,2011,13(7):786-801.
[9]Lee UL,Jeon SH,Park JY,et al.Effect of platelet-rich plasma on dental stem cells derived from human impacted third molars[J].Regen Med,2011,6(1):67-79.
[10]Govindasamy V,Ronald VS,Abdullah AN,et al.Human platelet lysate permits scale-up of dental pulp stromal cells for clinical applications[J].Cytotherapy,2011,13(10):1221-1233.
[11]Müller AM,Davenport M,Verrier S,et al.Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue[J].Tissue Eng Part A,2009,15(4):869-875.
[12]Zhang W,Walboomers XF,van Kuppevelt TH,et al.The performance of human dental pulp stem cells on different three-dimensional scaffold materials [J].Biomat,2006,27(33):5658-5668.
[13]Iwata T,Yamato M,Tsuchioka H,et al.Periodontal regeneration with multi-layered periodontal ligament-derived cell sheets in a canine model[J].Biomat,2009,30(14):2716-2723.
[14]Tsumanuma Y,Iwata T,Washio K,et al.Comparison of different tissue-derived stem cell sheets for periodontal regeneration in a canine 1-wall defect model[J].Biomat,2011,32(25):5819-5825.
[15]El Backly R,Ulivi V,Tonachini L,et al.Platelet lysate induces in vitro wound healing of human keratinocytes associated with a strong proinflammatory response[J].Tissue Eng Part A,2011,17(13-14):1787-1800.
[16]Intini G.The use of platelet-rich plasma in bone reconstruction therapy[J].Biomat,2009,30(28):4956-4966.
[17]Chen FM,Zhang J,Zhang M,et al.A review on endogenous regenerative technology in periodontal regenerative medicine[J].Biomat,2010,31(31):7892-7927.
[18]Chen FM,Zhang M,Wu ZF.Toward delivery of multiple growth factors in tissue engineering [J].Biomat,2010,31(24):6279-6308.
[19]Ferreira CF,Carriel Gomes MC,Filho JS,et al.Platelet-rich plasma influence on human osteoblasts growth[J].Clin Oral Implants Res,2005,16(4):456-460.
[20]Kettunen P,Karavanova I,Thesleff I.Responsiveness of developing dental tissues to fibroblast growth factors:expression of splicing alternatives of FGFR1,-2,-3,and of FGFR4;and stimulation of cell proliferation by FGF-2,-4,-8,and-9[J].Dev Genet,1998,22(4):374-385.
[21]Shiba H,Fujita T,Doi N,et al.Differential effects of various growth factors and cytokines on the syntheses of DNA,type I collagen,laminin,fibronectin,osteonectin/secreted protein,acidic and rich in cysteine(SPARC),and alkaline phosphatase by human pulp cells in culture[J].J Cell Physiol,1998,174(2):194-205.
[22]Onishi T,Kinoshita S,Shintani S,et al.Stimulation of proliferation and differentiation of dog dental pulp cells in serum-free culture medium by insulin-like growth factor[J].Arch Oral Biol,1999,44(2):361-371.
[23]Schilephake H.Bone growth factors in maxillofacial skeletal reconstruction[J].Int J Oral Maxillofac Surg,2002,31(5):469-484.
[24]Marx RE,Carlson ER,Eichstaedt RM,et al.Platelet-rich plasma:growth factor enhancement for bone grafts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85(6):638-646.
