雷公藤多苷对糖尿病肾病大鼠肾组织转化生长因子β1、骨形成蛋白7及Gremlin表达的影响
2012-05-10常保超陈卫东
张 燕 常保超 陈卫东
目前,糖尿病肾病(DN)导致慢性肾衰竭已十分常见,其病理改变多表现为弥漫性肾小球硬化、肾小球结节性硬化,肾间质纤维化等。与肾小球病变相比,肾间质纤维化更能反映肾功能减退的程度,决定患者预后[1]。转化生长因子 β1(TGF-β1)是重要的促纤维化因子,拮抗TGF-β1的抗纤维化因子骨形成蛋白 7(BMP-7)及 BMP-7的内源性拮抗剂Gremlin在体内失衡是引起肾间质纤维化的重要机制。雷公藤多苷(TW)因具有独特的抗炎作用被应用于临床治疗DN,但其是否具有抗纤维化作用研究较少。本研究通过高糖高脂饮食,并以链脲佐菌素腹腔注射建立DN大鼠模型,观察肾组织损伤过程中 TGF-β1、BMP-7 及 Gremlin 的表达变化,进一步了解DN肾间质纤维化的机制,应用TW进行干预治疗,以探讨其在防治肾间质纤维化的作用。
对象与方法
实验动物与分组 清洁级雄性SD大鼠40只,体重180~200g(购自蚌埠医学院实验动物中心),随机分为实验组(30只)及对照组(10只),适应性喂养1周,测鼠重进入实验。造模组予以高糖高脂饲料喂养4周后,腹腔注射40 mg/kg链脲佐菌素;对照组予以基础饲料喂养,腹腔注射枸橡酸盐缓冲液。72h后采血测血糖,随机血糖≥16.7 mmol/L为造模成功。将成功造模的26只大鼠随机分为DN组13只,每日以生理盐水灌胃;TW治疗组13只,每日以TW 50 mg/(kg·d)灌胃,用药16周。
主要试剂 兔抗大鼠TGF-β1多克隆抗体、兔抗大鼠BMP-7多克隆抗体、兔抗大鼠Gremlin多克隆抗体、羊抗兔二抗均购自北京奥博森生物技术有限公司。Trizol、逆转录酶、引物均购自上海生物工程公司。TW片剂由上海药业有限公司生产。
观察方法
一般情况 每天观察各组大鼠精神、饮食、饮水、皮毛色泽及活动情况。
尿蛋白定量及尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG) 在造模前及造模后第2、4、8、16周测量鼠重,并将大鼠放入代谢笼中,禁食、自由饮水,收集24h尿。免疫比浊法测定24h尿蛋白定量,用分光光度法测量尿NAG。
血清生化、肾组织的采集及检验 16周处死动物,处死时心脏采血3 ml用于生化检验。取血后,摘取肾脏,右肾生理盐水洗去血迹后称重,液氮速冻后-80℃冰箱保存备用。左肾放入10%中性甲醛中固定备检。氧化酶法测定血糖,采取自动生化分析仪测定血清白蛋白(Alb)、肌酐(SCr)、尿素氮(BUN)。
肾组织病理检查 (1)组织学:将10%中性甲醛固定的肾组织石蜡包埋的常规组织切片,HE染色,观察肾组织病理变化。肾间质纤维化定量分析借助HMIAS-2000高清彩色病理报告分析系统,每个标本在光镜200倍视野下分别观察10个不含肾小球的皮质视野。计算纤维化面积占整个视野的百分比。肾间质浸润的炎症细胞计数在400倍光镜下,每张切片随机选择10个不含肾小球的视野,计数肾间质内浸润的炎症细胞(单核巨噬细胞、淋巴细胞、中性粒细胞),结果以(炎症细胞数/高倍视野×400)表示[2]。(2)免疫组织化学染色:常规脱蜡,3%H2O2处理,微波修复抗原后滴加封闭液,滴加兔抗大鼠TGF-β1多克隆抗体、兔抗大鼠 BMP-7多克隆抗体、兔抗大鼠Gremlin多克隆抗体。次日加生物素化,山羊抗兔IG在37℃孵育30 min,加SABC工作液,DAB显色,苏木素复染。阴性对照组以PBS缓冲液代替一抗。每个标本随机抽取10个高倍视野下,计算阳性细胞的百分比。
肾组织 TGF-β1、BMP-7、Gremlin 核酸表达 以RT-PCR 检测 TGF-β1、BMP-7、Gremlin 核酸表达。取各组大鼠肾皮质0.1g,用TRIzol抽提总RNA,紫外分光光度计测定总RNA的浓度及纯度(A260/280值在 180~200之间)。取 5 μg总 RNA,按照M-MLV Reverse Transcriptuse试剂盒说明书进行逆转录合成CDNA,取适量CDNA在PCR扩增仪上进行扩增,反应总体积为50 μl。MNCBI的Nucleotide中查得目的基因和内参照基因,采取Primer Express Sofware设计,由上海生物工程公司合成。
TGF-β1:上游 5'-GCCTGAGTGGCTGTCTTTTGA-3',下游 '5'-GAAGCGAAAGCCCTGTATTCC-3'。扩增产物长度242 bp;扩增条件为94℃度预变性2 min,94℃变性 30s,54℃退火 30s,72℃延伸 40s,经 30 个循环后,72℃再延伸8 min。
BMP-7:上游 5'GTAGCGCGTAGAGCCG-3',下游'5'-CGAGTCCGTGCATGG-3'。扩 增 产 物 长 度 345 bp,扩增条件为94℃度预变性2 min,94℃变性30s,57.1℃退火30s 72℃延伸40s,经35个循环后72℃再延伸8 min。
Gremlin:上游 5'-AGGTTCCCAAGGAGCCATTC-3',下游 '5'-GATATGCAACGGCACTGCTT-3'。扩增产物长度275 bp,扩增条件为94℃度预变性2 min,94℃变性 30s,61℃退火 30s,72℃延伸 40s,经 30 个循环后72℃再延伸8 min。
内参 GAPDH:上游 5'-GAGAGGGAAATCGTGCG TGAC-3',下 游 '5'-CATCTGCTGGAAGGTGGACA-3'。扩增产物长度453 bp,扩增条件为94℃度预变性2 min,94℃变性30s,57.1℃退火30s,72℃延伸40s,经30个循环后72℃再延伸8 min。
取PCR产物5 μl与上样缓冲液充分混匀后,于5%琼脂糖凝胶电泳,紫外线透射检测仪上,在紫外灯下照相,再以Labworks软件进行光密度扫描。以甘油醛-3-磷酸脱氢酶(GAPDH)密度作为参考值标准对照,比值表示核酸相对表达量。
肾组织 TGF-β1、BMP-7、Gremlin 蛋白表达 以Western blotting 检测肾组织 TGF-β1、BMP-7、Gremlin蛋白表达,将肾组织加入裂解液中,提取总蛋白后,测定蛋白浓度。蛋白样本在100℃变性5 min,各取样本20 μl,进行 SDS-PAGE 凝胶电泳。电泳结束后,电转移至PVDF膜,在含5%脱脂奶粉封闭液中封闭1h。加入兔抗大鼠多克隆抗体TGF-β1(1∶100)、兔抗大鼠多克隆抗体BMP-7(1∶200)和兔抗大鼠多克隆抗体Gremlin(1∶200),4℃过夜,洗膜后与辣根过氧化物酶标记的羊抗兔IgG(1∶1 000)37℃下孵育1h。取出PVDF膜,置于DAB显色液显色、定影。用凝胶图像分析系统进行电泳条带光密度扫描分析,以靶蛋白条带光密度与内参照条带光密度的比值作为蛋白的各组相对表达量,予以统计分析。
统计学分析 采用SPSS 13.0软件包进行统计学分析,计量资料以(¯x±s)表示,尿蛋白定量和尿NAG在三组间和造模前后不同时间点变化的比较采用两因素多水平重复测量资料的方差分析;其他指标的平均水平及肾组织病理改变在三组间的比较用完全随机设计单因素方差分析,均数间的两两比较采用q检验;采用Pearson直线相关分析肾组织TGF-β1与Gremlin表达的关系。P<0.05表示差异有统计学意义。
结 果
实验组30只大鼠中2只造模失败,2只因血糖过高死亡,共26只进入实验,后因感染死亡3只。最终进入统计分析的大鼠DN组11只,TW组12只,对照组10只。DN模型组大鼠均出现精神萎靡、反应迟钝,食欲下降、体重减轻,毛发杂乱无光泽。TW干预后上述情况有所改善,第16周TW组大鼠体重(416.35±72.26)g与DN组(388.26±53.07)g及对照组(543.23±36.92)g比较均有统计学差异(P<0.05)。
各组大鼠尿蛋白、尿NAG比较 在链脲佐菌素腹腔注射2周后模型组动物尿蛋白增加,至4周达到顶峰,此后一直保持较高水平,两组大鼠尿蛋白变化趋势基本一致,但TW组低于DN组,在第4、8、16周时均有统计学差异(P<0.01)(表1)。DN组及TW组早期出现尿NAG升高,与对照组比较在第2、4、8、16周均有统计学差异;TW组尿NAG水平显著低于DN组(P<0.01)(表2)。
各组生化指标改变见表3,第16周时与正常对照组相比,模型组随机血糖、SCr、BUN明显升高,Alb降低,差异具有统计学意义(P<0.001)。TW组SCr和BUN显著低于DN组(P<0.01),Alb显著高于后组(P<0.01)。
肾组织病理改变 对照组肾小球、肾小管结构正常;DN组肾小球面积和肾小球体积增大,肾小球毛细血管袢基膜增厚,系膜区系膜细胞增多、基质增生,部分大鼠出现局灶肾小球硬化性改变;肾小管上皮细胞浑浊、空泡样变,部分上皮细胞坏死,肾间质炎性细胞浸润,纤维结缔组织增生,局灶性纤维化。TW组较DN组病变轻,部分肾小球毛细血管袢基膜增厚,肾间质炎性细胞浸润及纤维化较少(P<0.01)(表4)。
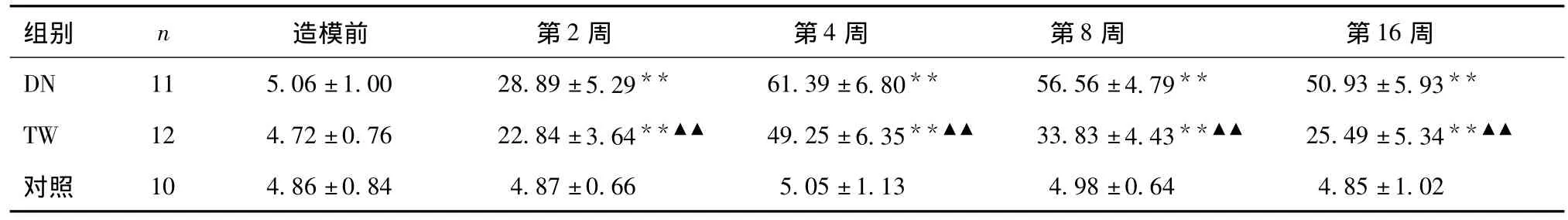
表1 各组大鼠尿蛋白定量(mg/24h)的变化

表2 各组大鼠尿NAG(U/L)变化
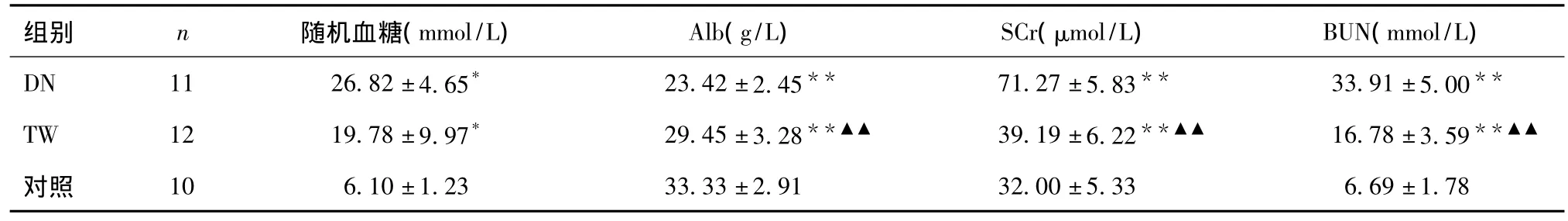
表3 第16周各组实验大鼠血糖生化指标的变化

表4 各组肾组织病理的改变
肾组织 TGF-β1、BMP-7 和 Gremlin 免疫组化及蛋白的表达 16周时,TGF-β1、Gremlin在对照组肾小管有少量表达,均呈胞浆阳性;DN组及TW组肾小管 TGF-β1、Gremlin的表达明显增加(P <0.01)。与DN组比较,TW组的两者表达量下降(P<0.01)。Western blotting法检测肾组织 TGF-β1、Gremlin的蛋白表达也显示同样的变化趋势(P <0.01)(表5、6,图 1、2)。
各组肾组织均有BMP-7表达,主要位于肾小管和集合管,呈胞质表达阳性,DN组及TW组BMP-7的表达低于对照组。与DN组相比,TW组BMP-7表达增多(P<0.01)。Western blotting法检测肾组织BMP-7的蛋白表达,与对照组比较DN组明显下调,TW干预后BMP-7 蛋白增加(P <0.01)(表5、6,图1、2)。
肾组织 TGF-β1、BMP-7 和 Gremlin 的核酸表达与对照组比较,DN组和TW组肾组织TGF-β1和Gremlin核酸表达上调,但 TW组低于 DN组(P<0.01)。与对照组比较,DN组和TW组BMP-7核酸表达下调,但TW组高于DN组(P<0.01)(表7、图 3)。
肾组织TGF-β1与Gremlin表达的关系 两者在免疫组化、核酸和蛋白表达的相关系数r分别为0.898、0.648和0.855,说明两者的表达呈正相关(P <0.01)。

表5 肾组织免疫组化TGF-β1、BMP-7和Gremlin阳性细胞百分比(%)
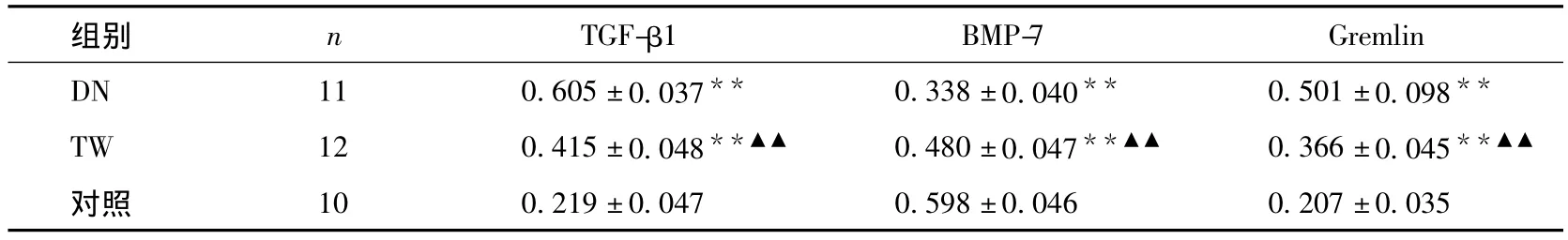
表6 肾组织TGF-β1、BMP-7和Gremlin蛋白的表达
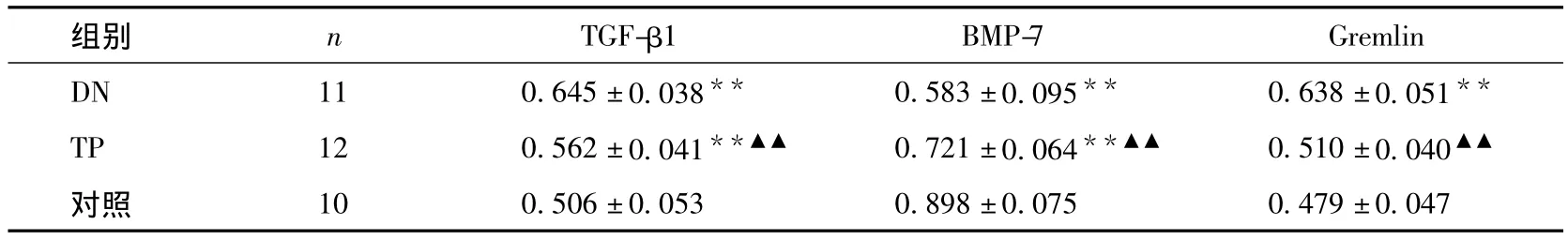
表7 肾组织TGF-β1、BMP-7和Gremlin的核酸表达
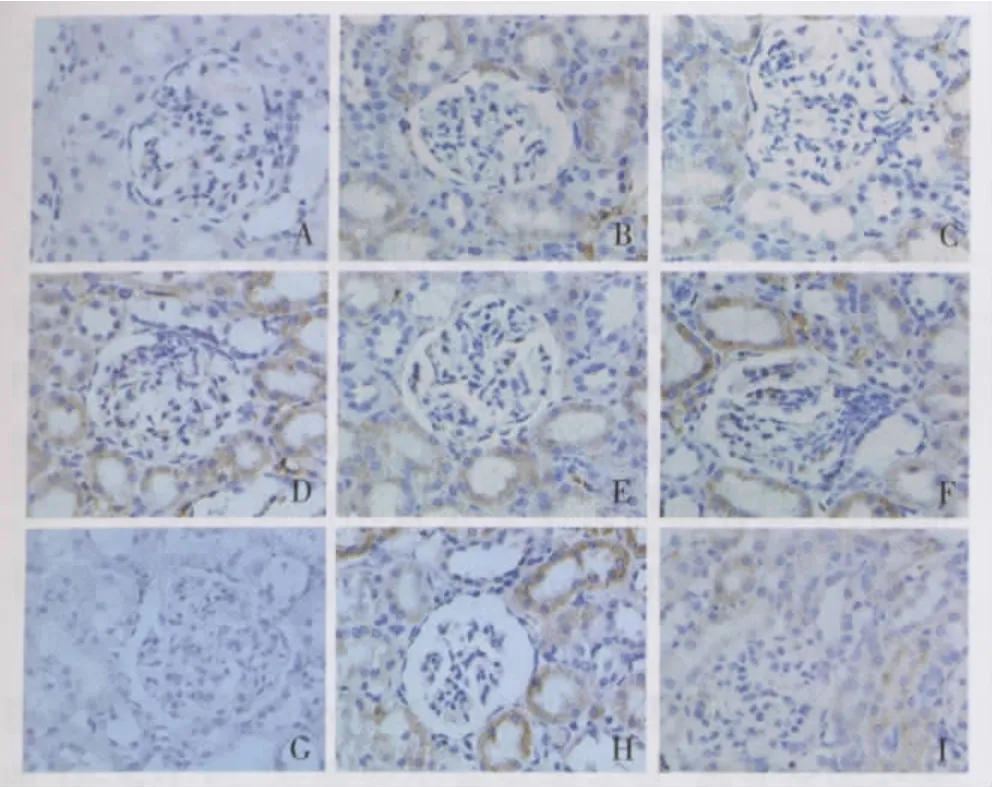
图1 糖尿病肾病组、雷公藤多苷治疗组及对照组大鼠16周肾组织形态学变化及 TGF-β1、BMP-7和Gremlin表达

图2 各组大鼠肾组织 TGF-β1、BMP-7和 Gremlin的蛋白表达
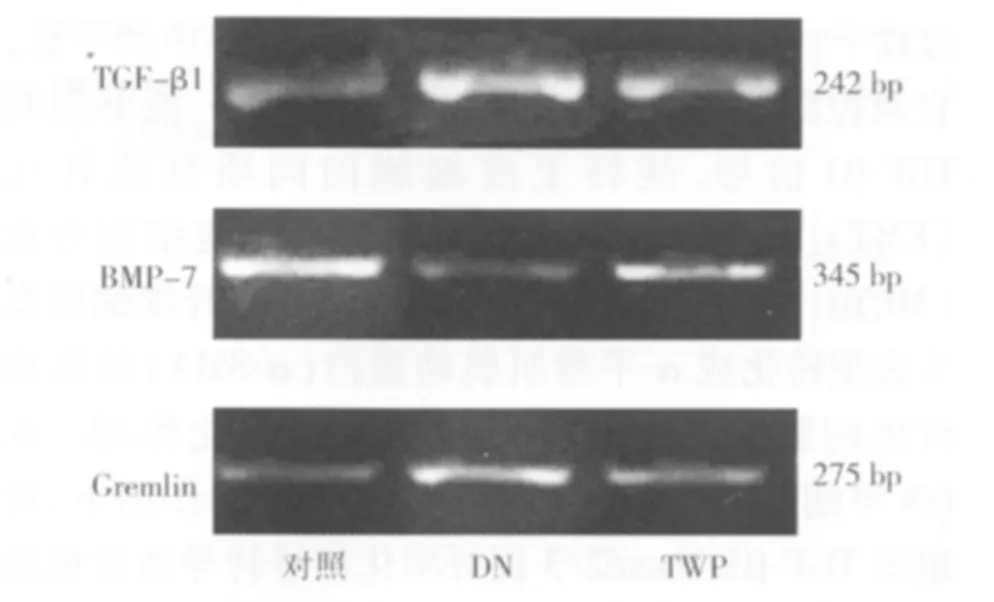
图3 各组大鼠肾组织 TGF-β1、BMP-7和 Gremlin的核酸表达
讨 论
肾间质纤维化是各种慢性肾脏病进展到终末期肾病的共同结果。蛋白尿是DN肾小球损伤的标志,同时也是加重肾脏损害的因素[3]。Morii等[4]研究发现,蛋白尿在肾小管损伤方面发挥了更加重要的作用。进入肾小管中的蛋白质及前免疫介质加重肾小管上皮细胞负荷并促进肾小管上皮细胞释放各种炎症因子、趋化因子[如单核细胞趋化因子1(MCP-1)]等,使肾间质单核/巨噬聚集、导致小管间质炎性反应。刺激原基质成纤维细胞和经上皮间叶转化来的肌纤维细胞增生,肾间质纤维化[5,6]。
本研究发现,DN早期大鼠尿蛋白定量增加,肾小管上皮细胞受损,尿NAG升高,并随病程进展加重,16周时可见肾小管上皮细胞浑浊、空泡样变和坏死,肾间质炎症细胞浸润。既往体外实验证实雷公藤甲素可稳定足细胞的骨架结构,逆转足细胞的损伤,恢复足细胞骨架结构和相关分子的表达,从而减少尿蛋白[7]。雷公藤具有抑制T细胞及B细胞的活化,诱导活化的T细胞、树突细胞凋亡,抑制IL-1α、IL-1β、MCP-1 等炎症因子的合成,抑制肾小管上皮细胞炎症介质的产生等广泛抗炎、抑制免疫作用,本研究中经TW干预后,大鼠尿蛋白明显减少,尿NAG下降,病理显示肾小管损害减轻,炎症细胞浸润减少,说明TW可以减轻尿蛋白,改善肾小管的损伤,抑制炎症,从而改善肾间质纤维化的发生及发展。
细胞因子与DN肾间质纤维化及肾小球硬化密切相关。TGF-β1是纤维化的中心环节,参与成纤维细胞的活化、增生和表型转化及细胞外基质增多的过程[8]。BMP-7是转化生长因子超家族中的一员,它调控细胞的生长、分化、趋化及凋亡。能够阻断TGF-β1信号,逆转上皮细胞向间质细胞转化(EMT)[9],诱导间质成纤维细胞向上皮细胞分化(MET)[10],拮抗 TGF-β1 诱导的间质成纤维细胞发生表型转化成α平滑肌肌动蛋白(α-SMA)的肌成纤维细胞[11],逆转 TGF-β1 的促纤维化作用。在DN早期高糖、尿蛋白、多种细胞因子的作用下,肾组织TGF-β1/Smad2/3促纤维化信号转导途径被激活[12,13],BMP-7 的表达下降,与肾间质纤维化密切相关。外源性重组BMP-7能够改善肾小管间质纤维化,并与剂量正相关[14]。
我们观察16周DN大鼠肾组织TGF-β1的免疫组化、核酸及蛋白表达异常增高,BMP-7的免疫组化、核酸及蛋白表达下降,肾间质纤维结蹄组织增生明显、局灶纤维化。DN发生发展过程中不仅高血糖、高血脂等代谢因素促进肾组织TGF-β1的表达,炎症趋化因子MCP-1使得单核巨噬细胞在局部浸润增生,进一步促进 TGF-β1的高表达[15]。而雷公藤作为一种免疫抑制剂,很低浓度的雷公藤甲素即能抑制脂多糖(LPS)刺激的树突细胞产生MCP-1的生成[16],抑制肾小管上皮细胞的抗原递呈功能[17],抑制肾小管上皮细胞表达MCP-1[18],从而起到减少TGF-β1的产生,基于上述的研究结果,我们采用TW干预。治疗后TGF-β1的免疫组化、核酸及蛋白表达增高趋势被抑制,BMP-7核酸、蛋白增加,肾组织纤维化减轻。说明TWP能够下调TGF-β1表达的调节系统,上调BMP-7的表达,从而改善肾间质纤维化。
BMP-7的肾脏保护作用,不仅取决于其本身,还与其激动剂和拮抗剂之间的复杂平衡有关[19]。TGF-β1和BMP-7在肾纤维化的过程中相互拮抗,但TGF-β1并非 BMP-7受体的配体,本身不调节BMP-7表达及信号传导,而是通过正向调节其下游因子 BMP-7的内源性拮抗剂 Gremlin发挥作用的[20,21]。研究发现Gremlin在 DN 肾组织表达是增加的,并与肾间质纤维化及肾功能减退相关[22,23]。外源性端粒酶抑制Gremlin表达可以减轻肾间质纤维化[24]。
我们还发现,DN肾组织Gremlin的核酸及蛋白表达明显升高,且主要在肾小管表达,与TGF-β1的表达具有正相关性,这说明TGF-β1可以正向调节Gremlin的表达。DN发展过程中过度表达的TGF-β1上调Gremlin的产生,拮抗BMP-7的抗纤维化,而TW抑制TGF-β1的产生,从而下调Gremlin了的表达,改善肾间质纤维化。
综上所述,本研究阐明了TW通过减少蛋白尿、保护肾小管上皮细胞、抑制炎症,下调促纤维化因子TGF-β1及下游因子Gremlin的表达,上调抗纤维化因子BMP-7的表达,从而改善肾间质纤维化。但是,Gremlin并不调节BMP-7的产生,因此TW增加BMP-7表达机制的研究有待进一步完善。
1 Klahr S,Morrissey J,Hruska K,et al.New approaches to delay the progression ofchronic renalfailure.Kidney Int,2002,Suppl(80):23-26.
2 Taal MW,Zandi-Nejad K,Weening B,et al.Proinflammatory gene expression and macrophage recruitment in the rat remnant kidney.Kidney Int,2000,58(4):1664 -1676.
3 徐鹏杰,李 航,徐亚兰,等.2型糖尿病倂发慢性肾脏病临床病理分析.中华肾脏病杂志,2010,26(10):731-735.
4 Morii T,FujitaH,NaritaT,etal. Association ofmonocyte chemoattractant protein-1 with renal tubular damage in diabetic nephropathy.J Diabetes Complications,2003,17(1):11 - 15.
5 Wang Y,Chen J,Chen L,et al.Induction of monocyte chemoattractant protein-1 in proximal tubule cells by urinary protein.J Am Soc Nephrol,1997,8(10):1537 -1545.
6 Donadelli R,Zanchi C,Morigi M,et al.Protein overload induces fractalkine upregulation in proximal tubular cells through nuclear factor kappaB-and p38 mitogen-activated protein kinase-dependent pathways.J Am Soc Nephrol,2003,14(10):2436 - 2446.
7 Zheng CX,Chen ZH,Zeng CH,et al.Triptolide protects podocytes from puromycin aminonucleoside induced injury in vivo and in vitro.Kidney Int,2008,74(5):596 -612.
8 Kelynack KJ,Hewitson TD,Martic M,et al.Lovastatin downregulates renal myofibroblast function in vitro. Nephron, 2002, 91(4):701-707.
9 Yoshikawa M,Hishikawa K,Marumo T,et al.Inhibition of histone deacetylase activity suppresses epithelial-to-mesenchymal transition induced by TGF-beta1 in human renal epithelial cells.J Am Soc Nephrol,2007,18(1):58 -65.
10 Zeisberg M,Shah AA,Kalluri R.Bone morphogenic protein-7 induces mesenchymal to epithelial transition in adult renal fibroblasts and facilitates regeneration of injured kidney.J Biol Chem,2005,280(9):8094-8100.
11 Veerasamy M,Nguyen TQ,Motazed R,et al.Differential regulation of E-cadherin and alpha-smooth muscle actin by BMP 7 in human renal proximal tubule epithelial cells and its implication in renal fibrosis.Am J Physiol Renal Physiol,2009,297(5):F1238 - F1248.
12 张飞飞,谭若云,熊明霞,等.高糖通过转化生长因子β1-Smad信号传导途径诱导肾小管上皮细胞转化.中华肾脏病杂志,2008,24(3):174-178.
13 Liu Y.Renal fibrosis:new insights into the pathogenesis and therapeutics.Kidney Int,2006,69(2):213 - 217.
14 Wang SN,Lapage J,Hirschberg R.Loss of tubular bone morphogenetic protein-7 in diabetic nephropathy.J Am Soc Nephrol,2001,12(11):2392-2399.
15 刘 娜,严海东,李雪竹,等.单核细胞趋化蛋白1在人肾小管细胞分化中的作用及其与转化生长因子表达的关系.中华肾脏病杂志,2008,24(8):586 -587.
16 Liu Q,Chen T,Chen G,et al,Immunosuppressant triptolide inhibits dendritic cell-mediated chemoattraction of neutrophils and T cells through inhibiting Stat3 phosphorylation and NF-kappaB activation.Biochem Biophys Res Commun,2006,345(3):1122 -1130.
17 李 恒,刘志红.雷公藤内酯醇对人肾小管上皮细胞抗原递呈功能的影响.肾脏病与透析肾移植杂志,2001,10(4):303-308.
18 刘志红,戴春笋,李恒,等.雷公藤内酯醇对人近端肾小管上皮细胞单核细胞趋化因子合成的影响.肾脏病与透析肾移植杂志,2000,9(5):431 -435.
19 Yanagita M.Modulator of bone morphogenetic protein activity in the progression of kidney diseases.Kidney Int.2006,70(6):989 -993.
20 Tardif G,Hum D,Pelletier JP,et al.Differential gene expression and regulation of the bone morphogenetic protein antagonists follistatin and gremlin in normal and osteoarthritic human chondrocytes and synovial fibroblasts.Arthritis Rheum,2004,50(8):2521 -2530.
21 Kane R,Stevenson L,Godson C,et al.Gremlin gene expression in bovine retinal pericytes exposed to elevated glucose.Br J Ophthalmol,2005,89(12):1638 -1642.
22 McMahon R,Murphy M,Clarkson M,et al.IHG-2,a mesangial cell gene induced by high glucose,is human gremlin.Regulation by extracellular glucose concentration,cyclic mechanical strain,and transforming growth factor-beta1. J Biol Chem,2000, 275(14):9901-9904.
23 Dolan V,Murphy M,Sadlier D,et al.Expression of gremlin,a bone morphogenetic protein antagonist,in human diabetic nephropathy.Am J Kidney Dis,2005,45(6):1034 -1039.
24 Zhang Q,Shi Y,Wada J,et al.In vivo delivery of Gremlin siRNA plasmid reveals therapeutic potential against diabetic nephropathy by recoveringbone morphogenetic protein-7.PLoS One,2010,5(7):e11709.
