IgA肾病合并线粒体病
2012-05-10曾彩虹刘志红
黄 倩 曾彩虹 刘志红
病史摘要
病史 16岁女性,因“浮肿、尿检异常2年半”于 2009-12-07 入院。
患者2007年5月无明显诱因出现颜面及双下肢水肿,无尿量减少及肉眼血尿,当地医院查尿蛋白3+,诊断为肾病综合征(NS),予泼尼松60 mg/隔日及双嘧达莫口服,半月后尿检转阴,于2009年6月停用激素。2009-09-25无诱因双下肢水肿再现,查尿蛋白3+,隐血阴性,血白蛋白(Alb)22.7 g/L,血脂升高,肾功能正常,服中药汤剂6周(成分不详),水肿无改善。近一周腹胀明显,尿量减少(约300 ml/d),B超示大量腹水。病程中无高血压、光过敏、关节痛、口腔溃疡及贫血,无胸闷、气短,精神、饮食欠佳,睡眠尚可,大便正常。
既往史、家族史:早产6周,学习成绩不佳,发育较同龄人差。
体格检查 体温 36.5℃,脉搏90次/min,呼吸20次/min,血压105/60 mmHg,颜面水肿,咽部无红肿,双肺呼吸音清,未闻及干、湿性啰音,心脏听诊未及杂音,腹膨隆,移动性浊音阳性,全腹无压痛及反跳痛,肝、脾肋下未及,腰骶部及双下肢重度水肿。
实验室检查
血常规 Hb 12.5 g/L,WBC 9.8 ×109/L,N/L60%/26%,PLT 269×109/L。
尿液 尿蛋白定量5.96 g/24h,尿沉渣红细胞计数1 万/ml,α2 巨球蛋白20 mg/L,C3 26 mg/L;尿视黄醇结合蛋白(RBP)0.49 mg/L,N-乙酰-β-D-氨基葡萄糖苷酶(NAG)4.6 U/(g·Cr),溶菌酶(Lyso)<0.5 mg/L,尿渗量478 mOsm/(kg·H2O)。
血生化 Alb 19.2 g/L,Glo 19.5 g/L,BUN 4.24 mmol/L,SCr 64.5 μmol/L,UA 293 μmol/L,胱抑素 C 1.19 mg/L,ALT 7 U/L,AST 22 U/L,总胆固醇12.99 mmol/L,三酰甘油 4.62 mmol/L,K+4.58 mmol/L,Na+139.1 mmol/L,Cl-105.3 mmol/L,TCO225.5 mmol/L,Ca2+1.86 mmol/l。C反应蛋白 0.1 mg/L。糖化血红蛋白5.2%.
免疫球蛋白及自身抗体 ANA、A-dsDNA、血抗体谱、抗磷脂抗体谱IgM、IgA、IgG均阴性。补体C3 0.8 g/L,C4 0.1 g/L。IgG 1.28 g/L,IgA 1.01 g/L,IgM 1.34 g/L,IgE >1 000 IU/ml,抗链球菌溶血素“O”(ASO)30.1 IU/ml,类风湿因子(RF)<20 IU/ml。乙型肝炎、丙型肝炎、梅毒及艾滋抗体检测均阴性。
其他 外周血淋巴细胞亚群 CD4+706个/μl,CD8+743 个/μl,CD3+1 493 个/μl,CD20+121 个/μl,CD25+调节性T细胞25个/μl。
双肾B超 左肾101 mm×37 mm×50 mm,右肾100 mm×36 mm×50 mm,双肾皮质厚度不清,轮廓规则,包膜连续完整。双肾内未见肾盂肾盏扩张。
辅助检查 (1)窦性心律;(2)T波改变。胸片、电测听及眼底检查正常。
肾活检
光镜 15个肾小球,毛细血管袢开放尚好,少数内皮细胞成对,偶见浸润细胞,节段系膜区轻度增宽(图1A、B),节段壁层上皮细胞增生,见小管反流,球囊壁增厚。PASM-Masson:未见明显嗜复红物沉积。肾小管间质急性病变轻度,灶性小管上皮细胞刷状缘脱落(图1C),较多小管上皮细胞浊肿、细颗粒样变性,间质偶见单个核细胞小灶性分布,偶见小管炎。肾小动脉平滑肌细胞空泡变性。
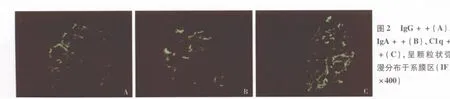
免疫荧光 肾小球4个,IgG++(图2A)、IgA++(图2B)、C1q++(图2C),呈颗粒状弥漫分布于系膜区。IgM、C3阴性。Ⅳ型胶原α3、α5链染色肾小球基膜、肾小管基膜均正常。肾小球外周袢podocin表达正常,呈现颗粒状分布。

电镜 观察1个肾小球,系膜区增宽,系膜细胞增生,基膜样物质增多(图3A),系膜区见中~高电子密度的致密物(图3B)。肾小球毛细血管袢开放差,数处被成对的内皮细胞堵塞,节段袢腔内见淋巴细胞,尚开放的肾小球毛细血管袢腔内见红细胞,偶见内皮细胞胞质连拱状及内皮细胞吞饮,基膜厚约339~719 nm。肾小球足细胞足突广泛融合(图3C),大量微绒毛化,胞质内见扩张的内质网及大的吞噬性溶酶体。肾小球基膜膜上及内皮下未见电子致密物沉积。
小结:符合IgA肾病(IgAN)(微小病变型)。
诊治经过 患者入院后肾活检诊断为IgA肾病(微小病变型),予足量激素诱导,出院随访1月时复查尿检转阴,激素规律减量。2011年8月13日患者于上感后出现水肿、尿少及纳差,并出现胸闷、呼吸困难,胸片示左侧胸腔积液伴肺部不张,再次收入我科。
住院期间患者反复发作心律失常及癫痫,并且出现四肢肌力下降。至此,患者临床表现出现极大的改变,表现为多系统和器官损害,包括神经系统病变、骨骼肌受累、糖尿病及听力下降,临床医师开始怀疑是否存在线粒体病的可能。此时对于患者肾活检电镜标本重切观察,发现在少量肾小管上皮胞浆内可见异常线粒体。而该患者最终通过血白细胞基因检测,发现8969位点碱基因突变(8969G>A),最终患者诊断为线粒体病。
讨 论
微小病变型IgAN以光镜下肾小球基本正常、免疫荧光典型IgA系膜区沉积及电镜观察肾小球足细胞足突融合为特点。国外文献报导此类型IgAN发病率较高,占同期 NS的 48%,国内报导为42.9%[1]。该患者肾活检病理光镜、免疫荧光及电镜观察均符合微小病变型IgAN,其特点包括:(1)光镜下肾小球病变较轻,仅见节段轻度系膜增生,肾小管间质急性病变,灶性小管上皮细胞刷状缘脱落,见细颗粒变性;(2)免疫荧光示IgA系膜区沉积;(3)电镜证实除肾小球系膜区电子致密物沉积外,尚见肾小球足细胞足突广泛融合,胞质大量微绒毛化。结合患者临床表现为NS,且激素治疗有效的特点,当时诊断为微小病变型IgAN。

然而,患者2011年NS复发,并出现多系统损害,促使临床医师怀疑到线粒体病的可能。线粒体病是由于线粒体结构和功能异常导致的一组疾病,临床表现多样化,可累及全身多个系统。可通过血白细胞基因检测及受累组织活检来明确诊断。肌肉组织易获取,因而骨骼肌受累患者可行肌肉活检明确诊断,在肌纤维中可见破碎红纤维(raggedred fiber,RRF)[2-5]。该患者正是通过白细胞基因检测发现线粒体基因突变,从而明确诊断。但由于线粒体病也可累及肾脏,因此也带来了疑问,该患者的肾脏损害是否与线粒体病相关。
回顾该患者的肾活检诊断经过,肾活检时患者尚未出现多系统损害,仅表现为NS,超微结构观察肾小球足细胞足突广泛融合,但并未见胞质内异常线粒体。因为病理与临床符合,而忽略了其他因素的可能,因而对于肾小管间质尤其是小管上皮细胞的线粒体观察的不够仔细。后在确诊线粒体病时,再次重切电镜标本仔细观察,其足细胞仍未见明显异常线粒体,但在少部分肾小管上皮细胞胞质中可见异常线粒体,线粒体形态、大小各异,有的线粒体中部向内凹陷,但线粒体嵴排列尚好。
相比骨骼肌和中枢神经系统损伤,人们对于线粒体病肾损害了解较少。既往文献多见于儿童患者,主要导致肾小管功能损伤,如范可尼综合征(Fanconi syndrome)、Batter综合征及肾小管酸中毒等,一些散发的病例表现为原发性肾小球损害。光镜下主要表现慢性肾小管间质损伤,电镜观察可在肾小球足细胞或(和)近端肾小管上皮细胞胞浆内见到异常线粒体的蓄积(线粒体肿胀,线粒体嵴减少或消失)[6-9]。
近年来文献陆续报导了成人的线粒体病,与儿童患者不同,成人在组织学上主要表现为肾小球病变。Guéry等[2]在2003年总结了既往报导的24例A3243G mtDNA突变的线粒体病,19例行肾活检,其病理改变包括:(1)14例为光镜表现为局灶节段性肾小球硬化(FSGS),但光镜下并不能区分A3243G mtDNA相关的FSGS及原发的FSGS。电镜下部分病例可见肾小球足细胞内胞质内异常线粒体的蓄积(包括线粒体形态、大小及线粒体嵴的改变),作者推测这种异常线粒体可能是 A3243G mtDNA突变线粒体病的特异病征。在系膜细胞及内皮细胞中未见类似改变。(2)Doleris等[10]描述了一种小动脉肌细胞坏死、点状透明变性的特异改变,但在其他文献中均未见报导。(3)3例表现为与FSGS不相关的非特异性慢性小管间质改变,可见近端及远端小管萎缩。超微结构观察在肾小管上皮细胞胞质中可见异常线粒体蓄积。2011年,Emma等[11]指出,线粒体病肾脏受累者仅少数患者的肾足细胞或(和)肾小管上皮细胞中可见异常线粒体蓄积,多数患者并未观察到类似改变。
该患者临床线粒体病诊断明确,又存在肾脏损害,且病理上可见肾小管上皮细胞胞质内异常线粒体的蓄积,从疾病一元化解释来说,可以考虑为线粒体所致的肾脏疾病。但需要注意的是:(1)肾脏疾病诊断并不能单纯依赖于病理,也需要结合临床考虑。该患者初始治疗及复发后足量激素诱导治疗均有效,而从线粒体病的发病机制来说,是由于线粒体结构及功能异常所致疾病,激素治疗不可能使病情得到改善,文献中对此也有报道[12,13]。(2)仔细分析肾活检组织学及超微结构学,也有与典型线粒体病肾脏损害相悖之处。线粒体病肾脏受累者光镜下肾小球表现为FSGS,肾小管间质慢性改变多见;但该例患者肾小球未见节段硬化病变,并且有免疫复合物沉积,而肾小管间质主要表现为急性病变。虽然超微结构观察到肾小管上皮细胞胞浆中异常线粒体的蓄积,但众所周知,线粒体DNA环是裸露的,不似核DNA有组蛋白保护,且纠错能力差,本身易发生变异,在受到各种刺激后也容易出现损伤。肾小管上皮细胞的线粒体损害可以继发于其他多种原因,如Ⅰ型酪氨酸血症、药物(异磷酰胺)、有毒物质尤其是重金属(如镉)[14-16]。而且从线粒体形态上无法区分其损伤原因。因此,该例患者虽然肾小管上皮细胞胞质中可见肿胀且大小、形态各型的线粒体,但并不足以明确其肾脏损害与线粒体病相关。
前文已述,基因位点筛选除了应用血液白细胞外,尚可用受累组织标本检测并分析其异质率。根据Guéry等对于A3243G位点突变线粒体病患者的检测发现,血液白细胞中线粒体的异质率在5%~25%,但不能预测肾脏是否受累,而肾脏标本检测异质率在55% ~66%[2,10]。对于该患者,最确切的方法是对其肾脏组织标本进行基因位点筛选及异质率检测,如果确实存在与白细胞相同的位点突变,且异质率可达文献所报导的范围,才可以明确肾脏病变与线粒体病相关。
该患者也能以二元论来解释:(1)线粒体病诊断明确;(2)肾小球病变与线粒体病无关,是在IgAN(微小病变型)基础上伴有不明确原因导致的肾小管上皮细胞线粒体损害。正如前文所述,我们更倾向于IgAN合并线粒体病的诊断。
通过这个病例,提醒我们在观察肾小球病变的同时,也需要关注肾小管病变,对于一些特定疾病的诊断是非常有意义的。另外需要指出的是,1997年,Jansen等[17]报导糖尿病人群中A3243G突变的检出率在1%。甚至有文献报导少数线粒体患者由于肾脏疾病伴有听力损伤而被误诊为Alport综合症[18]。线粒体病的发生率可能比目前报道的更高,这也提醒我们在临床诊疗过程中应重视其他系统损害的意义,警惕线粒体病的可能。
1 张希然,王庆文,陈惠萍等.微小病变样IgA肾病的临床病理特征及激素疗效分析.肾脏病与透析肾移植杂志,2011,20(2):109-113.
2 Guéry B,Choukroun G,Noël LH,et al.The spectrum of systemic involvement in adults presenting with renal lesion and mitochondrial tRNA(Leu)genemutation.JAm SocNephrol,2003,14(8):2099-2108.
3 Zeviani M,Carelli V.Mitochondrial disorders.Curr Opin Neurol,2007,20(5):564 -571.
4 McFarland R,Turnbull DM.Batteries not included:diagnosis and management of mitochondrial disease.J Intern Med,2009,265(2):210-228.
5 McFarland R,Taylor RW,Turnbull DM.Mitochondrial disease—its impact,etiology,and pathology.Curr Top Dev Biol,2007;77:113-155.
6 Niaudet P,Rotig A.The kidney in mitochondrial cytopathies.Kidney Int,1997,51(4):1000 -1007.
7 Kuwertz-Bröking E,Koch HG,Marquardt T,et al.Renal Fanconi syndrome:first sign of partial respiratory chain complex IV deficiency.Pediatr Nephrol,2000,14(6):495 -498.
8 Mochizuki H, Joh K, Kawame H, et al. Mitochondrial encephalomyopathies preceded by de-Toni-Debré-Fanconi syndrome or focal segmental glomerulosclerosis. Clin Nephrol, 1996, 46(5):347-352.
9 Hameed R,Raafat F,Ramani P,et al.Mitochondrial cytopathy presenting with focal segmental glomerulosclerosis,hypoparathyroidism, sensorineural deafness, and progressive neurological disease.Postgrad Med J,2001,77(910):523 -526.
10 Doleris LM,Hill GS, Chedin P,et al.Focal segmental glomerulosclerosis associated with mitochondrial cytopathy.Kidney Int,2000,58(5):1851 -1858.
11 Emma F,BertiniE,SalviatiL,etal.Renalinvolvementin mitochondrial cytopathies.Pediatr Nephrol,2012,27(4):539 - 550.
12 Hotta O,Inoue CN,Miyabayashi S,et al.Clinical and pathologic features of focal segmental glomerulosclerosis with mitochondrial tRNALeu(UUR)gene mutation.Kidney Int, 2001, 59(4):1236-1243.
13 Löwik MM,Hol FA,Steenbergen EJ,et al.Mitochondrial tRNALeu(UUR)mutation in apatientwith steroid-resistantnephrotic syndrome and focalsegmentalglomerulosclerosis.NephrolDial Transplant,2005,20(2):336 - 441.
14 Endo F,Sun MS.Tyrosinaemia type I and apoptosis of hepatocytes and renal tubular cells.J Inherit Metab Dis,2002,25(3):227 -233.
15 Nissim I, Horyn O, Daikhin Y, et al.Ifosfamide-induced nephrotoxicity:mechanism and prevention.Cancer Res,2006,66(15):7824-7831.
16 Thévenod F.Nephrotoxicity and the proximal tubule.Insights from cadmium.Nephron Physiol,2003,93(4):p87 -93.
17 Jansen JJ,Maassen JA,van der Woude FJ,et al.Mutation in mitochondrial tRNA(Leu(UUR))gene associated with progressive kidney disease.J Am Soc Nephrol,1997,8(7):1118 -1124.
18 Cheong HI,Chae JH,Kim JS,et al.Hereditary glomerulopathy associated with a mitochondrial tRNA(Leu)gene mutation.Pediatr Nephrol,1999,13(6):477 -480.
