磷酸化蛋白质组学在生命科学研究中的机遇与挑战
2012-05-10徐长亮综述刘志红审校
徐长亮 综述 刘志红 审校
在对疾病发病机制、诊断、生理功能及药物开发研究中,往往需要获取一些高通量、大样本、全局性数据,通过整体化系统性分析,从中寻找线索,推断可能的病因以及诊断靶标,由此诞生了诸如基因组学、蛋白质组学及代谢组学等建立在网络架构式研究思路基础上多种新的研究方法和理论。磷酸化蛋白质组学,以其研究对象特殊性、研究方法专业性及研究思路系统性,已在生命科学的多个领域和层面发挥独特作用。
磷酸化蛋白质组学的研究尚处于初期阶段,鉴于其特殊的研究方法及内容,对揭示生命体尤其是疾病状态下细胞信号传导具有不可替代的优势[1-4]。此外,磷酸化蛋白质组学的研究为寻找药物新的作用靶点和疾病诊断指标提供全新的研究思路。本文主要就磷酸化蛋白质组学在生命科学、药学及医学研究前景进行综述。
磷酸化蛋白质组学概述
磷酸化是细胞中蛋白质翻译后最重要修饰形式之一,由蛋白激酶及磷酸酶参与,通过对蛋白底物可逆性磷酸化及去磷酸化调控生理过程,该过程高度保守。
磷酸化蛋白质组学是研究蛋白质磷酸化过程的科学,包括氨基酸残基磷酸化程度及细胞受刺激后动态的蛋白磷酸化事件。蛋白质磷酸化是细胞内信号传导的关键性调控机制,几乎参与细胞所有的生物学事件及细胞调控过程(如细胞周期、受体介导的信号传导、细胞分化、细胞增生、细胞代谢等)。磷酸化蛋白质组学正是利用电泳技术和质谱相结合的手段实现对整个细胞中磷酸化蛋白的磷酸化程度进行监控的一种研究方法。
在信号传导过程中,蛋白质磷酸化通常扮演信号级联开关的角色。一方面,受体蛋白酪氨酸激酶介导的细胞内信号转导,可启动时间依赖性细胞内酪氨酸磷酸化,该过程对其他衔接蛋白或者其他信号分子如蛋白激酶和磷酸化酶重新修饰,将信号传导至下一级信号分子[5-8]。另一方面,蛋白磷酸化对细胞内信号传导的衰减和终止同样起重要作用,该控制系统失衡可能导致肾脏、心血管、自身免疫等多种疾病和肿瘤[9,10]。
尽管可用磷酸化位点特异性抗体通过普通或二维凝胶电泳检测蛋白磷酸化,但识别新的磷酸化蛋白,尤其是寻找新磷酸化位点的过程更具挑战性。除了检测磷酸化丰度及位点,定量动态地研究磷酸化事件对于认识细胞信号转导通路也极其重要。另外,精密调控激酶和磷酸酶活性可导致相关信号蛋白磷酸化水平发生微妙变化。某些信号蛋白的磷酸化不仅存在动态变化,而且在细胞中还呈空间分布特点。与此同时,细胞内某些信号传导蛋白磷酸化程度更多取决于外界刺激,如信号分子、药物和机械压力等。
因而,磷酸化蛋白质组学通过系统的回溯性研究,更加准确和快速寻找激酶或磷酸化酶的源头作用,然后结合经典的生物学方法进行验证,快捷地探索各种未知的生命奥秘。与此同时,随着其他基础学科的发展与进步,新技术、新仪器的不断使用,磷酸化蛋白质组学研究也朝着更具特异性、再现性、重复性、灵敏性及精确性的方向发展[11]。
生物学领域
图1 磷酸化蛋白质组学的发展趋势[13]
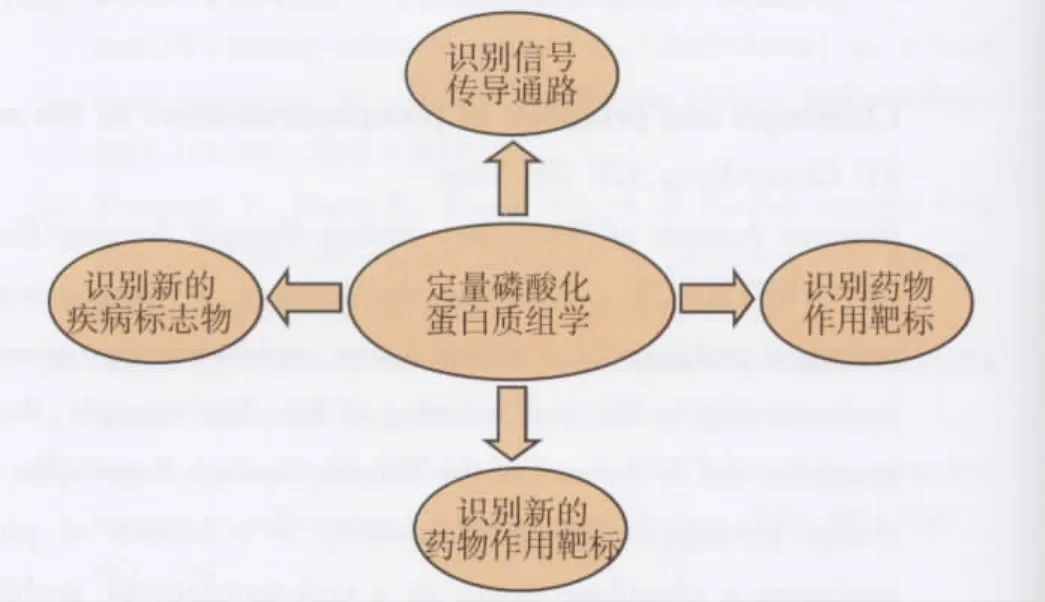
图2 磷酸化蛋白质组学的应用
蛋白磷酸化在生命各个环节甚至在整个生命科学均起重要作用。截至2012年7月,Pubmed收录关于磷酸化的文献已经超过16万篇,其中绝大多数涉及蛋白磷酸化。由于蛋白磷酸化研究的重要性,出现了跳出传统经典生物学,引申自“鸟枪法”为研究思路的磷酸化蛋白质组学。
磷酸化蛋白质组学,是一种基于全细胞内蛋白为研究靶标,全蛋白水平扫描不同蛋白的磷酸化程度,寻找新的磷酸化蛋白及新磷酸化位点,不断完善蛋白磷酸化体系,具有全面、可靠、高效及探索性的特点。首先,磷酸化蛋白质组学以整个细胞所有蛋白为研究对象,研究内容囊括了细胞内所有具有生命功能的蛋白,如细胞增生、细胞周期、有丝分裂、细胞分化等所有相关蛋白,因而研究更为全面。其次,磷酸化蛋白质组学研究基于全蛋白水平,因此其结果更具普遍性,而经典生物学研究蛋白磷酸化往往针对特定条件,以两个或多个蛋白之间的相互作用为出发点,具有相当局限性,缺乏整体认识,而磷酸化蛋白质组学可一次性全面检测不同蛋白激酶及磷酸化酶对同一个蛋白磷酸化程度的影响,因而结果更加可靠。再则,一次蛋白质组学试验可同时考虑蛋白磷酸化相关多个变量,了解同一时刻整个系统的变化。经典生物学方法则只是了解单个研究变量(即目的变量),不能反映细胞内真实情况,逐步增加研究变量并借助更加复杂的研究系统,从而增加了研究的复杂性及不确定性,缺乏可重复性和真实性。磷酸化蛋白质组学反映的是细胞内真实发生的事件,在一次试验中考虑了各种变量,克服了经典生物学中逐步添加变量的缺陷,更为高效。最后,由于磷酸化蛋白质组学以细胞内全部蛋白质为研究对象,更易发现未知的新磷酸化位点及磷酸化蛋白。另外,结合经典细胞生物学的知识,剔除已知蛋白激酶或者磷酸化酶影响,可发现新的具有磷酸化或去磷酸化功能的酶。
药学领域
古人云“一石激起千层浪”,药物就类似一块石头,当其进入体内或作用于细胞后,其产生的各种生理效应,就像“千层浪”一般,扩散至整个细胞甚至全身。如何找到药物的作用机制,解答这种具有系统复杂性的问题,经典实验生物学方法往往是从某个点出发,然后通过不同的技术手段,不同的细胞信号传导通路,不同的细胞生理活动,希望通过还原论的观点,以线性联系,一步步推导出药物作用的靶点,阐述药物作用的机制[12]。由于各学科不断发展,虽然产生了诸如分子模拟、同位素标记、亲和层析等新技术,以初步筛选、缩小研究范围,但往往以点代面,必然会导致许多假阳性或者假阴性结果。因而,就需要一种新的试验方法,全局性的观察新问题。由此,便产生了一门新的药理学科——网络药理学。目前,网络药理学已经被广泛的用于识别潜在的药物靶点、预测其未知的适用范围甚至检测某些毒副反应。适用范围较传统药理学更大。由于蛋白的磷酸化在细胞生理功能及信号传导通路的调控中极其重要,目前许多药物靶目标都是与蛋白磷酸化相关的酶类,因此很多药物的作用靶点都是这一类酶。磷酸化蛋白质组学,由于其全蛋白质组水平的磷酸化位点检测的“网络研究”特点,因此克服了传统还原论“线性研究”缺陷,并结合已知的细胞生物学相关的知识,可更加快捷准确的发现药物作用的潜在靶点,甚至做多靶点的预测,将更好地揭示药物作用机制[13-15]。因此,磷酸化蛋白质组学由于其自身的特点,必将成为网络药理学的一种重要的研究手段。
医学领域
随着社会的进步,人们对生活质量的追求也越来越高,需要威胁生命健康的各种疾病有更多更全面的认识。随着医疗理念的进步,从传统的重治疗轻预防转变为预防治疗并重。随着预防医学的发展和完善,不同疾病的早期生物靶标的寻找及鉴定已经成为医学工作的重要任务。
磷酸化蛋白质组学对疾病生物靶标,尤其磷酸化蛋白的生物靶标的寻找具有不可替代的优势[16-23]。在各种疾病发病过程及药物研究中起重要作用。因此,通过比较患者和正常人组织细胞代谢物中不同的蛋白磷酸化丰度,对于筛选疾病的诊断标志物或者预后标志物具有相当重要的价值。同时,由于蛋白磷酸化是一个高度动态的过程,其对疾病治疗药物的使用也非常敏感,在个体化医疗的不断发展与完善,对患者的磷酸化蛋白的研究可以更好的指导临床医生对临床用药的选择。
目前,在肾脏病领域,磷酸化蛋白质组学的研究已经取得长足的发展,对于研究各种激素及细胞因子对肾脏功能的改变发挥重要的推动作用。例如,通过磷酸化蛋白质组学方法,研究加压素对髓袢升支粗段细胞、肾小管上皮细胞及集合管功能的影响[24-30]。另外也有研究涉及血管紧张素Ⅱ及转化生长因子β(TGF-β)所导致的肾小管上皮细胞功能及上皮间质转化的影响[31-35]。同时,由于肾脏疾病可通过尿液监测,因此Gonzales等[36]通过尿液外泌体磷酸化蛋白质组分析发现,多个新的蛋白磷酸化位点,其中包括噻嗪敏感性钠氯共转运体(NCC)serine-811的磷酸化位点这一个潜在生物靶标。另外,已有研究发现水通道蛋白2(AQP2)的serine-256的磷酸化位点,而通过对该位点的磷酸化程度的检测,可评估加压素的活性程度,进而监测疾病的进程[37]。
因而,磷酸化蛋白质组学对疾病生物靶标的寻找,个性化治疗方案的制定以及疾病进展的监测必将发挥更加重要的作用。
磷酸化蛋白质组学存在的问题
蛋白磷酸化在细胞内通信中发挥极其重要生理功能,并在生命信号网络中起着信号传导级联放大的作用。参与细胞中多种生理过程,如细胞周期进程,细胞新陈代谢,细胞与细胞间的交流与沟通,并作出适当反应,对了解和监控蛋白磷酸化意义重大。因此,磷酸化蛋白质组学便顺理成章的成为研究蛋白磷酸化最强有力的武器。由于磷酸化蛋白在生理活动中所处的重要的地位,决定了磷酸化蛋白的丰度相对不足。为了解决这个问题需要从两方面考虑:一是,提高仪器自身的灵敏度;二是,富集磷酸化蛋白。目前设备的功能尚不能满足对生物样本中极微量磷酸化蛋白分析的要求。因此,富集磷酸化蛋白肽段或体液样品的就显得尤为关键。目前,已经有多种磷酸化蛋白富集方法,但都有不足之处。例如,特异性蛋白抗体免疫沉淀法,由于所用抗体对丝氨酸、苏氨酸特异性较差,目前主要用于检测酪氨酸磷酸化的蛋白质组学研究。又如,固定金属亲和色谱层析法,虽然克服了免疫沉淀法的部分缺点,但可能会丢失一些低丰度未结合到层析柱的磷酸化肽段,但对多磷酸化的蛋白由于具有较强的亲和力的蛋白却很难被洗脱下来,同时柱上也会结合某些酸性基团、电子供体也会结合到柱上,造成非磷酸化的污染。
另外,由于磷酸化蛋白质组学是基于质谱的研究,因而磷酸化肽段的序列分析和磷酸化位点的精确定位成为该研究的一个难点,因为磷酸化肽段与非磷酸化肽段在质谱分析中先有不同的碎裂性。常规的数据分析处理软件主要针对非修饰肽段进行研究,当使用于磷酸化肽段进行处理时,其对序列分析的准确性、灵敏度以及磷酸化位点鉴定的准确性都具有很大的局限性。
最后,由于仪器、试剂和样品的特殊性,磷酸化蛋白质组学研究要求消耗巨大的经费和资源。由于磷酸化蛋白在细胞总蛋白中的丰度较低,只占总蛋白的10%的样品来源相对较难。因此每次实验样本,需要提取大量的蛋白,一方面增加了实验本身的系统误差;另一方面也增加了人力消耗。其次,磷酸化蛋白的标记成本较高,由于目前广泛使用的iTRAQ法灵敏度高,但是该法所需要的试剂价格昂贵。另外,为了保证尽量覆盖所有蛋白谱,往往需要根据电荷情况将磷酸化蛋白样品重新分布,而每一个组分都要作为一个单独样品,单独标记,进一步增加了研究的经费投入。
小结:磷酸化蛋白质组学研究处于初级阶段,尚有诸多不足之处,但是随着研究的不断开展,实验技术的不断成熟,仪器设备不断更新,我们有理由相信磷酸化蛋白质组学必将在未来的生命科学研究中发挥越来越重要的作用。
1 Macek B,Mann M,Olsen JV.Global and site-specific quantitative phosphoproteomics:principles and applications.Annu Rev Pharmacol Toxicol,2009,49:199 -221.
2 Schreiber TB,M usbacher N,Breitkopf SB,et al.Quantitative phosphoproteomics--an emerging key technology in signal-transduction research.Proteomics,2008,8(21):4416 -4432.
3 Chen WG,White FM.Proteomic analysis of cellular signaling.Expert Rev Proteomics,2004,1(3):343 -354.
4 Morandell S,Stasyk T,Grosstessner-Hain K,et al.Phosphoproteomics strategies for the functionalanalysis of signal transduction.Proteomics,2006,6(14):4047 -4056.
5 Dengjel J,Akimov V,Olsen JV,et al.Quantitative proteomic assessment of very early cellular signaling events.Nat Biotechnol,2007,25(5):566 -568.
6 Verano-Braga T,Schwämmle V,Sylvester M,et al.Time-Resolved Quantitative Phosphoproteomics:New Insights into Angiotensin-(1-7)Signaling Networks in Human Endothelial Cells.J Proteome Res,2012[Epub ahead of print].
7 Chumbalkar V,Latha K,Hwang Y,et al.Analysis of phosphotyrosine signaling in glioblastoma identifies STAT5 as a novel downstream target of ΔEGFR.J Proteome Res,2011,10(3):1343 -1352.
8 Semenov A,Goldsteins G,Castrén E.Phosphoproteomic analysis of neurotrophin receptor TrkB signaling pathways in mouse brain.Cell Mol Neurobiol,2006,26(2):163 -75.
9 Larive RM,Urbach S,Poncet J,et al.Phosphoproteomic analysis of Syk kinase signaling in human cancer cells reveals its role in cell-cell adhesion.Oncogene,2009,28(24):2337 -2347.
10 Solit DB,Mellinghoff IK. Tracing cancer networks with phosphoproteomics.Nat Biotechnol,2010,28(10):1028 - 1029.
11 Wang F,Song C,Cheng K,et al.Perspectives of comprehensive phosphoproteome analysis using shotgun strategy.Anal Chem,2011,83(21):8078-8085.
12 刘志红,黎磊石.系统生物学——推动肾脏病临床研究的新动力.肾脏病与透析肾移植杂志,2005,14(1):1-2.
13 Yan GR,Yin XF,Xiao CL,et al.Identification of novel signaling components in genistein-regulated signaling pathways by quantitative phosphoproteomics.J Proteomics,2011,75(2):695 -707.
14 Weber C,Schreiber TB,Daub H.Dual phosphoproteomics and chemical proteomics analysis of erlotinib and gefitinib interference in acute myeloid leukemia cells.J Proteomics,2012,75(4):1343 -1356.
15 Pan C,Olsen JV,Daub H,et al.Global effects of kinase inhibitors on signaling networks revealed by quantitative phosphoproteomics.Mol Cell Proteomics,2009,8(12):2796 -2808.
16 Lim YP.Mining the tumor phosphoproteome for cancer markers.Clin Cancer Res,2005,11(9):3163 -3169.
17 Stern DF.Phosphoproteomics for oncology discovery and treatment.Expert Opin Ther Targets,2005,9(4):851 -860.
18 Yu LR,Issaq HJ,Veenstra TD.Phosphoproteomics for the discovery of kinases as cancer biomarkers and drug targets.Proteomics Clin Appl,2007,1(9):1042 -1057.
19 Metodiev M,Alldridge L.Phosphoproteomics:A possible route to novel biomarkers of breast cancer.Proteomics Clin Appl,2008,2(2):181 -194.20 Younossi ZM,Baranova A,Stepanova M,et al.Phosphoproteomic biomarkers predictinghistologicnonalcoholic steatohepatitisand fibrosis.J Proteome Res,2010,9(6):3218 -3224.
21 Brewis IA,Brennan P.Proteomicstechnologiesforthe global identification and quantification of proteins.Adv Protein Chem Struct Biol,2010,80:1 - 44.
22 Lim YP,Diong LS,Qi R,et al.Phosphoproteomic fingerprinting of epidermal growth factor signaling and anticancer drug action in human tumor cells.Mol Cancer Ther,2003,2(12):1369 -1377.
23 Li J,Rix U,Fang B,et al.A chemical and phosphoproteomic characterization of dasatinib action in lung cancer.Nat Chem Biol,2010,6(4):291 -299.
24 Gunaratne R,BrauchtDW,Rinschen MM,etal.Quantitative phosphoproteomic analysis reveals cAMP/vasopressin-dependent signaling pathways in native renal thick ascending limb cells.Proc Natl Acad Sci U S A,2010,107(35):15653 -15658.
25 HoffertJD,Pisitkun T,Knepper MA.Phosphoproteomics of vasopressin signaling in the kidney.Expert Rev Proteomics,2011,8(2):157-163.
26 Bansal AD,Hoffert JD,Pisitkun T,et al.Phosphoproteomic profiling reveals vasopressin-regulated phosphorylation sites in collecting duct.J Am Soc Nephrol,2010,21(2):303 -315.
27 Hoffert JD,Wang G,Pisitkun T,et al.An automated platform for analysis of phosphoproteomic datasets:application to kidney collecting duct phosphoproteins.J Proteome Res,2007,6(9):3501 -3508.
28 Bolger SJ, Hurtado PA, Hoffert JD, et al. Quantitative phosphoproteomics in nuclei of vasopressin-sensitive renal collecting duct cells.Am J Physiol Cell Physiol,2012,303(10):C1006 -1020.
29 Rinschen MM,Yu MJ,Wang G,et al.Quantitative phosphoproteomic analysis reveals vasopressin V2-receptor-dependent signaling pathways in renal collecting duct cells.Proc Natl Acad Sci U S A,2010,107(8):3882-3887.
30 Hasler U,Nunes P,Bouley R,et al.Acute hypertonicity alters aquaporin-2 trafficking and induces a MAPK-dependent accumulation at the plasma membrane of renal epithelial cells.J Biol Chem,2008,283(39):26643-26661.
31 Li XC,Zhuo JL.Phosphoproteomic analysis of AT1 receptor-mediated signaling responses in proximal tubules of angiotensin II-induced hypertensive rats.Kidney Int,2011,80(6):620 -632.
32 Zhao B,Knepper MA,Chou CL,et al.Large-scale phosphotyrosine proteomic profiling of rat renal collecting duct epithelium reveals predominance of proteins involved in cell polarity determination.Am J Physiol Cell Physiol,2012,302(1):C27 -45.
33 Chen YX,Li Y,Wang WM,et al.Phosphoproteomic study of human tubular epithelial cell in response to transforming growth factor-beta-1-induced epithelial-to-mesenchymal transition.Am J Nephrol,2010,31(1):24-35.
34 Hoorn EJ,Pisitkun T,Yu MJ,et al.Proteomic approaches for the study of cell signaling in the renal collecting duct.Contrib Nephrol,2008,160:172-185.
35 Feric M,Zhao B,Hoffert JD,et al.Large-scale phosphoproteomic analysis of membrane proteins in renal proximal and distal tubule.Am J Physiol Cell Physiol,2011,300(4):C755 -770.
36 Gonzales PA,Pisitkun T,Hoffert JD,et al.Large-scale proteomics and phosphoproteomics of urinary exosomes.J Am Soc Nephrol,2009,20(2):363-379.
37 Hoffert JD,Pisitkun T,Wang G,et al.Quantitative phosphoproteomics ofvasopressin-sensitive renal cells:regulation of aquaporin-2 phosphorylation at two sites.Proc Natl Acad Sci U S A,2006,103(18):7159-7164.
